Введение. Изменение деятельности сердечно-сосудистой системы, в том числе сердечного ритма, является наиболее ярким индикатором отклонений, возникающих в регулирующих системах. Они предшествуют гемодинамическим, метаболическим, энергетическим нарушениям и могут быть наиболее ранними прогностическими признаками неблагополучия пациента [10, 17].
Одними из первых работ, доказавшими взаимосвязь между поражениями головного мозга и нарушениями ритма сердца, а также летальностью от сердечно-сосудистых заболеваний, включая внезапную сердечную смерть, стали исследования L. Reinstein, S. Lavy, J.R. Mikolich [18, 20, 23]. Одним из информативных методов изучения функционального состояния организма является метод исследования вариабельности ритма сердечного (ВРС) - вариационной кардиоинтервалометрии, достоинствами которого являются неинвазивность, высокая оперативность и информативность, простота и доступность получения исходной информации [6].
ВРС является способом изучения синусового сердечного ритма с применением современного математического анализа. Полученные данные указывают на активацию связей сердца и головного мозга при поражении центральной нервной системы (ЦНС). Это позволяет обсуждать сложное и многостороннее влияние мозгового поражения на функцию органов и систем, нарушение деятельности которых, в свою очередь, способно привести к срыву витальных функций и внезапной смерти [7, 8]. Сегодня исследование ВРС активно внедряется в клиническую практику. Установлена высокая информативность ВРС при диагностике полиневропатий, синкопальных состояний. Имеются разработки, позволяющие определить диагностическую значимость исследования ВРС и, в частности, спектрального анализа ритма сердца при гипертонической болезни, патологии щитовидной железы, невротических расстройствах, опухолях головного мозга, рассеянном склерозе, паркинсонизме и ряде других заболеваний [2-4, 9, 12, 14, 15, 21, 24, 25].
Хорошо известно, что интервал между циклами сердечных сокращений зависит от ритмической активности пейсмейкерных клеток синусового узла. В свою очередь ритмическая активность находится под нервным и эндокринным контролем, а также под влиянием ряда гуморальных факторов, изменяющих порог спонтанной деполяризации пейсмейкеров синусового узла. Последнее приводит, соответственно, к увеличению или уменьшению интервала между циклами сердечных сокращений и, следовательно, частота сердечных сокращений (ЧСС). Поэтому факторы, регулирующие ЧСС, будут определять и вариабельность сердечного ритма [3]. Распределение мощности и центральная частота каждого компонента не фиксированы, а могут варьировать в связи с изменениями автономных модуляций сердечного цикла [11, 16, 19].
Частотный анализ позволяет определить максимальную общую мощность спектра (TP), спектральные мощности высокочастотного (HF), низкочастотного (LF) и очень низкочастотного (VLF) компонентов (диапазон частот 0,15-0,35Hz, 0,05-0,15Hz и 0,004-0,05Hz, соответственно), а также соотношение (индекс) LF/HF. При этом, по мнению абсолютного большинства исследователей, HF характеризует тонус парасимпатического, а LF, индекс LF/HF и VLF - симпатического отдела вегетативной нервной системы [1, 13, 22].
Материалы и методика исследований. В исследовании приняло участие 43 больных поступивших на лечение в нейрохирургическое отделение Рязанской Областной клинической больницы (ОКБ) с диагнозом - опухоль головного мозга в возрасте от 22 до 70 лет, направление из Областной клинической поликлиники (ОКП) и районных больниц Рязанской области. Критерии включения в исследование: взрослые больные с опухолями головного мозга, находящиеся на лечении в нейрохирургическом отделении Рязанской ОКБ. Пациенты разделены на 2 группы в зависимости от наличия (1 группа) или отсутствия (2 группа) эпилептических приступов. Для исследования применялся анализ вариабельности сердечного ритма. У всех больных была выполнена пятиминутная запись кардиоинтервалограммы в 3 пробах: покоя (фон), гипервентиляция и после гипервентиляция. Использовался аппаратно-программный комплекс «Варикард 2.51» и программное обеспечение «Иским-6». Состояние вегетативной̆ нервной̆ системы и ее механизмов регуляции оценивались статистическими (ЧСС, среднеквадратическое отклонение - СКО, и показатель активности регуляторных систем - ПАРС), геометрическими (Мода - МО, вариационный размах - ВР, и индекс напряжения - ИН ), а так же спектральными характеристиками (ТР, НF, LF, VLF, LF/HF, индекс централизации - ИЦ и процентное отношение трех компонентов тотальной мощности НF (%HF), LF (%LF) и VLF (% VLF).
Cтатистический анализ проводился с помощью непараметрических методов математической статистики (U-критерий Манна-Уитни) Использовался пакет компьютерных программ Statistica10.0.
Результаты и их обсуждение. Проведен сравнительный анализ показателей ВРС у пациентов с опухолью головного мозга в зависимости от наличия эпилептических приступов. Результаты представлены в табл. 1.
Таблица 1. Показатели ВСР у больных с опухолями головного мозга
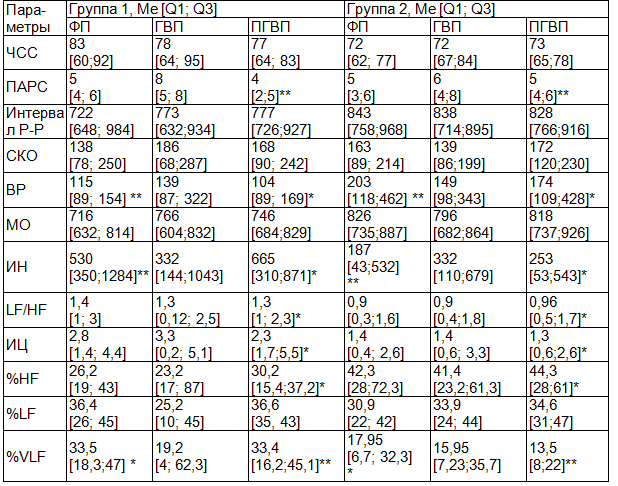
Примечание: значимость различий между двумя группами сравнивания: * - p<0,05; ** - p<0,01; ФП - фоновая проба; ГВП- гипервентиляционная проба; ПГВП - постгипервентиляционная проба.
У больных первой группы наблюдается высокий уровень ЧСС на всех исследуемых пробах, что отражает повышенную активность симпатического отдела вегетативной нервной системы по сравнению с больными второй группы, у которых выявлены преобладания парасимпатического отдела вегетативной нервной системы. Под влиянием симпатического нерва увеличивается ЧСС (стимуляция синусовый узла). Деятельность вегетативной нервной системы находится под постоянным влиянием центральной нервной системы и других гуморальных влияний. Повышенная активность симпатического отдела вегетативной нервной системы подразумевает напряжение вегетативной нервной системы раздражителем и является ответом на его воздействие.
У больных первой группы наблюдается уменьшение показателей Мо во всех исследуемых пробах, максимально 15,3%, (p<0,05) в фоновой пробе, по сравнению с больными второй группы, что отражает доминированное влияние симпатического отдела вегетативной нервной системы на сердечный ритм у больных первой группы. Мо отражает активность гуморальной регуляции сердечного ритма и уменьшается при доминировании симпатического отдела вегетативной нервной системы и возрастает при доминировании парасимпатического отдела вегетативной нервной системы.
Среднее квадратическое отклонение (СКО) - стандартная статистическая оценка вариабельности сердечного ритма (нормальное значение СКО от 40 до 80 мс), но имеет половые и возрастные различия. Особенность показателя заключается в том, что его уменьшение или увеличение может быть связано и с автономными и с центральными механизмами регуляции. Уменьшение СКО отражает преобладание симпатической регуляции (т.е. напряжение регуляторных систем). У больных первой группы наблюдается уменьшение СКО в фоновом исследовании и после гипервентиляции. В фазе гипервентиляции у больных первой группы наблюдается нарастание СКО по сравнению с исходным состоянием, что указывает на временное усиление автономной регуляции вследствие повышенного влияния гипервентиляции на сердечный ритм.
У больных первой группы наблюдается достоверное уменьшение показателей ВР на 76,5% (p<0,05) в фоновом состоянии и на 67,3% (p<0,05) после гипервентиляциии по сравнению с больными второй группы что отражает доминирование адренергических воздействий на сердечный ритм у больных первой группы в отличие от М-холинергических воздействий на ритм сердца у больных второй группы. Вариационный размах служит как показатель изменения продолжительности пульсовых интервалов и демонстрирует степень регуляции вегетативной нервной системы, точнее парасимпатического отдела вегетативной нервной системы. ВР уменьшается при доминировании симпатического воздействия на ритм сердца и возрастает при преобладании парасимпатического воздействия на ритм сердца.
ИН - индекс напряжения. Существует ряд интегральных показателей для измерения степени напряжения функциональных систем из показателей ВСР, и наиболее распространенный из них индекс напряжения регуляторных систем. Широко известно, что этот индекс теряет свое значение при физиологической нагрузке (в нашем исследовании - гипервентиляционная проба). Преобладание высокого уровня индекса напряжения у больных с опухолями головного мозга, протекающими с эпилептическим синдромом, обозначает, что адаптационные механизмы значительно напряжены и организм нуждается в высших отделах центральной нервной системы, т.к. автономная регуляция напряжена и не может обеспечить требуемый уровень адаптации. У физически здоровых взрослых ИН составляет 80-140 ед. и вырастает при увеличении симпатического тонуса и в целом отражает вегетативный гомеостаз. У больных первой группы наблюдается достоверное увеличение ИН на 64,8% (p<0,05) в фоновой пробе и на 62% (p<0,05) в гипервентиляционной пробе, что отражает увеличение симпатического тонуса вегетативной нервной системы по сравнению с больными второй группы.
ИЦ-индекс централизации, количественное отношение между центральным и автономным контролем регуляции сердечного ритма. Среднее абсолютное значение у здоровых людей от 0,7 до 1,5. ИЦ указывает на относительное усиление симпатического тонуса и его увеличение говорит о центральном управлении ритма сердца. У больных первой группы наблюдается достоверное увеличение ИЦ на 84% (p<0,05) после гипервентиляции, а также увеличение в фоновой и гипервентиляционной пробе по сравнению с больными второй группы, что отражает преобладание симпатической нервной системы и центральное управление у больных первой группы.
LF/HF - отношение мощности низких частот к мощности высоких частот и является взаимоотношением между симпатическими и парасимпатическими компонентами вегетативной нервной системы. Это соотношение получило широкое распространение как способ оценки сердечно-сосудистой автономной регуляции, где увеличение этого соотношения отражает преобладание симпатической нервной системы и наоборот. Симпатическое преобладание ведет к централизации контроля сердечного ритма. У больных первой группы наблюдается достоверное увеличение LF/HF на 37,5% (p<0,05) после гипервентиляции а также увеличение на 49,4% в фоновой и гипервентиляционной пробе по сравнению с пациентами второй группы, что говорит о значимой активации центральных механизмов регуляции (симпатикотония) и снижение автономных механизмов. Присутствие эпилептических синдромов у больных первой группы вызывает стресс адаптационных систем и это дорого обходится физиологическому механизму адаптации.
VLF характеризует влияние высших вегетативных центров на подкорковые центры и отражает состояние нейрогуморального и метаболического уровня регуляции и служит показателем степени связи автономных и корковых уровней регуляции. Измерение мощности VLF, LF и HF осуществляется в абсолютных единицах мощности (мс2), но здесь отображено процентное отношение трех компонентов тотальной мощности (TP), т.е. относительный вклад каждого из трех компонентов в пропорции к общей мощности. Высокочастотные колебания (HF) отражают преимущественное влияние парасимпатической системы и низкочастотные колебания (LF) отражают преобладание симпатического влияния на сердечный ритм. У больных первой группы наблюдается преобладание LF над VLF и HF во всех исследованных пробах (HF<VLF<LF, p<0,05) в после гипервентиляции по сравнению с пациентами второй группы(VLF<LF<HF, p<0,05 в фоновой пробе и VLF<LF<HF , p<0,05 после гипервентиляции) что обозначает преобладание влияния симпатического отдела вегетативной нервной системы на сердечный ритм у больных первой группы и парасимпатического преобладания у второй группы.
Выводы. Все проанализированные показатели кратковременного (пятиминутного) анализа ВСР показывают наиболее выраженные нарушения регуляторных механизмов высших нейрометаболических систем, в том числе и гуморальная система и автономная нервная система и также угнетение высших функциональных резервов сердечно-сосудистой системы. Опухоли головного мозга создают значительный стресс регуляторных систем, что отрицательно влияет на взаимосвязь между центральными и автономными механизмами регуляции. Высокий уровень нейрогуморального влияния на сердечный ритм при опухоли головного мозга также влияет на адаптационный потенциал организма. Сопутствующие эпилептические синдромы у больных с опухолями головного мозга являются дополнительной нагрузкой на механизмы адаптации, которые проявляются преобладанием симпатического отдела вегетативной нервной системы, вернее централизация контроля сердечного ритма, «гиперадаптация» соответствующих физиологических адаптационных систем и в результате приводит к возможному неблагополучному исходу (срыв адаптации). Выявленные особенности сегментарных и эрготропных механизмов, а также преобладание воздействия симпатического отдела вегетативной нервной системы у больных с опухолями головного мозга, протекающими с эпилептическими синдромами, сообщают нам о подавлении автономных механизмов регуляции и преобладания симпатических центральных механизмов.
Практическая значимость. Статистические, геометрические и спектральные показатели ВРC являются наиболее эффективным способом для оценки адаптационного потенциала и для прогнозирования течения эпилепсии у больных с опухолями головного мозга.
