Среди нарушений физиологического течения беременности весьма высока доля гипертензивных нарушений (5-10%); они же зачастую являются причиной материнской и перинатальной заболеваемости и смертности. В связи с этим для практикующего врача принципиально важно по результатам обследования принять правильное решение относительно включения беременной в группу высокого риска развития гипертензивных нарушений и выбрать адекватную тактику наблюдения и лечения.
Преэклампсия – это мультифакторное заболевание, развитие которого определяется как генетическими так и экзогенными факторами [1,4].
Частоту развития гипертензивных нарушений у беременных существенно увеличивает полиморфизмы гена ингибитора активатора плазминогена 1 типа (PAI-1) 4G/5G и ангиотензиногена (ANG) 235 M→T. Патогенетический механизм преэклампсии при полиморфизме PAI-1 5G/4G связан с угнетением фибринолиза, результатом чего является недостаточная инвазия трофобласта, неполноценная плацентация, гипоксия, локальное, а затем генерализованное повреждение эндотелия [3,9,10].
В контроле уровня артериального давления важную роль играет полиморфизм в гене ангиотензиногена 235 M→T [2]. Наличие генотипа 235 ТТ приводит к увеличению концентрации ангиотензиногена и гиперактивности всей ренин-ангиотензин-альдостероновой системы, что может быть причиной развития гипертензии у беременных [1,2,7,8].
В мета-анализе Lin R. еt al. (2012) показано, что TT генотип увеличивает риск ПЭ по сравнению с MM генотипом в 1,61 раза (ОШ 1,61, 95% ДИ 1,22-2,14, р=0,001) [7]. Многочисленными исследованиями установлена роль антифосфолипидного синдрома в патогенезе акушерских осложнений, в том числе и преэклампсии [1,3].
Приведенные факты дают основание говорить о вышеперечисленных факторах, как о факторах, которые увеличивающих риск развития гипертензивных нарушений при беременности. Таким образом, гипертензивные нарушения вызывают много факторов, к тому же большинство из них имеет стохастическую природу. Поэтому утверждать разовьется ли у данной беременной преэклампсия наперед невозможно. Следовательно, в контексте возможного развития гипертензивных нарушений при беременности можно говорить только в вероятностном смысле. А именно, какова вероятность того, что у беременной с данными значениями (х1, х2…хn) факторов будут наблюдаться гипертензивные нарушения.
Цель работы – исследование зависимости частоты развития гипертензивных нарушений у беременных от следующих факторов: полиморфизма по генам PAI-1 4G/5G и ANG 235 M→T, уровня антител к β2 гликопротеину 1, уровня Д-димера.
Материалы и методы. Выборка. Для реализации поставленной задачи было обследовано 177 женщин в третьем триместре беременности. Из них 44 с физиологическим течением беременности – контрольная группа, будем называть ее группой «0». Группу 1А образовали 64 беременных с гестационной артериальной гипертензией или преэклампсией легкой степени. Группу 1В – 69 беременных с преэклампсией средней или тяжелой степени тяжести. Беременные были разделены на группы по уровню артериального давления, протеинурии, дополнительных исследований и в соответствии с клиническим протоколом МОЗ Украины № 676. У всех беременных был произведен забор крови c целью определения генных полиморфизмов, состояния системы гемостаза, уровня антифосфолипидных антител.
Уровень Д-димера в плазме крови определяли на основании иммунотурбодиметрического анализа с помощью латекс-теста «Tina-quant а D-Dimer» (Roche Diagnostics, США) на системе Roche/Hitachi Сobas c 6000.
Исследование генетических полиморфизмов проводили путем аллельспецифической полимеразной цепной реакции, с последующей детекцией методом электрофореза в 3% агарозном геле. Использовался комплект реагентов «SNP-экспресс» производства НПФ «Литех» (Россия) для определения полиморфизмов в геноме человека: 675 5G/4G в гене ингибитора активатора плазминогена -1, 235 M→T в гене ангиотензиногена, 20210 G→A в гене протромбина.
Определение суммарных антител классов Ig M и Ig G к β2 гликопротеину 1 (At β2 ГП1) проводили методом непрямого твердофазного иммуноферментного анализа (ELISA) в сыворотке крови с помощью реагентов производства «Orgentec Diagnostica GmbH» (Германия).
Маркеры. В качестве маркеров предложено рассматривать: Д-димер, полиморфизмы в геноме человека: 675 5G/4G в гене ингибитора активатора плазминогена -1 (РАІ-1), 235 M→T в гене ангиотензиногена, 20210 G→A в гене протромбина; антитела к β2 гликопротеину – 1. Этот выбор основан на следующих фактах.
Маркер – Д-димер. Уровень Д-димера в 1А группе (1,13±0,09 мкг/мл) превышал в 2,35 раза (р<0,0001), а в 1В в 3,17 раза (1,52±0,18 мкг/мл, р<0,0001) показатель контрольной группы (0,48±0,03мкг/мл).
Маркер – полиморфизм в гене ангиотензиногена 235 M→T. Полиморфизм ТТ в группе 1А встречался в 3,1 раза чаще (28,12%, р<0,05), в группе 1В в 2,87 раза чаще (26,09%, р<0,05), чем в контрольной группе (9,09%). Количество нормальных гомозигот и гетерозигот по группам не отличалось и составляло: 37,5% и 34,48% в 1А группе, 24,64% и 49,27% в 1В группе, 47,73% и 43,18% в контрольной группе.
Маркер – полиморфизм в гене РАІ-1 675 5G/4G. Количество нормальных гомозигот 675 5G/5G гена РАІ-1 в группе 1А (18,75%) в 2,9 раза, а в 1В группе (24,64%) в 2,21 раза меньше, чем в контрольной группе (54,55%, р<0,05). Количество гетерозигот 675 5G/4G гена РАІ-1 в 1,58 раза больше в 1А группе (60,94%), а патологических гомозигот 675 4G/4G гена РАІ-1 в 3,61 раза больше в 1В группе (24,64%), чем в контрольной группе (38,64% и 6,82% соответственно, р<0,05).
Маркер – уровень суммарных антител к β2 ГП-1. Достоверно более высокий уровень антител к β2 ГП-1 классов Ig М, Ig G установлен у беременных 1В группы 6,52±0,46 Ед/мл против 4,02±0,24 Ед/мл контрольной группы (р<0,05).
Статистическая обработка результатов исследования проводилась на персональном компьютере. Для вычислений использовали компьютерные программы Microsoft Excel 2010 и Graph Pad Prism 5 for Windows, методы аналитической и вариационной статистики. Выдвинутые гипотезы проверялась с использованием статистических критериев, уровень значимости 0,05 [5].
Результаты и обсуждение. Группа с мутацией в гене протромбина. Данные исследования генных полиморфизмов выделяют группу с мутацией в гене протромбина 20210 G→A. В группе 0 (контрольной) нет беременных с мутацией в гене протромбина. Все беременные с мутацией протромбина оказались в группе 1А или 1В. Поэтому, наличие гомо- или гетерозиготной мутации в гене протромбина 20210 G→A является маркером осложнения гестации развитием преэклампсии. Группа беременных с протромбиновой мутацией составляет 19 человек, из них преэклампсию легкой степени имели – 3 (16%), преэклампсию средней или тяжелой степени – 16 (84%). У всех беременных 1А группы была обнаружена гетерозиготная форма мутации протромбина. Таким образом, мутации в гене протромбина является не только маркером развития гипертензивных нарушений при беременности, но и маркером для дифференциации групп 1А и 1В. Беременных при обнаружении мутации в гене протромбина следует включить в группу риска развития преэклампсии тяжелой или средней тяжести.
Прогноз развития гипертензивных нарушений у беременных. Поскольку беременные с мутацией в гене протромбина заведомо попадают в группу с гипертензивными осложнениями, то из групп 1А и 1В в дальнейших исследованиях были исключены беременные, имеющие мутацию в гене протромбина 20210 G→A, а оставшиеся беременные были объединены в группу 1. Число беременных в группе 1 составило 114.
Далее будем использовать обозначения: хD – количество Д-димера, xAtβ2 – количество антител к β2 гликопротеину 1, xPAI – значение PAI – 1, xANG – значение ANG. Значение xPAI равно 1, если ген нормальный, равно 2, если ген гетерозиготный, и равно 3, если ген патологическая гомозигота; аналогично xANG принимает значения 1, 2 и 3. Каждой беременной приписываем вектор факторов: х=(хD, хAtβ2, хPAI, хANG) – результаты ее лабораторного обследования.
Будем исходить из того, что вероятность развития гипертензивных нарушений у беременных является функцией:
P(y)=P(хD, хAtβ2, хPAI, хANG)=1/(1+exp{-y}) (1)
от линейной комбинации
y=a+bDxD+bPAIxPAI+bANGxANG+bAtβ2xAtβ2 (2)
факторов хD, хAtβ2, хPAI, хANG.
Функцию (2) будем называть функцией риска, ее значение вычисленное по значениям хD, хAtβ2, хPAI, хANG определяет частоту развития гипертензивных нарушений. Коэффициенты bD, bAtβ2, bPAI, bANG были оценены по выборке так, чтобы зависимость вероятности P(y)=P(хD, хAtβ2, хPAI, хANG) развития гипертензивных нарушений от линейной комбинации факторов (2) была наилучшей. Соответствующие оценки получены по методу максимального правдоподобия:
a=-7,00, bD=5,69, bAtβ2=0,42, bPAI=0,93, bANG=0,35.
При этом функция риска принимает следующий вид:
y=-7,00+5,69xD+0,93xPAI+0,35xANG+0,42xAtβ2. (3)
Вероятность развития гипертензивных нарушений у беременной с вектором факторов х=(хD, хAtβ2, хPAI, хANG) равна:
P(y)=P(хD, хAtβ2, хPAI, хANG)= 1/(1+exp{-y})=
=1/(1+exp{-(-7,00+5,69xD+0,93xPAI+0,35xANG+0,42xAtβ2)}). (4)
График функции P(y)=1/(1+exp{-y}) изображен на рис. 1. По оси абсцисс отложены значения у функции риска, по оси ординат – значения вероятностей Р(у) развития гипертензивных нарушений.
По зависимости (4) вероятности P(y) развития гипертензивных нарушений от значения у функции риска можно оценить различные частотные характеристики, связанные с риском развития преэклампсии. В частности, можно определить значение y функции риска, превышение которого у беременной с вероятностью большей Р относит ее в группу высокого риска развития гипертензивных нарушений. Например, для Р равных 0,75; 0,80; 0,90; 0,95 имеем соответственно Р(1,099)=0,75; Р(1,386)=0,80; Р(2,197)=0,90; Р(2,944)=0,95. Если у беременной значение функции риска оказалось равным 1,099 (или больше), то с вероятностью не меньшей 0,75 она окажется в группе высокого риска развития гипертензивных нарушений (в среднем на 100 беременных со значением функции риска 1,099 (или больше) не менее чем у 75 будут гипертензивные нарушения). Для беременной со значением функции риска 2,944 (или больше) вероятность оказаться в группе высокого риска равна 0,95 (в среднем на 100 беременных со значением функции риска, превышающим 2,944, около 95 будут иметь гипертензивные нарушения).
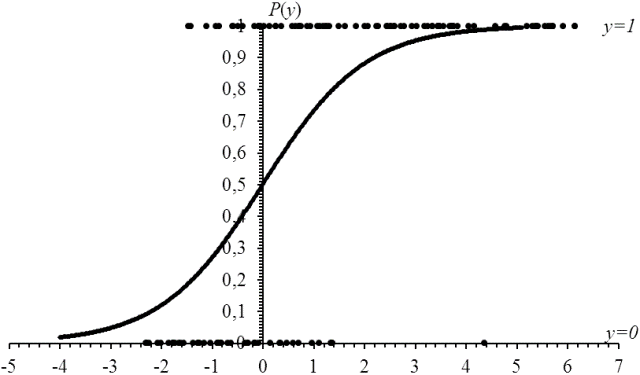
Рис. 1. График зависимости вероятности Р(у) развития гипертензивного осложнения от значения у функции риска (• - значения функции риска на оси у=0 для беременных из группы 0, на оси у=1 для беременных из группы 1)
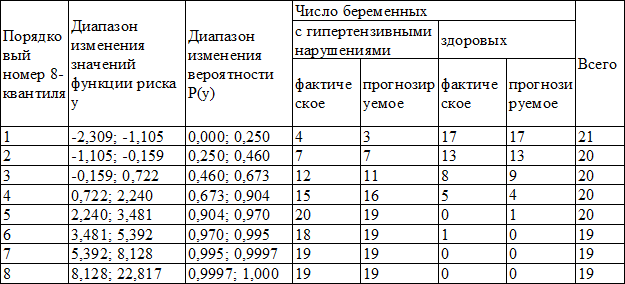
О согласии прогнозируемого и фактического числа случаев развития гипертензивных нарушений при беременности. Выясним, насколько хорошо согласуется предложенная модель (4) зависимости вероятности развития гипертензивных нарушений от факторов хD, хAtβ2, хPAI, хANG. Для этого упорядочим значения функции риска всех беременных (группа 0 и группа 1) от меньших к большим и разобьём полученные значения на восемь, равных по численности частей – восьми-квантилей (см табл.). В первую восьми-квантиль вошла 1/8 часть беременных, значения функции риска у которых минимальны, во вторую восьми-квантиль следующая 1/8 часть беременных, с большим значением функций риска. В последнюю восьмую восьми-квантиль вошла оставшаяся 1/8 часть беременных (с максимальными значениями функции риска). Для каждой восьми-квантили подсчитаем фактическое и прогнозируемое число беременных с гипертензивными нарушениями, а также фактическое и прогнозируемое число беременных с нормальным течением беременности (см. табл.1).
Значение статистики Hosmer-Lemeshow [6] характеризующее уклонение между прогнозируемым и наблюдаемым числом беременных с гипертензивными нарушениями и уклонение между прогнозируемым и наблюдаемым числом здоровых беременных равно 3,2. Критическое значение статистики равно 12,59 (р<0,05), последнее свидетельствует о хорошем согласии модели с фактическими данными.
Таблица 1. Фактическое и прогнозируемое количество гипертензивных нарушений
Примеры определения вероятности развития гипертензивного нарушения. Беременная T, результаты обследования. Значение Д-димера равно 1,14 мкг/мл, количество антител к β2ГП – 1 равно 6,5 Ед/мл, результаты генетического тестирования гена РАІ-1 – 675 4G/4G – патологическая гомозигота, гена ангиотензиногена – 235 МТ – гетерозигота. Следовательно вектор факторов (хD, хAtβ2, хPAI, хANG)=(1,14; 6,5; 3; 2); значение функции риска:
у=-7,0+5,69·1,14+0,93·3+0,35·2+0,42·6,5=5,772
(см. равенство (3)). Согласно формуле (4) вероятность Р(у) развития гипертензивного нарушения у беременной равна:
Р(у)=1/(1+exp{-y})=1/(1+exp{-5,772})=0,997.
Беременная З., результаты обследования. Значение Д-димера равно 0,5 мкг/мл, количество антител к β2ГП – 1 равно 3,0 Ед/мл, результаты генетического тестирования: ген РАІ-1 – 675 5G/5G – нормальная гомозигота, ген ангиотензиногена – 235 ММ – нормальная гомозигота. Вектор факторов беременной (хD, хAtβ2, хPAI, хANG)=(0,5; 3,0;1;1), значение функции риска:
у=-7,0+5,69·0,5+0,93·1+0,35·1+0,42·3,0=-1,585.
Вероятность Р(у) развития гипертензивного нарушения у беременной М (см. формулу (4)) составляет:
Р(у)=1/(1+exp{-y})=1/(1+exp{-(-1,585)})=1/(1+exp{1585})=0,17.
![]()
Близким, к предложенному методу прогнозирования развития гипертензивных нарушений при беременности является метод «подсчета баллов» [4], для оценки риска наследственной тромбофилии и связанных с ними осложнений. В методе «подсчета баллов» каждый генный полиморфизмы, в зависимости от его патогенного вклада, имеет определенное количество баллов. Риск определяется путем суммирования баллов. Предложенная нами модель позволяет оценить не только вклад полиморфных вариантов генов тромбофилии, но и степень гиперкоагуляции, наличие кофактора к антифосфолипидным антителам. Более того, в предложенной модели учитывается не только вклад каждого фактора, но и их взаимодействие между собой. И что принципиально важно – модель дает возможность оценить частоту развития гипертензивных нарушений и, как следствие, определяет вероятность беременной оказаться в группе высокого риска.
Выводы
1. Мутация в гене протромбина является маркером развития гипертензивных нарушений при беременности. При наличии мутации в гене протромбина беременную следует включить в группу риска развития преэклампсии тяжелой или средней степени тяжести.
2. Предложена модель зависимости частоты развития гипертензивных нарушений у беременных от значения Д-димера, количества антител к β2 гликопротеину 1, наличия полиморфизмов 4G/5G в гене ингибитора активатора плазминогена – 1 типа и 235 М→Т в гене ангиотензиногена. Модель учитывается не только вклад каждого фактора, но и совокупное их воздействие на развитие гипертензивных нарушений у беременных.
3. Предложенная модель дает возможность оценить частоту развития гипертензивных нарушений у беременных.
4. Полученные результаты позволяют выявить беременных группы риска развития гипертензивных нарушений (по результатам тестирования генов, уровню антител к β2 гликопротеину 1, уровню Д-димера) с целью проведения у них профилактических мероприятий, своевременной госпитализации, назначения медикаментозных средств, определения состояния плода.
