Динамично развивающееся производство метанола и формальдегида в Пермском крае является одним из крупнейших поставщиков производимых продуктов в России, объем производства, которого составляет до 80%. В промышленности метанол применяется в качестве полупродукта для производства формальдегида, синтетического каучука, уксусной кислоты, органического стекла. Формальдегид применяется для производства пластмасс, красок, синтетических смол и клеев, изоляционных материалов, дубильных веществ, дезинфицирующих и лекарственных средств, текстильных вспомогательных веществ; в качестве протравителя в сельском хозяйстве, а также при многих реакциях органического синтеза. Работники такого предприятия трудятся в условиях непрерывного производственного процесса в несколько рабочих смен, выполняют большой объем работы с высокой сосредоточенностью.
Известно, что метанол и формальдегид оказывают политропное действие на организм человека: поражают нервную и сосудистую систему, обладают выраженным раздражающим действием на слизистые оболочки, поражают кожу, вызывают расстройства зрения и обладают кумулятивным эффектом [5, 7]. Особенно ярко выражены эти изменения у лиц, имеющих длительный и постоянный контакт с промышленными ксенобиотиками, что усугубляет их неблагоприятное воздействие. Иммунная система, являясь основной защитной системой организма, в первую очередь реагирует на воздействие ксенобиотических факторов, вызывающих различные нарушения иммунитета, что чаще всего выражается в угнетении клеточного звена [1, 2, 9]. Процесс апоптоза или запрограммированной клеточной гибели, выступает одним из основных механизмов регуляции активности клеток, защищающий организм как от излишней атаки со стороны иммунитета (элиминация аутореактивных клеток), так и уничтожая поврежденные (онкотрансформированные) клетки. Белок р53 является основным внутриклеточным маркером, свидетельствующим о вступлении клетки в апоптоз. Показано, что он также играет важную защитную роль, поскольку его активация резко уменьшает вероятность накопления мутаций генома, в том числе и тех, которые способствуют неопластической трансформации. Нарушение его функции приводит к молекулярным изменениям, вызывающим различные новообразования. Белок р53 способен к стимуляции синтеза веществ, участвующих в детоксикации, репарации поврежденной ДНК и контроле распределения хромосом во время митоза [4, 8]. Однако особенности изменения клеточного иммунитета и апоптоза, у работников химических предприятий на фоне воздействия формальдегида до сих пор никем не рассматривались, что важно для проведения коррекционных и профилактических мероприятий по снижению экзогенной контаминации формальдегидом и восстановления здоровья работающих.
Цель работы: исследовать изменения ключевых параметров клеточного иммунитета и маркеров апоптоза у работников химического производства, экспонированных к метанолу и формальдегиду.
Материалы и методики. В группу обследования включено 78 человек, которые были разделены на 3 группы. Первую группу (с экспозицией) составили работники химических предприятий, непосредственно контактирующие с метанолом и формальдегидом на рабочем месте (n=26). Во вторую группу (вне экспозиции) вошли лица, работающие на том же предприятии, однако в карте аттестации их рабочего места не было указано экспозиции к изучаемым токсикантам (n=26). В качестве контроля использовали показатели группы сравнения (n=26), куда вошли работники другого предприятия, трудовая деятельность которых не связана с вредными и опасными условиями труда. В исследовании участвовали лица только рабочих специальностей – аппаратчики, слесари, слесари-ремонтники, мастера, технологи и др. Группы были сопоставимы по полу, возрасту, стажу работы.
У всех обследуемых определяли содержание метанола и формальдегида в периферической крови и моче методом жидкостной хроматографии на капиллярном газовом хроматографе «Кристалл 2000» (Россия). Выполнено в лабораториях методов жидкостной и газовой хроматографии ФБУН «ФНЦ медико-профилактических технологий управления рисками здоровью населения» (Пермь, Россия).
Поскольку известно, что химические вещества угнетают, главным образом, клеточно-опосредованные иммунные реакции, у всех обследуемых изучали основные субпопуляции лимфоцитов периферической крови: Т-лимфоциты (CD3+), Т-лимфоциты-хелперы (CD3+CD4+), Т-лимфоциты-хелперы (CD3+CD8+), цитотоксические Т-лимфоциты (CD3+CD25+), Т-лимфоциты, экспрессирующие CD95CD3+CD95+, Т-регуляторные клетки (CD4+CD25+CD127-); низкодифференцированные Т-лимфоциты (CD4+CD8+); B-лимфоциты (CD3-CD19+), натуральные киллеры (NK) – (CD16+56+). Фенотипирование лимфоцитов проводилось методом проточной цитометрии на проточном цитометре FACSCalibur фирмы «BectonDickinson» («BD», USA) с использованием программы CellQuest-PrO («BD», USA). Определение популяции лимфоцитов проводили с использованием панелей меченых моноклональных антител (МКАТ) к мембранным CD-рецепторам («BD», USA). Выполнено отделом иммунобиологических методов диагностики ФБУН «ФНЦ медико-профилактических технологий управления рисками здоровью населения» (Пермь, Россия).
Рассчитывался интегральный показатель - отношение процента CD3–позитивных лимфоцитов периферической крови, экспрессирующих молекулу CD95, к проценту Т-регуляторных клеток. Предлагаемый способ учитывает не только количественные (количество CD3-лимфоцитов, Т-регуляторных клеток), но и функциональные параметры Т-клеточного звена иммунитета (экспрессия молекулы CD95 на Т-лимфоцитах, отражающая активационный статус клетки и ее готовность вступить в апоптоз), а также предлагает удобный вариант "количественной" оценки степени воздействия формальдегида на клеточный иммунитет.
Содержание белка р53 - основного внутриклеточного маркера апоптоза, экспрессируемого только в апоптотирующих клетках, определяли методом проточной цитометрии при использовании МКАТ против белка р53 согласно методике производителя («BD», USA).
В сыворотке крови определяли содержание общего IgE методом иммуноферментного анализа с использованием тест-систем «Вектор-Бест» (Россия) на анализаторе «Elx808IU» (США), анализ содержания специфического IgЕ методом модифицированного конкурентного иммуноферментного анализа согласно МР 111-14/55-04-02.
Показатели фагоцитарной активности проводилось с использованием в качестве объектов фагоцитоза формалинизированных эритроцитов барана (Дуглас, 1983).
Статистическая обработка проводилась с помощью программы «Statistika-6.0» и «StatPlus 2009 Professional 5.8.4». Поскольку полученные данные не подчинялись закону нормального распределения, достоверность отличий определялась по критерию Манна-Уитни. Для определения степени связи между двумя переменными использовался корреляционный анализ – коэффициент детерминации (R2). Рассчитывался реперный уровень (BMC) [3].
Результаты и обсуждение. В результате проведенных исследований установлено превышение содержания метанола и формальдегида в биосредах (крови и моче) в обеих группах работников химического производства (табл. 1), причем во второй группе отмечается тенденция к увеличению содержания метанола в крови и моче в сравнении с первой группой, однако достоверных различий нами не получено.
Таблица 1. Исследование содержания метанола и формальдегида в крови и моче у работников химических предприятий, экспонированных к метанолу и формальдегиду
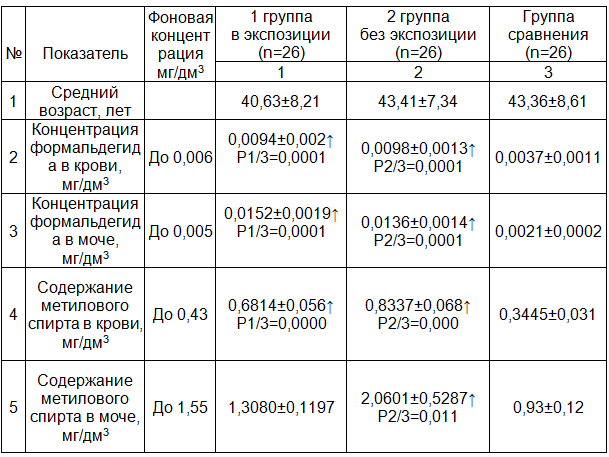
Примечание: ↑ - указано превышение фоновых концентраций.
Полученные данные свидетельствуют о сенсибилизации к формальдегиду независимо от непосредственного контакта с формальдегидом на рабочем месте. Данное предположение подтверждается выявлением специфического IgЕ в сыворотке крови работников химического производства как в группе с экспозицией, так и без экспозиции к формальдегиду (табл. 2). Помимо этого, у работников химического производства обеих групп содержание общего IgE было достоверно повышено (табл. 2). Выявленная высокая корреляционная взаимосвязь между увеличением содержания формальдегида в крови и повышением уровня общего IgE (R2=0,717, р=0,0001, BMC=0,005, мкг/л) доказывает, что сенсибилизация работающих к промышленным токсикантам вызывает развитие иммунного ответа по аллергическому типу при превышении уровня формальдегида в крови выше 0,005 мкг/л.
Таблица 2. Исследование показателей клеточного иммунитета у работников химических предприятий, экспонированных к метанолу и формальдегиду
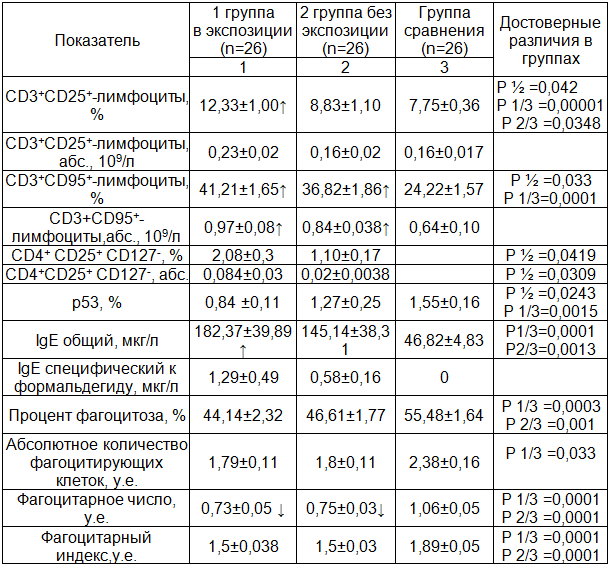
Примечание: ↑ - указано увеличение показателя выше нормы.
При оценке ключевых параметров клеточного иммунитета показано, что у работников первой группы (с экспозицией), достоверно повышена экспрессия активационного маркера CD25+ на Т-лимфоцитах (табл. 2). Молекула CD25 является рецептором для интерлейкина-2 – основного активирующего фактора для Т-лимфоцитов, который запускает как пролиферацию, так и апоптоз Т-лимфоцитов. При этом, у лиц занятых на химическом производстве, выявлена повышенная экспрессия молекулы CD95 (Fas/APO-1) на CD3+-лимфоцитах, как в относительном, так и в абсолютном выражении (табл. 2). При оценке содержания белка р53, показано, что его экспрессия достоверно снижена у лиц, работающих на химическом производстве (табл. 2), вне зависимости от непосредственного контакта с формальдегидом. Также у работников химического производства определено снижение показателей фагоцитарной активности: процента фагоцитоза, фагоцитарного числа, фагоцитарного индекса (табл. 2). Таким образом, воздействие химических веществ (метанола и формальдегида) приводит к повышению экспрессии маркеров, характеризующих общий потенциал готовности Т-клеточного звена иммунитета к апоптозу, что важно для уничтожения измененных клеток в организме и, по-видимому, является защитным компенсаторным механизмом. Однако снижение экспрессии белка р53, ограничивающего накопление аномальных клеток с различными изменениями генома, в том числе и тех, которые способны к неопластической трансформации [4], а также фагоцитарной активности клеток, способных уничтожать апоптотирующие и патологически трансформированные клетки, создает высокий риск развития заболеваний, связанных с нарушением апоптоза.
При изучении причинно-следственных связей убедительно показано, что выявленные нарушения клеточного иммунитета являются следствием контакта с химическими веществами. Так определена высокая положительная взаимосвязь между увеличением уровня метанола (R2=0,869, р=0,00001) и формальдегида (R2=0,704, р=0,005, BMC=0,009, абс., 109/л) в моче и повышением экспрессии маркера ранней активации лимфоцитов – молекулы CD25. Выявлена обратная корреляционная зависимость между снижением фагоцитарного индекса (R2=0,789, р=0,0001) и фагоцитарного числа (R2=0,637, р=0,0001, у.е.) и увеличением содержания формальдегида в крови. Увеличении содержания метанола в моче обратно коррелирует с уменьшением фагоцитарного индекса (R2=0,755, р=0,0001) и абсолютным количеством фагоцитирующих клеток (R2=0,607, р=0,0001, BMC=0,691, у.е.).
При расчете интегрального показателя соотношения процента CD3–позитивных лимфоцитов периферической крови, экспрессирующих молекулу CD95, к проценту Т-регуляторных клеток установлено. Если содержание формальдегида в сыворотке крови у работников не превышает допустимой уровень фоновых концентраций (менее 0,006 мг/дм3), значение интегрального критерия составляет менее 40. У лиц, в сыворотке крови которых содержание метанола и формальдегида было выше допустимых фоновых уровней (более 0,006 мг/дм3), значение интегрального параметра определялось выше 40, что свидетельствует о глубоких нарушениях клеточного иммунитета. Таким образом, установлено численное значение интегрального критерия, что позволяет количественно оценивать степень негативного воздействия формальдегида на клеточное звено иммунитета.
В проведенном исследовании доказано, работа на химическом предприятии, использующем в технологическом цикле метанол и формальдегид, приводит к сенсибилизации организма работающих к изучаемым токсикантам, нарушению ключевых параметров клеточного иммунитета и апоптоза, что свидетельствует о нарушении адаптационных процессов, и повышению риска развития и прогрессирования широкого спектра заболеваний.
Выводы
1. У обследованных работников химического производства, выявлено превышение содержания метанола и формальдегида в биосредах (кровь, моча) выше уровня фоновых концентраций. Доказано развитие сенсибилизации к ним по увеличению уровня общего IgE и специфического IgE к формальдегиду в сыворотке крови.
2. Установлено увеличение экспрессии маркера ранней активации Т-лимфоцитов – молекулы CD25 и маркера апоптоза - CD95 на CD3+-лимфоцитах, как защитного компенсаторного механизма. Одновременно отмечали снижение уровня экспрессии внутриклеточного маркера апоптоза - белка р53 и фагоцитарной активности клеток крови, что создает высокий риск развития заболеваний, связанных с нарушением апоптоза.
3. Определены реперные уровни для общего IgE, экспрессии маркера ранней активации лимфоцитов и абсолютного количества фагоцитирующих клеток. Установлен интегральный критерий соотношения процента CD3–позитивных лимфоцитов периферической крови, экспрессирующих молекулу CD95, к проценту Т-регуляторных клеток. Это позволяет определить величину эффекта неблагоприятного воздействия формальдегида на клеточный иммунитет как на индивидуальном, так и на популяционном уровнях, а также позволяет на ранних этапах процесса дезадаптации принимать решения о коррекционных и профилактических мероприятиях по снижению экзогенной контаминации формальдегидом.
