По данным Международного агентства по изучению рака (IARC), ведущего свою деятельность под эгидой Всемирной организации здравоохранения (WHO), ежегодно в мире регистрируется 8 млн. новых случаев злокачественных опухолей и более 5,2 млн. смертей от них[7]. Рак пищевода (РП) является причиной смерти в мире около 900 тыс. онкологических больных, представляет собой агрессивную злокачественную эпителиальную опухоль человека. Косвенным показателем агрессивности злокачественных опухолей является соотношение общего числа смертных случаев от рака определенной локализации в течение 1 года к числу вновь выявленных больных этой нозологией в течение этого же года. Данное соотношение называют индексом агрессивности. Для рака пищевода этот индекс составляет 0,95. Для сравнения при раке легкого этот показатель равен 0,93, а для таких нозологий как рак молочной железы, предстательной железы и прямой кишки он колеблется от 0,16 до 0,23 [2].
Наряду с первичным раком печени, карциномой поджелудочной железы и мезотелиомой плевры, рак пищевода относится к опухолям с наихудшим прогнозом и плохими результатами лечения [1,5,7]. Общая 5-летняя выживаемость составляет около 15% [2]. Этот показатель широко варьирует в зависимости от диагностированной стадии, применяемого метода лечения [3].
В настоящее время известно, что для возможного успешного лечения прогностически неблагоприятных злокачественных опухолей, к которым относится рак пищевода, требуется дифференцированный подход к выбору метода лечения, а во многих случаях комбинированное лечение с использованием нескольких методов воздействия. До недавних пор велись дискуссии о целесообразности и большей эффективности того или иного способа лечения.
Исторически перед онкологами стояла дилемма: радикальное хирургическое лечение с высоким риском летального исхода и надежда на полное выздоровление либо паллиативное относительно безопасное облучение и продолжительный, но определённый период ремиссии с неизбежным рецидивом.
Методом выбора является хирургическое лечение [4]. Но, несмотря на современные достижения агрессивной онкохирургии в сочетании с поступательным развитием интенсивной терапии, результаты хирургического лечения местно-распространенного рака пищевода далеки от удовлетворительных.
Благие намерения хирурга, стремление помочь больному могут, к сожалению, дискредитировать этот эффективный способ лечения расширением показаний к оперативному лечению и, как итог, повышением послеоперационной смертности. Часто при постановке диагноза больные находятся в тяжёлом состоянии, обусловленном как общим воздействием раковой опухоли на организм, так и алиментарными нарушениями из-за сопутствующей дисфагии и невозможностью энтерального питания. Низкие функциональные резервы (истощенность и пожилой возраст) делают неоправданно опасной, а подчас и невозможной операцию на пищеводе.
Исторически альтернативным методом лечения рака пищевода является проведение лучевой терапии. Этот метод используется, в основном у соматически ослабленных функционально неоперабельных больных или больных с диссеминированным процессом с целью купирования дисфагии.
Дистанционная лучевая терапия проводится конвенциально либо конформно. Радикальной суммарной очаговой дозой (СОД) являются 60-70 Гр. Преимущество конформного облучения – это облучение опухолевого очага без развития нежелательных побочных эффектов и осложнений со стороны окружающих пищевод органов. По сути метод является паллиативным, применялся самостоятельно в основном до 1980-х годов, до расцвета пищеводной хирургии. Общая 5-летняя выживаемость больных, получающих лучевую терапию, составляет от 0 до 10% [6]. К каждому методу лечения должны быть строгие показания. Лучше отказаться от заведомо неоправданного оперативного пособия, выбрав консервативный путь лучевой терапии.
Ясно, что требуется индивидуализация лечения с использованием строго обоснованного метода лечения, учитывая риски проведения того или иного воздействия у этой тяжёлой категории больных.
Материалы и методы
В работе представлены отдалённые результаты хирургического и лучевого лечения 166 больных раком пищевода. Обследование и лечение проводилось в Рязанском областном клиническом онкологическом диспансере с мая 1998 по май 2011 г. Диагностика рака пищевода основывалась на данных клинического, инструментального и лабораторного исследований. Всем больным, участвующим в исследовании, выполнялся стандартный комплекс обследований, включающий в себя: лабораторное обследование (анализ крови общий, анализ мочи общий, биохимический анализ: билирубин: общий, прямой, непрямой; сулемовая проба; тимоловая проба; мочевина; креатинин; остаточный азот; коагулограмма; сахар крови; RW; ИФА(ВИЧ). ЭКГ, консультация терапевта. Для подтверждения диагноза, определения распространённости опухолевого поражения пищевода и морфологической верификации выполнялась ФЭГДС с биопсией, цитологическим и гистологическим исследованием биоптата, рентгенологическое исследование органов грудной полости, пищевода и желудка, рентгеновская компьютерная томография органов грудной полости, фиброларинготрахеобронхоскопия. Ультразвуковое исследование органов брюшной полости, забрюшинного пространства и шейно-надключичных зон с целью выявления отдалённых метастазов. Перечисленные исследования были выполнены всем больным. Кандидатам на хирургическое лечение с целью определения распространённости процесса по брюшной полости выполнялась диагностическая лапароскопия, с целью определения функциональной операбельности выполнялась спирография и ультразвуковое исследование сердца. Фиброколоноскопия и ирригоскопия выполнены по показаниям.
Всего было 157(94,6%) мужчин и 9(5,4%) женщин. Такое соотношение характерно для рака пищевода. Средний возраст больных был 59,5±1,13 лет (от 41 года до 84 лет).
В хирургической группе было 97(94,2%) мужчин и 6(5,8%) женщин. Средний возраст хирургических больных был 56,15±0,92 лет (от 41 года до 70 лет).
60(95,2%) больных радиологической группы были мужчины, 3(4,8%) – женщины. Средний возраст лучевых больных - 64,97±1,32 года (от 47 лет до 84 лет).
Клинически значимые сопутствующие заболевания наблюдались практически одинаково в обеих группах. Сопутствующая патология обнаружена у 120(71,4%) больных. Преобладала патология сердечно-сосудистой, дыхательной, эндокринной, мочеполовой и гепатобилиарной систем. В 17(10,1%) случаях сопутствующей патологией были первично-множественные синхронные и метахронные злокачественные опухоли. У 2 метахронный рак гортани, 1 - синхронный рак нижней губы, 3 - синхронный ранний рак кардиального отдела желудка, 4 - метахронный рак желудка, 1 - метахронный рак прямой кишки, 1 - синхронный хронический миелолейкоз, 1 - метахронный рак обеих молочных желёз, 2 - метахронный рак ротоглотки, 1 - метахронный рак дна полости рта и мягкого нёба. Причём синхронные или метахронные злокачественные опухоли диагностированы у 12,7%(8) лучевых и 8,7%(9) хирургических больных
Хирургических больных разделили по характеру проведённого лечения на: радикально и условно-радикально прооперированных больных (n=85), больных после наложения гастростом и эксплоративных лапаротомий (n=18).
Радикальным лечением мы считали хирургическое пособие, заключавшееся в проведении резекционного этапа с восстановительным и обязательным объёмом лимфодиссекции в брюшной полости D2, в грудной полости - 2S или 2F (n=20) (группа 1). Условно радикальным нами рассматривались вмешательства с объёмом лимфодиссекции в грудной полости менее 2S и с абдоминальной лимфодиссекцией D2 или D1 (n=65) (группа 2).
У 18 больных ограничились лишь проведением симптоматических хирургических вмешательств: 15 - гастростомии, 3 - эксплоративные лапаротомии (группа 3).
При проведении дистанционной γ-терапии (ЛТ) применялся классический режим фракционирования с разовой очаговой дозой (РОД) 1,8-2,0 Гр 5 раз в неделю и планируемой радикальной суммарной очаговой дозой (СОД) 60-65 Гр. ЛТ проводилась с использованием следующих полей облучения:
- 2 передне-задних фигурных полей;
- 3 фигурных полей: 1 переднего и 2 задне-боковых;
Предлучевая топометрия проводилась с использованием жидкой бариевой взвеси для контрастирования желудочно-кишечного тракта во время рентгенографии.
Во время облучения захватывали опухоль и все зоны установленного и предполагаемого местного распространения (по пищеводу и околопищеводной клетчатке) и регионарного метастазирования. При этом из объёма максимума ионизации, где СОД должна достигать 44-50 Гр на зоны субклинического распространения опухолевого процесса, требуется исключить ряд пограничных критических органов: cпинной мозг, верхние дыхательные пути, лёгочную ткань, сердце, кардиальный отдел желудка. Поэтому после подведения 40-44 Гр поля облучения сокращали. Также после подведения этой дозы рентгенологически оценивали эффективность облучения.
В ряде случаев применяли радиомодификацию 5-фторурацилом из расчета 250 мг внутривенно ежедневно до суммарной дозы 5,0 Гр.
Облучение проводили на гамма-терапевтических установках РОКУС в статическом режиме. Расстояние до источника облучение было равным 75 см. Размеры полей облучения варьировали, но в обязательном порядке последние выступали на 3-5 см от проксимального и дистального краёв опухоли.
Радиологические больные составили также 3 группы: перенесшие радиальную лучевую терапию (n=29)(группа 4), паллиативную лучевую терапию (n=22)( группа 5), больные с прерванным курсом лучевой терапии (n=12). В группу 4 входили пациенты с СОД от 60 до 65 Гр, в группу 5 - от 40 до 59 Гр, в группу 6 менее 40 Гр.
Результаты исследования
Для анализа отдалённых результатов хирургического лечения нами была сформирована группа наблюдения с точкой отсчёта, соответствующей дню операции. Из анализа были исключены больные, умершие в послеоперационном периоде от различных осложнений.
Отдалённые результаты хирургического лечения прослежены у 94 больных (рис. 1).
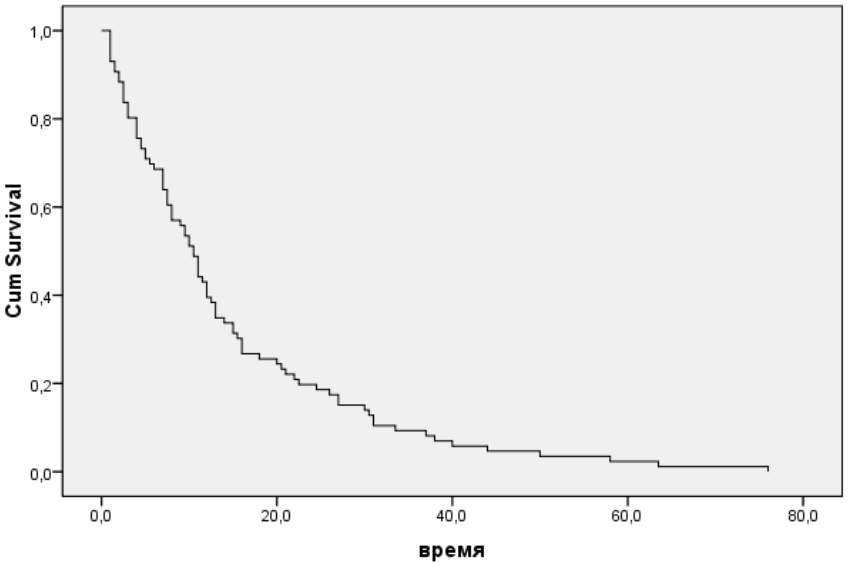
Рис. 1. Общая выживаемость хирургических больных раком пищевода.
При статистической обработке этой группы пациентов выявлено, что 95% доверительный интервал (ДИ) = 11,6-17,8 мес., медиана выживаемости 10,5±0,93 мес., показатели 6 мес., 1-, 2- и 3-летней выживаемости равны соответственно 64%, 39%, 18% и 9%.
Результаты выживаемости в 1,2 и 3 группах показаны на рис.2.
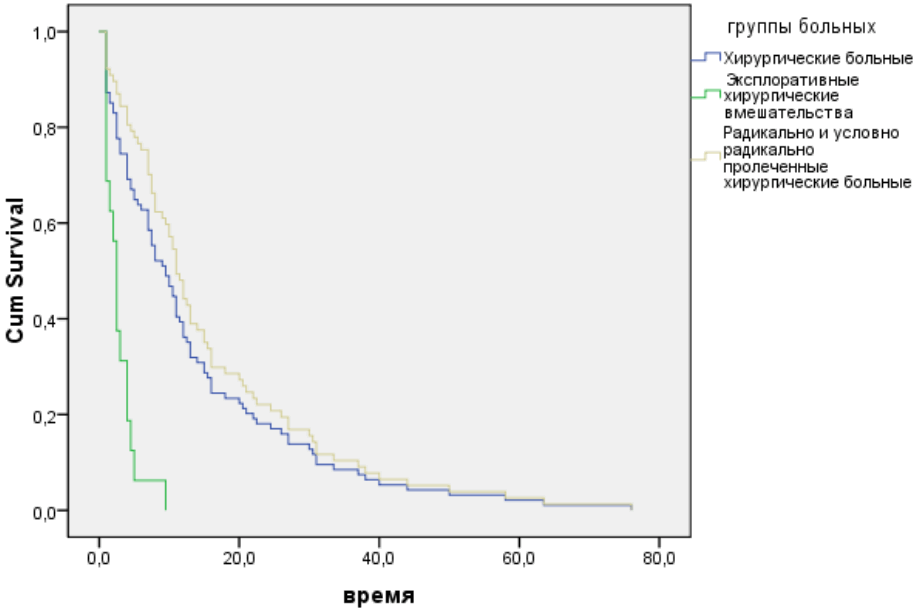
Рис. 2. Общая выживаемость хирургических больных раком пищевода с и без резекционного этапа лечения.
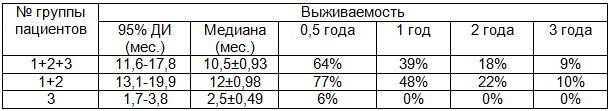
Сопоставление результатов хирургического лечения выявило преимущества по общей выживаемости за 3-летний период наблюдения в зависимости от проведения резекционного этапа лечения (табл.1). Показатели выживаемости пациентов после эксплоративных вмешательств значительно отличаются от выживаемости всей группы хирургически пролеченных больных (р<0,0001). Однако, при анализе отдалённых результатов хирургического лечения по группам больных с проведением резекционного этапа улучшение показателей выживаемости статистически незначимо (р=0,124). Это может говорить о крайней агрессивности рака пищевода.
Таблица 1. Отдалённые результаты хирургического лечения больных раком пищевода в зависимости от характера хирургического лечения
Для анализа отдалённых результатов радиологического лечения нами была сформирована группа наблюдения с точкой отсчёта, соответствующей дате выписки больных из стационара. Отдалённые результаты радиологического лечения прослежены у 63 больных (рис.3). При статистической обработке этой группы пациентов выявлено, что 95% ДИ = 7,2-13,2 мес., медиана выживаемости 6±1,24 мес., показатели 6 мес., 1-, 2- и 3-летней выживаемости равны соответственно 52%, 27%, 11% и 3%.
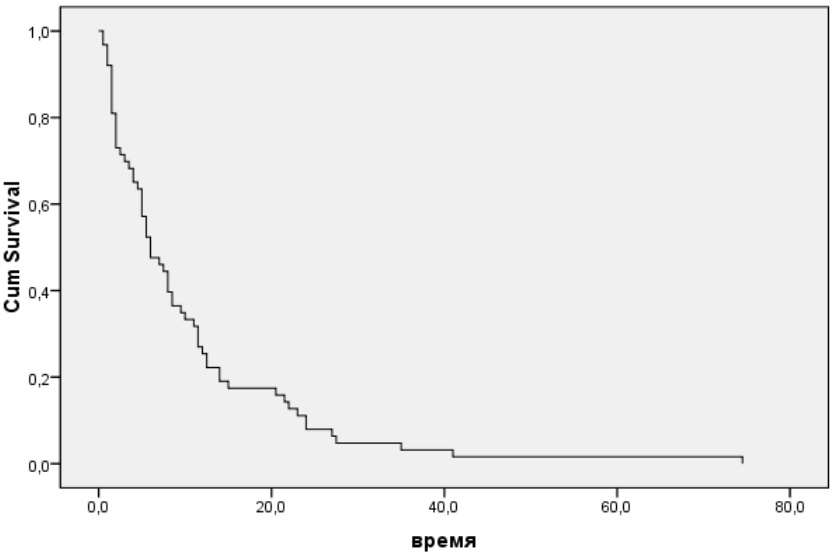
Рис. 3. Общая выживаемость радиологических больных раком пищевода.
Отдалённые результаты радиологического лечения в зависимости от подведённой суммарной очаговой дозы представлены на рис.4.
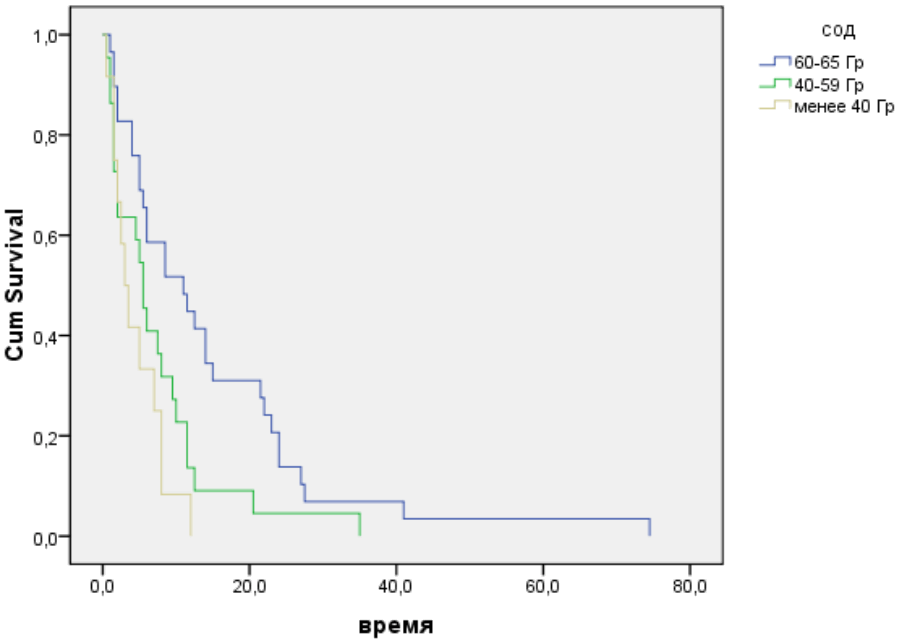
Рис. 4. Отдалённые результаты радиологического лечения рака пищевода в зависимости от СОД.
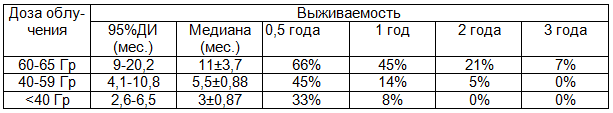
Сопоставление результатов лечения в 4,5,6 группах выявило преимущества по общей выживаемости за 3-летний период наблюдения в группе пациентов в зависимости от СОД (табл.2). При статистической обработке достоверное улучшение 3-летней выживаемости получено в группе 4 по сравнению с группами 5 и 6 (р=0,032 и 0,009 соответственно). Разница в выживаемости между группами 5 и 6 статистически недостоверна (р=0,448).
Таблица 2. Выживаемость в зависимости от дозы облучения
При анализе отдалённых результатов лучевого лечения больных раком пищевода выявлено, что выживаемость этой категории больных уступает таковой хирургически пролеченных больных (95% ДИ = 7,18-13,17 мес. против 11,57-17,81 мес. соответственно, медиана выживаемости 6±1,24 мес. против 10,5±0,93 мес. соответственно, показатели 6 мес., 1-, 2- и 3-летней выживаемости равны 52%, 27%, 11% и 3% против 64%, 39%, 18% и 9% соответственно (р=0,018)).
Выводы
- При одинаковой распространённости рака пищевода радикальное хирургическое лечение предпочтительнее дистанционной γ-терапия у соматически сохранных больных (р=0,018).
- Проведение дистанционной γ-терапии показано у соматически отягощённых и пожилых (старше 70 лет) больных раком пищевода (р=0,018).
- Хирургическое лечение рака пищевода приемлемо при проведении радикального и условно-радикального лечения (р<0,0001).
- Лучшие показатели радиологического лечения плоскоклеточного рака пищевода (дистанционная γ-терапия) получены при СОД-60-65 Гр по сравнению с группами с СОД - 40-59 Гр и СОД <40 Гр (р=0,032 и 0,009 соответственно).
