Рак молочной железы (РМЖ) занимает ведущее место в структуре онкопатологии у женского населения Соединенных Штатов Америки, Австралии, Европы, Российской Федерации [8, 11]. В 2009 г. в России РМЖ выявлен у 20,1% женщин, что в абсолютных цифрах составило 54315 случаев. Пик заболеваемости приходится на трудоспособный возраст от 30 до 59 лет (27,1%) [4].
Высокая чувствительность РМЖ к большинству современных цитостатиков обусловливает широкое применение различных режимов химиотерапии при данной патологии. Преобладающая часть химиотерапевтических схем для лечения РМЖ базируется на антрациклиновых антибиотиках [5, 6, 9]. Для первой линии полихимиотерапии (ПХТ) опухолей молочной железы чаще всего используется комбинация циклофосфана, доксорубицина и 5-фторурацила (схемы САF, FAC), что обусловлено достаточной эффективностью и экономической целесообразностью применения указанной комбинации в широкой клинической практике. Лечебный эффект схемы CAF составляет 60-64% [1, 5]. При этом количество и тяжесть нежелательных явлений цитостатиков возрастает прямо пропорционально их противоопухолевой активности.
В ряде отечественных работ исследовалась токсичность антрациклинсодержащей ПХТ РМЖ. Чаще всего отмечались: отрицательное влияние на гемопоэз (лейкопения – 74-97,3%, анемия − 22-87%, тромбоцитопения −12-27,8%), гастроинтестинальная токсичность (тошнота − 60-85,6%, рвота − 17,1-46%, диарея − 36,6%, стоматит − 4-22,2%, абдоминальные боли − 46%, признаки интерстициального панкреатита − 9,1%), кардиотоксичность (острая − 6-75,2% и кумулятивная − 34,6%), гепатотоксичность − 30%, цистит − 4% [1, 2, 7, 10].
Общеклинические методы обследования пациентов являются неотъемлемой частью сложного диагностического процесса. Для большого количества заболеваний качественный сбор жалоб обусловливает правильность диагноза не менее чем на 70% [3].
Наличие общепринятых и доступных методов оценки субъективных проявлений болезни очень важно в клинической практике. Большое количество исследований в медицине в целом и в онкологии в частности посвящено разработке методов количественной оценки боли. Для оценки интенсивности острой боли широко используются визуальная аналоговая шкала (ВАШ) и цифровая рейтинговая шкала (ЦРШ). Менее чувствительной является четырехзначная категориальная вербальная шкала (ВРШ). ЦРШ предназначена для определения только одного свойства боли – ее интенсивности и состоит из 11 пунктов от 0 («боли нет») до 10 («худшая боль, какую можно представить»). Эта шкала более удобна для использования на практике и лучше понимается большинством людей, чем ВАШ, которая представляет собой горизонтальную линию, под левым краем которой написано "нет боли", а под правым – "худшая возможная боль". Больной должен поставить вертикальную линию поперек указанной горизонтальной в том месте, которое более всего соответствует интенсивности боли. Категориальная вербальная шкала состоит из четырех показателей интенсивности боли: отсутствие боли, слабая, умеренная и интенсивная боль. По мнению некоторых авторов, эта шкала неточна в оценке боли и может использоваться только в качестве грубого скринингового инструмента, а более аккуратным методом, даже для рутинного использования в клинической практике, являются ЦРШ и ВАШ (рис. 1).
![Рис. 1. Наиболее широко используемые одномерные шкалы интенсивности боли: ЦРШ, ВРШ и ВАШ [12].](/images/articles/2012/2.1/12095/p.gif)
Рис. 1. Наиболее широко используемые одномерные шкалы интенсивности боли: ЦРШ, ВРШ и ВАШ [12].
Адаптированный к России опросник для изучения качества жизни онкологических больных MDASI содержит ЦРШ [13]. Однако в доступной литературе нет сведений об использовании ЦРШ при оценке токсичности ПХТ.
Цель. Оценить эффективность использования цифровой рейтинговой шкалы для объективизации клинических проявлений повреждения внутренних органов, обусловленного антрациклинсодержащей ПХТ РМЖ.
Материал и методы. Обследована 81 пациентка с РМЖ IIB-IV стадии в возрасте от 30 до 59 лет (V0,5=49,0; V0,25=45,0; V0,75=53,0 лет), получившие 6 курсов ПХТ по схеме CAF (циклофосфан 100 мг/м2 с 1 по 14 день, доксорубицин 30 мг/м2 в 1 и 8 день, 5-фторурацил 500 мг/м2 в 1 и 8 день цикла с повторением каждые 28 дней). Из сопутствующей патологии у 8-ми пациенток имелась гипертоническая болезнь I стадии (при этом одна пациентка регулярно принимала лозартан по 10 мг в сутки, двое регулярно принимали эналаприл по 10 мг в сутки), 2 пациентки страдали неспецифическим язвенным колитом, у 6-х пациенток – вирусный гепатит В в анамнезе. Сбор жалоб проводился до начала лечения и ежедневно в течение каждого курса ПХТ посредством устного опроса и модифицированной шкалы токсичности (посимптомного опросника, составленного на основе стандартной шкалы токсичности Центра клинических исследований Национального института рака Канады (Clinical Trial Centre National Cancer Institute Canada, CTC-NCIC) версия 3.0 и содержащего ЦРШ) [5]. Для оценки субъективных ощущений повреждения пищеварительной, мочевыделительной и сердечно-сосудистой систем, обусловленного ПХТ по схеме CAF, в модифицированной шкале токсичности перечислены субъективные симптомы из соответствующих разделов стандартной шкалы CTC-NCIC. На градуированной 10-тисантиметровой ЦРШ пациентки отмечали деление, соответствующее степени выраженности каждого симптома. Нулевому делению ЦРШ соответствовала нулевая степень токсичности (отсутствие симптома), деления 1, 2, 3 соответствовали I степени токсичности, деления 4, 5, 6 соответствовали II степени токсичности, деления 7, 8, 9 соответствовали III степени токсичности, деление 10 соответствовало III-IV степени токсичности (максимальная выраженность симптома). Объединение III и IV степеней токсичности обусловлено тем, что некоторые симптомы в шкале токсичности CTC-NCIC ограничиваются третьей степенью токсичности, а тактика ведения пациентов при III и IV степенях идентична. При анализе степени выраженности субъективных симптомов учитывалось максимальное значение, зафиксированное в течение каждого курса ПХТ. Также пациентки были обследованы с использованием общеклинических, лабораторных и инструментальных методов в динамике. Для изучения качества жизни больных РМЖ до и после проведения ПХТ использовался опросник "SF-36".
Обработку полученных результатов выполняли с помощью компьютерной программы STATISTICA 6. Количественные признаки описаны медианой (V0,5), интерквартильным размахом: 25-й процентиль (V0,25) и 75-й процентиль (V0,75). При сравнении двух независимых групп по одному признаку использовались критерий Манна-Уитни (U). Анализ взаимосвязи двух признаков выполнялся путем оценки коэффициента ранговой корреляции Спирмена (rs). Информативность устного сбора жалоб и модифицированной шкалы токсичности рассчитывалась по формуле Кульбака. Во всех процедурах статистического анализа рассчитывался достигнутый уровень значимости (p), критический уровень значимости принимался равным 0,05.
Результаты и обсуждение. Устный сбор жалоб является единственным методом получения информации о субъективной переносимости ПХТ в рутинной клинической практике. Однако этот метод, на наш взгляд, имеет ряд недостатков, поскольку пациент не обладает в достаточной мере знаниями о специфичных нежелательных явлениях цитостатиков, а также испытывает сложности при интерпретации степени выраженности симптома на вербальном уровне. Врач, как правило, акцентирует внимание пациента на тех проявлениях токсичности, которые являются противопоказанием для продолжения ПХТ (боль, стоматит, диарея) [5, 6, 9]. В результате информация о ряде субъективных симптомов, влияющих на качество жизни, и о начальных проявлениях токсичности может быть не озвучена или неправильно интерпретирована пациентом или врачом.
Для уточнения вышеуказанного предположения проанализирована частота жалоб, отражающих токсичность ПХТ и выявленных при опросе пациенток в ходе цитостатической терапии (табл. 1).
Таблица 1. Частота и степень выраженности жалоб, отражающих токсичность ПХТ, выявленных при опросе пациенток в ходе цитостатической терапии (абс., % от общего количества пациенток, n=81)
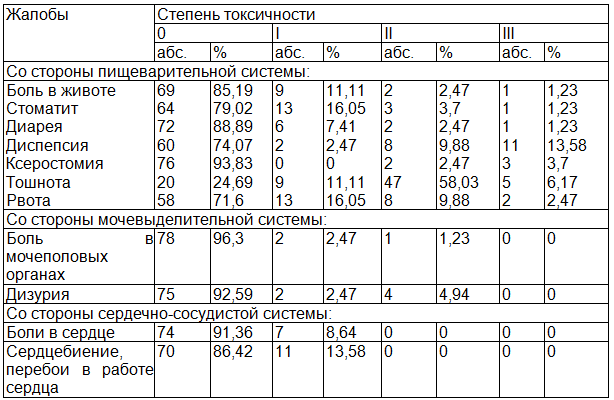
Наиболее частыми субъективными симптомами являлись тошнота II степени, рвота I степени и разного рода диспепсии на уровне III степени.
С целью объективизации субъективной информации, получаемой врачом от пациентов, в нашем исследовании проведена оценка частоты и характера вышеописанных жалоб, выявленных с помощью модифицированной шкалы токсичности в ходе цитостатической терапии (табл. 2).
Таблица 2. Частота и степень выраженности жалоб, отражающих токсичность ПХТ, выявленных с помощью модифицированной шкалы токсичности в ходе цитостатической терапии (абс., % от общего количества пациенток, n=81)
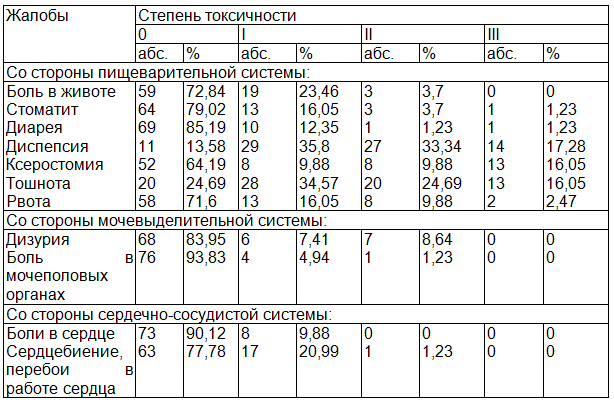
По данным модифицированной шкалы токсичности в ходе ПХТ наиболее часто выявлялись диспепсии I-II степеней, тошнота I степени и сердцебиение I степени. Дополнительно получена информация о распространенности ксеростомии I-III степеней, жалоб со стороны мочевыделительной системы. Эти данные значительно отличаются от результатов устного опроса, что обусловлено детализацией и объективизацией жалоб, как со стороны пациента, так и со стороны врача с помощью модифицированной шкалы токсичности, содержащей ЦРШ.
В связи с различием полученных данных нами проведен анализ информативности устного опроса и модифицированной шкалы токсичности для выявления нежелательных явлений ПХТ (табл. 3).
Таблица 3. Информативность жалоб, отражающих токсичность ПХТ, выявленных при опросе и с помощью модифицированной шкалы токсичности
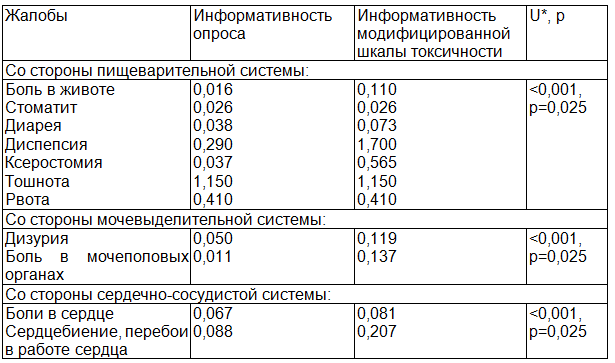
Примечание: * - U-критерий рассчитан для групп жалоб по системам.
Информативность модифицированной шкалы токсичности по отдельным системам с высокой статистической достоверностью выше информативности устного опроса для выявления проявлений токсичности ПХТ РМЖ.
Для доказательства конвергентной валидности модифицированной шкалы токсичности использован корреляционный анализ (табл. 4).
Таблица 4. Корреляционный анализ модифицированной шкалы токсичности с общеклиническим статусом, лабораторными показателями, данными инструментального обследования и физическим компонентом здоровья SF-36 в ходе ПХТ РМЖ
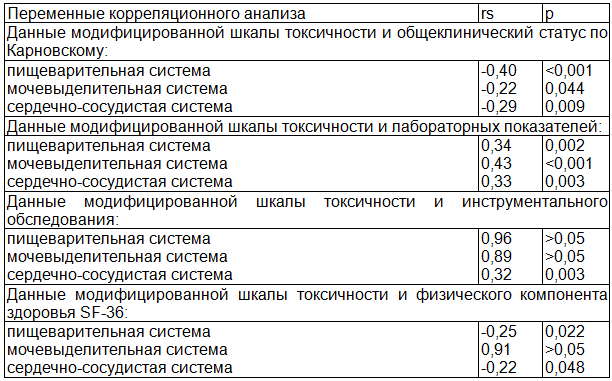
Из представленных данных видно, что данные модифицированной шкалы токсичности имеют слабую и умеренную обратную корреляционную связь с общеклиническим статусом; умеренную прямую связь с изменениями лабораторных показателей и с данными инструментального обследования сердечно-сосудистой системы; слабую обратную связь с показателями физического компонента здоровья опросника SF-36. Корреляционная зависимость между жалобами со стороны пищеварительной и мочевыделительной систем и данными ультразвукового исследования не прослеживается, что может быть обусловлено отсутствием патогномоничных признаков повреждения соответствующих органов при сонографии.
Заключение. На основании проведенного анализа следует выделить следующие принципиальные позиции:
- эффективность использования предложенной модифицированной шкалы токсичности, содержащей ЦРШ, превышает эффективность устного опроса как в плане выявления токсических проявлений ПХТ, так и в точности определения степени токсичности ПХТ РМЖ;
- конвергентная валидность модифицированной шкалы токсичности, содержащей ЦРШ, доказана существованием статистически значимых корреляционных связей между модифицированной шкалой токсичности и общеклиническими, лабораторными, инструментальными изменениями, показателями физического компонента здоровья опросника SF-36.
Это обосновывает целесообразность использования модифицированной шкалы токсичности, содержащей ЦРШ, для объективизации субъективной информации о переносимости ПХТ, получаемой врачом от пациента, и позволяет рекомендовать использование ее в клинической практике.
