Известно, что на долю острых лимфобластных лейкозов (ОЛЛ) у взрослых приходится 20-25% [1,5,7], тогда как у детей данная нозология встречается намного чаще – в 75 – 80% случаев всех острых лейкозов [4]. Несмотря на успехи современной полихимиотерапии и возможность достижения полной ремиссии у 80-85% больных ОЛЛ, длительная безрецидивная выживаемость больных не превышает 30-40% [9]. Наиболее значимыми факторами прогноза лейкоза является наличие цитогенетических аномалий. Так к наиболее оцениваемым прогностическим факторам ОЛЛ относятся транслокации t (9;22) и t (4;11). Транслокация t(9;22) определяется у 5-10% детей и 25-30% взрослых больных ОЛЛ, а t(4;11) определяется у детей в 2%, у взрослых – в 5-6% случаев [3]. Выявить транслокацию t(9;22) можно стандартным цитогенетическим методом, методом FISH; а также с помощью полимеразной цепной реакцией с обратной транскрипцией (ОТ-ПЦР), которая выявляет экспрессию химерного гена BCR/ABL [2,8]. Выявление химерного онкогена BCR/ABL при ОЛЛ позволяет пересмотреть терапевтическую тактику, тем самым увеличивая длительность ремиссии и продолжительность жизни больных. Однако в Узбекистане до настоящего времени частота встречаемости химерного онкогена BCR/ABL у больных ОЛЛ не была изучена, что послужило поводом для проведения данного исследования.
Цель исследования: изучить частоту встречаемости химерного онкогена BCR/ABL у больных ОЛЛ в Узбекистане.
Материалы и методы. В исследование было включено 134 больных с диагнозом ОЛЛ, находившихся на стационарном лечении в НИИ Гематологии и переливания крови в период с января 2009 г. по декабрь 2011 г. Возраст больных варьировал от 15 до 65 лет (медиана возраста 33,4±3,1 года), из них мужчин было 84 (63%), женщин – 50 (37%). Материалом исследования служили кровь/костный мозг, полученные от больных ОЛЛ при поступлении в стационар до начала специфического лечения.
Основными критериями постановки диагноза ОЛЛ были общий анализ крови, данные миелограммы и цитохимическое исследование бластных клеток. Больные были разделены на 3 основные группы. В первую группу вошли 102 больных с впервые установленным ОЛЛ. Вторую группу составили 16 больных с рецидивом ОЛЛ. Третью группу составили 16 больных с первично-резистентным течением ОЛЛ.
В нашем исследовании для выявления химерного транскрипта BCR/ABL использовали метод ОТ-ПЦР [6]. Важным критерием диагностики Ph – позитивного ОЛЛ методом ОТ-ПЦР стало двукратное определение химерного транскипта, т.е. при его однократном выявлении результат считался отрицательным.
Статистический анализ результатов проведен с использованием пакета статистических программ "Microsoft Excel 2003". Вычислялись следующие статистические параметры: средняя арифметическая, ошибка средней арифметической, величина критерия достоверности различий (р) проверялась с применением t-критерия Стьюдента. Результаты статистического анализа считались значимыми при р<0,05.
Результаты и обсуждение. В ходе исследования было обнаружено, что экспрессия гена BCR/ABL p190 была выявлена у 45 из 134 больных ОЛЛ, что составило 34%. В таблице 1 представлена встречаемость онкогена BCR/ABL p190 у больных 3-х групп.
У больных I группы химерный транскрипт BCR/ABL p190 методом ОТ-ПЦР более двух раз был зарегистрирован у 31 больного ОЛЛ, что составило 30% всех случаев ОЛЛ. У больных II группы экспрессия онкогена BCR/ABL p190 была установлена у 10 больных, что составило 63%. В III группе больных химерный транскрипт был выявлен у 4 больных, что составило 25%.
Таблица 1. Встречаемость BCR/ABL p190 у больных ОЛЛ

В ходе исследования удалось установить некоторые клинико-гематологические закономерности течения Ph-позитивного ОЛЛ. В дебюте заболевания у больных Ph-позитивным ОЛЛ чаще встречался гиперлейкоцитоз (количество лейкоцитов более 50,0х109/л). Он был выявлен у 11 (35%) из 31 больных. У больных Ph-негативным ОЛЛ гиперлейкоцитоз регистрировался в 21 (29%) из 71 случаев. Алейкемический вариант заболевания чаще встречался у больных Ph-негативными ОЛЛ - в 19 (27%) случаях из 71. При Ph–позитивном ОЛЛ алейкемический вариант лейкоза был выявлен у 4 (13%) из 31 больных.
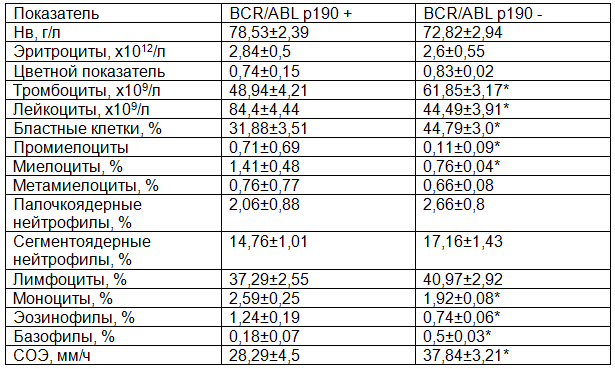
В табл. 2 представлены основные показатели крови у больных I группы на момент постановки диагноза ОЛЛ. Как видно из табл. 2, количество гемоглобина в дебюте заболевания существенно не отличалось у больных ОЛЛ в двух подгруппах и составило 78,53±2,39 и 72,82±2,94 г/л. Количество эритроцитов также не имело значительных отличий в обеих подгруппах и составило 2,84±0,5 и 2,6±0,55х1012/л. Цветной показатель у больных Ph-позитивным ОЛЛ составил 0,74±0,15, у больных Ph-негативным ОЛЛ – 0,83±0,02, что не имело существенных различий. Среднее количество лейкоцитов у больных Ph-позитивным ОЛЛ в дебюте заболевания составило 84,4±4,44х109/л, у больных без патологического транскрипта – 44,49±3,91х109 /л. Таким образом, количество лейкоцитов в дебюте заболевания у больных Ph-позитивным ОЛЛ было достоверно выше почти в 2 раза относительно показателей при Ph-негативном ОЛЛ (р<0,001). На момент диагностики Ph-позитивного ОЛЛ уровень лейкоцитов колебался в широких пределах: от 1,15х109/л до 800,0х109 /л, при Ph-негативном ОЛЛ разброс лейкоцитов был не настолько широк и составил 0,5-257,9х109/л. В отношении среднего количество тромбоцитов наблюдалась противоположная картина. Тромбоцитопения была более выражена у пациентов с Ph-позитивным ОЛЛ.
Таблица 2. Показатели крови больных Ph-позитивным ОЛЛ
Примечание: *-p<0,05.
Среднее количество тромбоцитов на момент диагностики заболевания составило 48,94±4,21х109/л/, что в 1,26 раз ниже (р<0,05) относительно больных Ph-негативным вариантом ОЛЛ, у которых количество тромбоцитов было 61,85±3,17 х109/л. Разброс тромбоцитов варьировал в более широких пределах в подгруппе ОЛЛ без патологического онкогена и составил ед-240 х109/л, тогда как в подгруппе с патологическим онкогеном – ед-137х109/л. Среднее количество бластных клеток в дебюте заболевания было ниже у больных Ph-позитивным ОЛЛ и составило 31,88±3,51%, тогда как у больных Ph-негативным ОЛЛ – 44,79±3,0% (р<0,05).
Количество промиелоцитов в периферической крови было достоверно выше в 7 раз в подгруппе с Ph-позитивным ОЛЛ (0,71±0,69%) относительно данных больных Ph-негативным ОЛЛ (0,11±0,09%) (р<0,001). Количество миелоцитов у больных с патологическим онкогеном также было больше в 1,8 раз относительно больных без онкогена и составило 1,41±0,48% против 0,76±0,04% (р<0,001). Количество метамиелоцитов в двух подгруппах было примерно одинаковым и составило 0,76±0,77% и 0,66±0,08%.
Анализ лейкоформулы показал следующие изменения. Так среднее количество нейтрофилов в подгруппах были различны. Количество палочкоядерных нейтрофилов у больных Ph-позитивным ОЛЛ составило 2,06±0,88%, что было ниже относительно больных Ph-негативным ОЛЛ, количество которых было 2,66±0,8%. Количество сегментоядерных нейтрофилов было выше в 1,2 раза (р<0,05). у больных без патологического транскрипта (17,16±1,43%) относительно больных с экспрессией транскрипта (14,76±1,01%). Среднее количество лимфоцитов в дебюте заболевания у больных Ph-позитивным ОЛЛ составило 37,29±2,55%, у больных Ph-негативным ОЛЛ – 40,97±2,92%, что не имеет существенных различий. Среднее количество моноцитов в периферической крови у больных с патологическим онкогеном было выше в 1,3 раза относительно больных без онкогена и составило 2,59±0,25% и 1,92±0,08% соответственно. Количество эозинофилов было также достоверно выше в 1,7 раз у больных с патологическим транскриптом относительно больных без патологического транскрипта, что составило 1,24±0,19% против 0,74±0,06% (р<0,001). Количество базофилов, наоборот, было в 2,5 раза выше у больных Ph-негативным ОЛЛ (0,18±0,07%) относительно больных Ph-позитивным ОЛЛ (0,5±0,03%) (р<0,001). Скорость оседания эритроцитов (СОЭ) была выше в 1,4 раза (р<0,01) у больных без экспрессии онкогена и составила 37,84±3,21 мм/ч относительно больных с экспрессией онкогена (28,29±4,5мм/ч). Таким образом, в дебюте заболевания у больных в двух подгруппах регистрировалось увеличение СОЭ, которое обусловлено увеличением концентрации в плазме белков-маркеров воспалительного процесса (фибриногена, C-реактивного белка и других), а также снижением числа эритроцитов.
При тщательном сборе анамнеза и объективном обследовании больных Ph - позитивным ОЛЛ были выявлены: лимфоаденопатия - 59% случаев, интоксикационный синдром – 47%, геморрагический синдром – 35%, спленомегалия – 29%, иммунодефицитный синдром – 24%, анемический синдром – 18% (рис. 1).
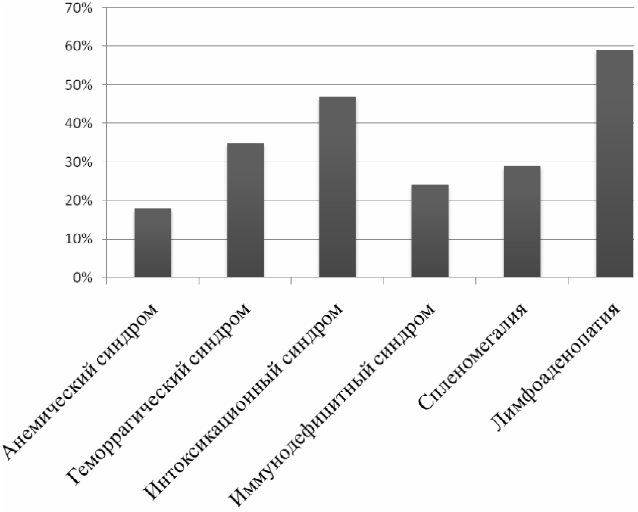
Рис. 1. Частота встречаемости синдромов у первичных больных Рh-позитивным ОЛЛ.
Как видно из рис. 1, наиболее часто Ph - позитивный ОЛЛ дебютирует с увеличения периферических лимфатических узлов, интоксикационного синдрома и геморрагического синдрома. Лимфоаденопатия характеризовалась увеличением миндалин и лимфатических узлов как периферических, так и внутренних (внутригрудных и внутрибрюшных) до различных размеров, безболезненных при пальпации. Геморрагический синдром проявлялся от мелкоточечных петехий и экхимозов до наружных кровотечений (наиболее часто носовых и у женщин - маточных). Развитие геморрагического синдрома было обусловлено двумя основными факторами – критическим снижением тромбоцитов и нарушением питания сосудистой стенки за счёт дисфункции тромбоцитов.
Выводы.
- Частота встречаемости химерного онкогена BCR/ABL p190 у больных ОЛЛ в Узбекистане составила 34%.
- Ph - позитивный ОЛЛ чаще дебютирует с гиперлейкоцитоза, выраженной тромбоцитопении, сдвига лейкоцитарной формулы влево, лимфоаденопатии и геморрагического синдрома.
