Рак желудка продолжает входить в число наиболее часто встречающихся злокачественных новообразований. В 2008 г. в мире зарегистрировано 989600 новых случаев рака желудка. Он занимает 4 место в структуре онкологической заболеваемости - после рака легких и бронхов, молочной железы и колоректального рака. При этом летальных исходов зарегистрировано 738000, что уступает по смертности лишь раку легких и бронхов [12]. В Санкт-Петербурге по заболеваемости рак желудка занимает 2 место у мужчин (11,7%), уступая только заболеваемости рака легкого, и 3 место у женщин (8,7%), после рака молочной железы и рака ободочной кишки [4].
Низкая чувствительность аденокарцином желудка к химиотерапии делает оперативное вмешательство единственным адекватным методом лечения [5] и требует поиска дополнительных терапевтических агентов лечения данного заболевания. Перспективным препаратом в этом отношении может оказаться мелатонин. Этот индольный гормон эпифиза, вырабатываемый также клетками диффузной нейроэндокринной системы [1, 3, 19], обладает антиоксидантным, иммуномодулирующим и антимутагенным действием [6, 8, 10, 18]. Показано, что мелатонин тормозит индукцию опухолей толстой кишки и ряда других локализаций у лабораторных животных [2, 3, 7, 15, 16]. Сведения о его применении у пациентов, страдающих опухолями желудка, крайне немногочисленны [13].
Целью данного клинического исследования явилось изучение уровня экскреции мелатонина, его суточного ритма у больных раком желудка, а также влияния экзогенного мелатонина на частоту развития рецидивов после радикального лечения пациентов, страдающих раком желудка.
Материалы и методы. Уровень экскреции 6-сульфатоксимелатонина (6-СОМТ) с мочой был изучен у 89 пациентов (49 мужчин и 40 женщин), страдающих раком желудка. Возраст заболевших – от 31 до 81 лет, средний возраст 60,7±10,4 года. Все пациенты предъявляли жалобы на различные нарушения сна. Морфологически опухоли были представлены аденокарциномами различной степени дифференцировки.
Определение уровня 6-СОМТ проводилось конкурентным иммуноферментным методом BUHLMANN 6-SMT ELISA (BUHLMANN LABORATORIES AG, Швейцария) в лаборатории перинатальной биохимии клинико-диагностической лаборатории НИИ акушерства и гинекологии им. Д.О.Отта СЗО РАМН.
Для определения стадии заболевания использовались данные интраоперационной ревизии и удаленного операционного материала.
Кроме того, исследовали влияние мелатонина на течение рака желудка 57 радикально оперированных больных в возрасте от 37 до 80 лет (37 мужчин и 20 женщин). Пациенты получали содержащий мелатонин препарат «мелаксен» (Юнифарм. Инк.. США) курсами в осенний (с 1 сентября по 30 ноября) и весенний (с 1 марта по 31 мая) периоды по 3 мг в течение всего периода наблюдения (16 месяцев). В качестве контрольной группы обобщен ретроспективный материал, полученный при обработке историй болезни 162 больных раком желудка, леченных радикально в НИИ онкологии им. Н.Н.Петрова с 2000 по 2007 г. Данные по возрастному составу пациентов в контрольной группе и группе пациентов, получавших мелатонин представлены на рис. 1.
Результаты и обсуждение. Данные экскреции 6-СОМТ (нг/мл) в зависимости от пола, возраста, наличия отдаленных метастазов представлены в табл. 1. Дневная экскреция 6-СОМТ была выше у пациентов без отдаленных метастазов: 422±36 против 231±27 нг/ч – p<0,001. При отсутствии отдаленных метастазов у мужчин дневная экскреция также была выше - 486± 53 против 266± 33 нг/ч (p<0,001). У женщин без отдаленных метастазов дневная экскреция также была выше: 338±43 против 209±37 нг/ч (p<0,05). Статистически достоверной разницы в показателях ночного уровня экскреции 6-СОМТ у мужчин и женщин не получено, но у мужчин без отдаленных метастазов уровень дневной экскреции 6-СОМТ был выше: 486±53 против 338±37 нг/ч (p<0,05). Таким образом, «мелатониновый» статус оказывает модулирующее влияние на опухолевый процесс: при более агрессивном течении заболевания экскреция мелатонина снижена, в ряде случаев извращена, что сопровождается повышением частоты рецидивирования.
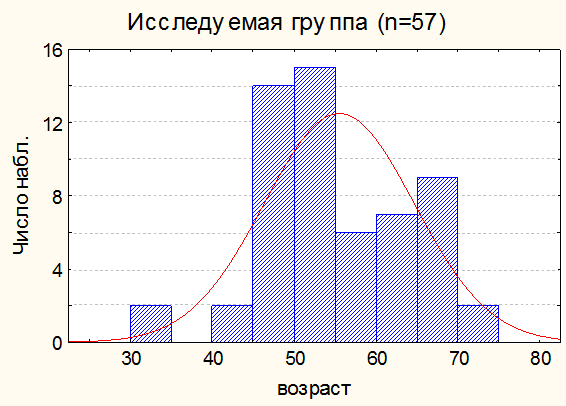
Рис 1а. Общая характеристика исследуемой группы по возрасту.
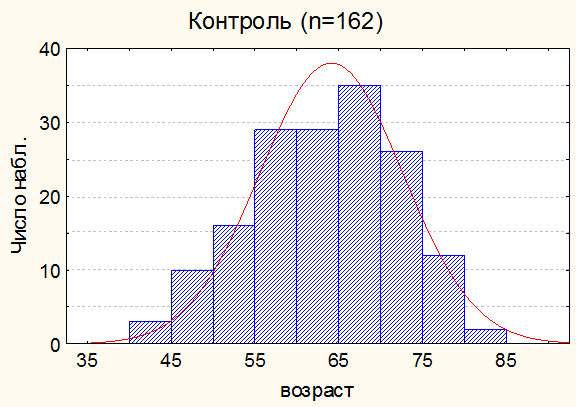
Рис. 1б. Общая характеристика контрольной группы по возрасту.
Сведения о возрастной динамике экскреции с мочой 6-СОМТ у больных раком желудка пациентов, вошедших в исследование, представлены на рис. 2. По литературным данным у здоровых людей с возрастом снижается выработка эпифизарного мелатонина и экскреция 6-СОМТ как в ночные так и в дневные часы суток [11, 17]. В нашем исследовании дневная экскреция 6-СОМТ существенно не менялась. Таким образом, у пациентов, страдающих раком желудка, циркадианный ритм экскреции 6-СОМТ нарушен.
По данным многолетних наблюдений в лаборатории биохимии с клинико-диагностическим отделением НИИ акушерства и гинекологии им. Д.О. Отта СЗО РАМН, уровень дневной экскреции 6-СОМТ у практически здоровых женщин не превышает 400 нг/ час, тогда как в ночные часы составляет 1020-2300 нг/час в возрасте 20-29 лет, 550-1550 нг/час в возрасте 40-59 лет, и 380-800 нг/час у лиц в возрасте 60-89 лет.
Таблица 1. Ночная и дневная экскреция (6-СОМТ) (нг/час) у больных, страдающих раком желудка при отсутствии и наличии отдаленных метастазов
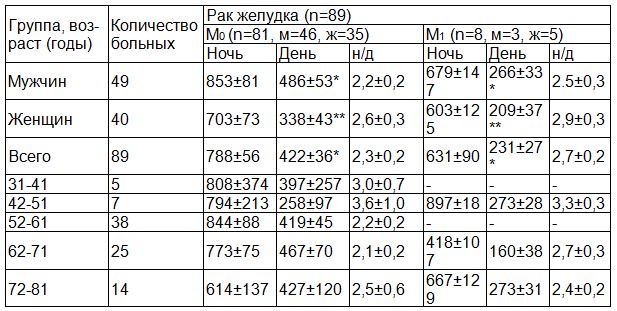
Примечания: M0 – отдаленные метастазы отсутствуют, M1 – наличие отдаленных метастазов: н/д – ночь/день; * - p<0,001, **- p<0,05.
Анализ данных показал, что изначальный уровень ночной экскреции был ниже у пациентов, у которых в течение года наблюдения возник рецидив заболевания, по сравнению с показателями в группе пациентов в течение года не имевших рецидива заболевания: 968±75 против 512±122 нг/ч (р<0,003).
Данные об экскреции 6-СОМТ в зависимости от степени распространения раковой опухоли на стенку желудка при отсутствии отдаленных метастазов представлены в табл. 2. Статистически достоверной разницы в уровне ночной экскреции 6-СОМТ не отмечено. При этом неслучайна разница в экскреции 6-СОМТ в дневные часы: при Т1 – 318±54 нг/ч и при Т4 – 544±93 нг/ч (p<0,05). Также не случайна разница в коэффициенте ночь/день: 2,8±0,3 против 1,8 ±0,3 (p<0,05). Эти данные могут свидетельствовать об извращении процесса выработки эпифизарного мелатонина при местном распространении опухолевого процесса.
Сведения об уровне экскреции 6-СОМТ в зависимости от степени поражения регионарных лимфатических узлов представлены в таблице 3. При повышении степени поражения регионарных лимфатических узлов происходит снижение выработки эпифизарного мелатонина в ночное время (p>0,05). В остальном существенных изменений не происходит.
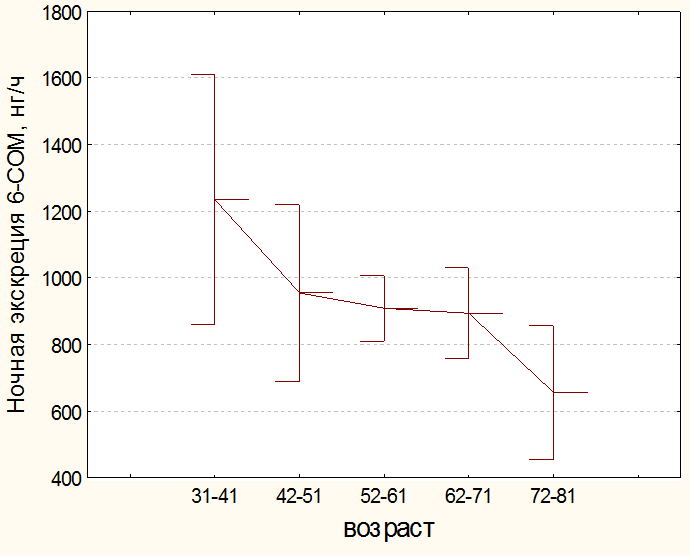
Рис. 2а. Возрастная динамика ночной экскреции 6-СОМТ у пациентов при раке желудка исследуемой группы.
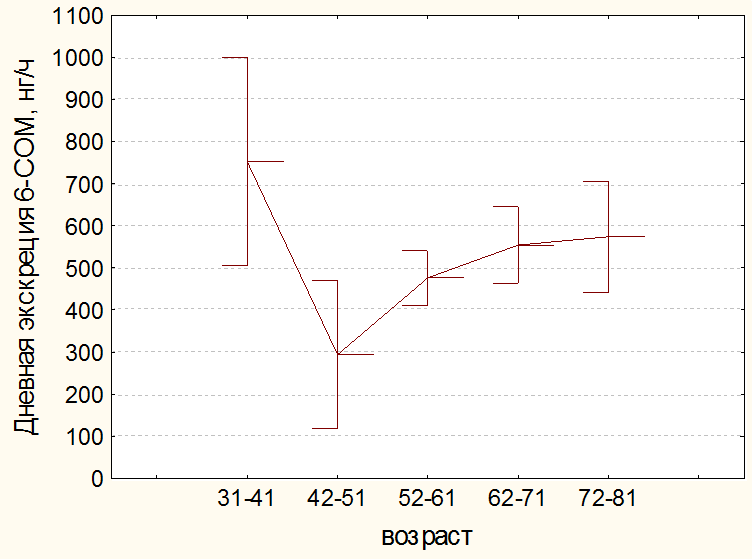
Рис 2б. Возрастная динамика дневной экскреции 6-СОМТ у пациентов при раке желудка исследуемой группы.
Таблица 2. Экскреция 6-СОМТ у пациентов при раке желудка в зависимости от степени местного распространения ракового процесса. * - p<0,05
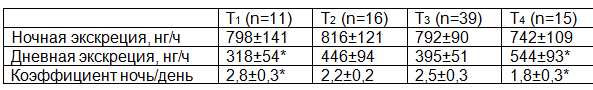
Таблица 3. Экскреция 6-СОМТ у пациентов при раке желудка в зависимости от степени поражения регионарных лимфоузлов.
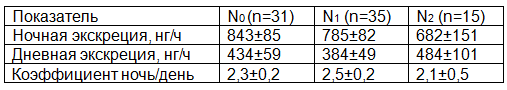
Таблица 4. Экскреция 6-СОМТ у пациентов при раке желудка в зависимости от степени дифференцировки раковой опухоли. * - p<0,01.
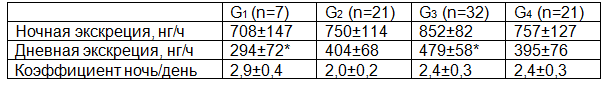
Данные об экскреции 6-СОМТ в зависимости от степени дифференцировки раковой опухоли представлены в таблице 4. Показана существенная разница экскреции 6-СОМТ в дневные часы между G1 и G3 (p<0,05): 294±72 нг/ч против 479±58 нг/ч. Эти данные не противоречат международной литературе. Так Zhang S. с соавт. [20] показал, что мелатонин влияет на степень дифференцировки аденокарциномы желудка линии SGC7901, снижая активность щелочной фосфатазы и лактатдегидрогеназы (ферментов, ответственных за дедифференцировку данной опухолевой ткани) и повышая экспрессию гена эндокана (деривата эндотелия). В нашем исследовании показана компенсаторная реакция организма на более низкую степень дифференцировки раковой опухоли.
Таким образом, наши наблюдения свидетельствуют о более низкой экскреции 6-СОМТ у больных раком желудка при его большей распространенности, более высокой дифференцировки и большем метастазировании, что соответствует наблюдениям других авторов [9].
Данные о безрецидивной выживаемости представлены на рис. 3.
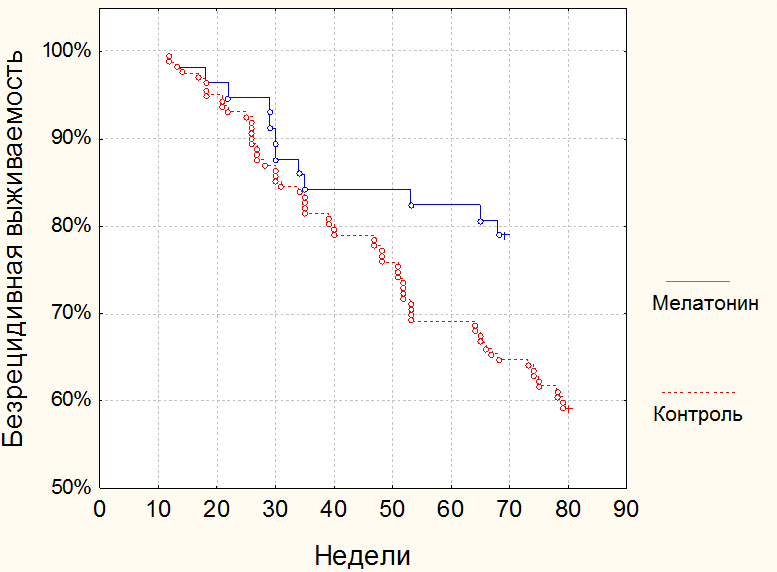
Рис. 3. Кривые безрецидивной выживаемости пациентов, страдающих раком желудка, принимающих мелатонин и контрольной группы.
Безрецидивная 1-годичная выживаемость при раке желудка в исследуемой группе составила 84% (48 человек) против 69% (112 человек) в контрольной (р<0,05, Лог-ранговый критерий). 16-месячная (68 недель) безрецидивная выживаемость достоверно (р<0,05) увеличилась с 65% (105 человек) до 79% (45 пациентов). Таким образом, применение мелатонина в осенний и весенний период года в дозе 3 мг перед сном улучшает показатели радикального лечения при раке желудка.
По данным Lissoni [13, 14] применение мелатонина у больных раком желудка 3-4 стадии достоверно увеличивает терапевтический эффект как стандартных схем так и биотерапевтических методов терапии.
Выводы
- У больных раком желудка наблюдается снижение уровня и нарушение суточного ритма экскреции с мочой 6-СОМТ, пропорциональное степени распространенности опухолевого процесса.
- Уровень 6-СОМТ в ночные часы может служить прогностическим фактором при раке желудка.
- Применение экзогенного мелатонина в осенний и весенний периоды увеличивает на 15 % безрецидивную 1- годичную выживаемость пациентов.
