Введение. Во всем мире терапия рака прямой кишки (РПК) является актуальной и сложной проблемой в онкологии. Сложность заключается в особенностях клинического течения (скрытый, длительный процесс, относительно большое число запущенных случаев), а также в различных подходах к терапии [1, 3, 4]. Несмотря на то, что золотым стандартом в терапии РПК является хирургический метод, многие аспекты данной проблемы решены не полностью [2, 5]. Получает развитие использование различных комбинаций неоадьювантных методов лечения РПК [6-8].
Цель исследования – оптимизация методов комплексной терапии РПК.
Материал и методы. Материалом исследования были сведения о 146 больных РПК, которым провели лучевую терапию (ЛТ), химиолучевую терапию (ХЛТ) и операцию в отделении опухолей ЖКТ Казахского НИИ онкологии с 2006 по 2011 г. В анализируемую группу вошли 69 (47,2%) женщин и 77 (52,7%) мужчин в возрасте от 26 до 86 лет. Средний возраст мужчин составил 64,6±9,4 года, женщин – 61,8±11,8 лет. В зависимости от вида проведенного лечения все больные были разделены на три группы: I группа (основная) – пациенты, которым проведена неоадъювантная ХЛТ (44 человека); II группа (аналитическая) – пациенты, получившие неоадьювантный курс ЛТ (52 человека); III группа – пациенты, получившие только оперативное лечение (50 человек). Во всех группах были проведены радикальные операции. Исследование было нерандомизированным, поэтому принципиальным явились идентичность распределения больных в группах по полу и возрасту, морфологической структуре, распространенности опухолевого процесса, характеру оперативного вмешательства. Гистологически высокодифференцированные опухоли наблюдались в 18,5%, умеренно-дифференцированные опухоли в 38,4% и низко-дифференцированные – в 43,1% случаев.
Пациентам основной группы ХТ проводилась 3 курсами с перерывом 2-3 недели в режиме FOLFIRI (иринотекан —180 мг/м2 в/в капельно в 1-й день, фолинат кальция ((лейковорин) — 200 мг/м2 в/в в 1-й день, фторурацил —400 мг/м2 в/в струйно в 1-й день, затем фторурацил —2,4-3,0 г/м2 24-часовая в/в инфузия), параллельно 3 курсу ХТ проводилась ЛТ. В аналитической группе использован режим классического фракционирования дозы: РОД 2 Гр ежедневно, 5 раз в неделю до СОД 50 Гр. Статистическая обработка проведена с помощью методов санитарной статистики, а достоверность различий – по критерию Стьюдента. Выживаемость оценена по таблице дожития.
Результаты исследования Рецидивы РПК были выявлены, в общем, у 21 пациента из 146 или в 14,4% случаев. При этом, наиболее часто рецидив заболевания отмечен при использовании монотерапии, в частности только оперативного лечения – в 11 случаях (22,0%). Затем по частоте рецидивирования находится группа пациентов получивших неоадьювантный курс ЛТ – 6 пациентов (11,5%), далее пациенты, получившие неоадьювантный курс ХЛТ – 4 больных (9,0%).
При начальных стадиях опухолевого процесса рецидивы возникли в 2 случаях при проведении ЛТ в предоперационном периоде и в 4 случаях при проведении только оперативного лечения, тогда как в группе больных получивших комплексное лечение возобновления болезни не наблюдалось. Анализ также показал, что частота рецидивов во всех исследуемых группах при Т3-4 была статистически достоверно выше, чем при Т1-2 (21,4% против 7,9%, р<0,001). При этом наиболее высокая частота рецидивирования при размере опухоли Т3-4 была отмечена в группе больных получивших только оперативное лечение (29,2%), по сравнению с Т1-2 (15,4%). В двух остальных подгруппах пациентов процент рецидивирования колебался с 16% до 18%. Следует также отметить, что количество рецидивов при Т3-4 было примерно одинаковым в группах больных получивших ЛТ и ХЛТ. Однако, в целом при сравнении этих групп для Т1-4, оказалось, что частота рецидивирования РПК была несколько меньше при ХЛТ, по сравнению с только ЛТ (9,0% и 11,5%, соответственно). Но эти различия были статистически не достоверными.
При сравнении этих групп с категорией лиц, получивших только оперативное лечение, было выявлено, что в последнем случае, рецидивы выявлены в 22,0%.
Рецидивы РПК при отсутствии метастатического поражения в лимфоузлах были отмечены в 8 случаях из 82, что составило 9,7%. Наиболее реже рецидивы встречались в данной подгруппе среди пациентов, получивших неоадьювантную ХЛТ (4,0%), затем в группе с ЛТ (6,9%) и чаще всего – в группе, где больные получили только оперативное лечение – 17,8%, что было статистически значимо (p < 0,001).
Среди пациентов, у которых имелось метастатическое поражение регионарных лимфатических узлов, рецидивы возникли в 13 случаях, т.е. в 1,6 раза чаще, чем в группе с негативными лимфоузлами. При этом, также как и в предыдущем случае, наиболее часто рецидивы отмечены в группе, получивших только операцию (27,3%), тогда как в группе получивших неоадьювантную ХЛТ рецидив опухоли отмечен в 15,8% случаев (р < 0,05).
Наиболее часто рецидивы возникали при размерах опухоли Т3-4, а также при наличии позитивных регионарных лимфоузлов. Частота рецидивов при этом колеблется от 27% до 29%.
Начиная с 1 года наблюдения и фактически до 5 года, показатели общей выживаемости были статистически достоверно выше у пациентов, получивших ХЛТ с последующей операцией. Четыре года пережили 70,4% таких больных, тогда как в группе пациентов, получивших только хирургическое лечение этот срок пережили только 52,0% исследованных (р<0,001). Эти показатели также были достоверно выше, чем те данные, которые были получены при изучении продолжительности жизни у пациентов получивших неоадьювантный курс ЛТ без химиотерапевтического воздействия. Необходимо выделить тот момент, что показатели выживаемости в сроки 3 года и более у данного контингента были достоверно выше, чем у пациентов получивших только оперативное лечение. Однако к 4 году наблюдения эти различия были статистически не значимыми (48,1% и 42,0%, соответственно).
Если учесть относительно высокие показатели 4-х летней выживаемости у пациентов основной группы (химиолучевая терапия + операция), то общая 4-х летняя выживаемость больных РПК (все группы) была равна 52,7% (рис. 1).
При высокодифференцированной аденокарциноме прямой кишки показатели 4-х летней выживаемости при проведении неоадьювантного курса лучевой или ХЛТ одинаковые (100,0% и 90,0%). При проведении только оперативного лечения показатели начинают снижаться с 3-го года наблюдения, когда значения достигают 77,8%.
При умеренно дифференцированной аденокарциноме из 17 пациентов основной группы 4 года пережили 14 или 82,3%, что было статистически достоверно выше, чем в двух группах, где выживаемость составила 52,6 и 45,0%, соответственно.
В группе больных с низкодифференцированным вариантом аденокарциномы прямой кишки выживаемость в контрольной группе составила 47,4%. В аналитической группе из 23 больных РПК выжило только 6, что составило 26,1%, а в группе получивших только оперативное лечение – 19,0%. Эти значения были статистически достоверно ниже, чем при ХЛТ. При этом, результаты выживаемости при неоадьювантной ЛТ были лучше, чем при только хирургическом лечении (p<0, 05).
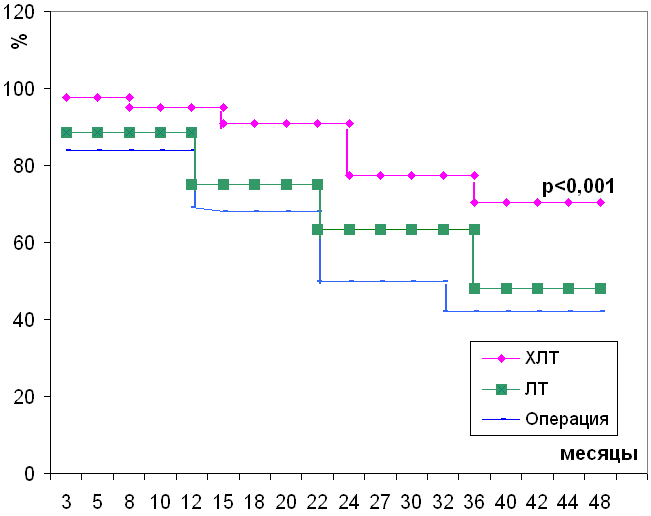
Рис. 1. Общая выживаемость больных раком прямой кишки.
Показано, что при любой степени дифференцировки опухоли показатели выживаемости были высокими в случае проведения неоадьювантного курса ХЛТ. Причем эти различия были наиболее выраженными у больных получивших лучевую и ХЛТ при высокодифференцированной аденокарциноме, по сравнению с пациентами, получившими только оперативное лечение.
Выживаемость больных в группе больных получивших неоадьювантный курс ХЛТ к четвертому году наблюдения была статистически достоверно выше при отрицательных лимфатических узлах. Такой тенденции не наблюдалось при проведении неоадьювантного курса ЛТ. При оперативном лечении, как и при ХЛТ, выживаемость при отсутствии регионарного поражения лимфоузлов была достоверно выше, чем при наличии метастазов в них.
При сравнении между основной и контрольными группами больных, и при положительных и при отрицательных лимфоузлах выживаемость была выше в группе больных, получивших неоадьювантный курс ХЛТ.
Общая продолжительность жизни у пациентов, получивших ХЛТ, при всех стадиях статистически достоверно превышает результаты, полученные при использовании только ЛТ или только оперативного лечения. Также необходимо отметить, что результаты лечения были значительно лучше (достоверная значимость) у пациентов, получивших ЛТ при I и III стадии опухоли, а при второй стадии данной разницы не выявлено.
При IV стадии опухоли 4 года и более выжил лишь один пациент из двух, получивших ХЛТ с неоадьювантной целью. При других методах лечения у больных с IV стадией выживших пациентов не было.
Заключение Комплексное лечение с использованием неоадьювантной химиолучевой терапии и с последующей операцией статистически значимо снижает частоту рецидивов и увеличивает общую продолжительность жизни.
