Введение. Рак желудка является одной из распространенных форм злокачественных опухолей в мире. С 2002 по 2007 г. в России абсолютное число вновь выявленных больных этой патологией снизилось на 10,7% у мужчин и на 7,6% у женщин [1]. Несмотря на это, в России рак желудка занимает 2-е место в структуре онкологической заболеваемости и летальности. В настоящее время радикальное хирургическое вмешательство является единственным методом лечения, позволяющим продлить жизнь данной категории больных [2].
Гастрэктомия остается операцией выбора при раке желудка. Изучение ближайших и отдаленных результатов хирургического лечения опухолей данной локализации показывает, что у определенного числа пациентов возникает ряд функциональных и органических расстройств, которые не только снижают качество жизни больного, но и могут служить причиной инвалидности или даже летального исхода. По данным ряда авторов, почти у каждого четвертого из оперированных больных в отдаленном периоде развиваются нарушения процесса пищеварения в различных формах и проявлениях [3,4]. По данным других авторов частота постгастрэктомических осложнений достигает 30-40% [9]. Патологические изменения, возникающие в различные сроки после гастрэктомии, чаще всего расцениваются как возобновление основного заболевания. Такая позиция хирургов-онкологов связана с высокой частотой локорегионарных рецидивов после радикальных операций (по данным литературы в 20-30% случаев) [5,6].
Одним из методов, способных улучшить качество жизни таких пациентов, является выполнение реконструктивной операции. При этом производится релапаротомия с резекцией зоны пищеводно-кишечного анастомоза, которая представляет большую опасность в плане развития несостоятельности вновь сформированного соустья [7]. Такие вмешательства относятся к одним из наиболее сложных хирургических вмешательств, требующих высокого уровня хирургической техники оперирования в условиях выраженного спаечного процесса и измененной анатомии органов брюшной полости.
Подобная онкологическая настороженность затрудняет диагностику состояний не связанных с первичным раком желудка, в том числе: опухоли другой локализации, острых заболеваний органов брюшной полости, рубцового стеноза пищеводного анастомоза, спаечного процесса в верхнем этаже брюшной полости. Хирургу повседневно приходится решать диагностические и лечебные задачи, имея дело с пациентами, перенесшими оперативные вмешательства на желудке. В эту группу нередко входят онкологические больные, которые на момент клинического обследования не имеют признаков рецидива или метастазов рака, но страдают различными по тяжести патологическими синдромами оперированного желудка.
Рентгенологическое исследование является важным средством распознавания поздних осложнений оперативных вмешательств на желудке. При этом оценивают морфологическое строение и функцию трансплантата, в частности регистрируют его ритмические сокращения. После операций, выполненных по поводу рака желудка, проводят систематические контрольные рентгенологические исследования с целью обнаружения возможного рецидива опухоли [8].
Цель. Представляем следующие клинические случаи повторных оперативных вмешательств при раке желудка после гастрэктомии с предоперационной химиоиммунотерапией, при которых выполнены различные по характеру реконструктивные операции на тонкой кишке.
Материалы и методы. Пациентка Ф., 60 лет, поступила в торакоабдоминальное отделение Ростовского научно-исследовательского онкологического института (ТАО РНИОИ) 01.06.2008 с жалобами на общую слабость, снижение массы тела, затрудненное прохождение твердой пищи по пищеводу. При фиброгастроскопии (ФГС) выявлена опухоль кардиального отдела желудка с переходом на абдоминальный отдел пищевода. Пациентке с удовлетворительной переносимостью проведено 2 курса неоадъювантной химиоиммунотерапии по схеме: в первый день внутривенно капельно введен Таксотер 75 мг/м2 на растворе 5% глюкозы и Ронколейкин 1 млн. Ед. на физиологическом растворе. С 1 по 14 дни пациентка получала капецитабин в дозе 1250 мг/м2 в сутки. На 3-й и 5-й дни внутривенно капельно произведено повторное введение Ронколейкина по 1 млн. Ед. Интервал между курсами составил 21 день. Через 7 дней после окончания 2-го курса пациентка госпитализирована для проведения оперативного лечения.
13.07.2008 пациентке выполнена операция в объеме: гастрэктомия, резекция абдоминального отдела пищевода, с формированием позадиободочного инвагинационного пищеводно-тонкокишечного анастомоза на выключенной по Ру петле тонкой кишки, лимфодиссекция D2. Гистологическое заключение - низкодифференцированная аденокарцинома. Послеоперационный период протекал без осложнений, больная выписана на амбулаторное лечение спустя 10 суток после операции.
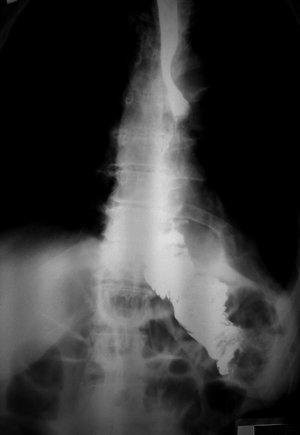
7.03.2010 пациентка повторно обратилась в институт с жалобами на периодические боли в животе, рвоту съеденной пищей, задержку стула и газов. На обзорной рентгенография органов брюшной полости и грудной клетки в прямой и правой боковой проекциях барием заполнен пищеводно-тонкокишечный анастомоз и отводящая петля тонкой кишки (рис. 1,2).
 |
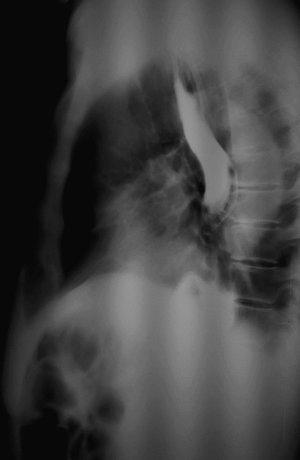 |
| Рис. 1. Обзорная рентгенография органов брюшной полости и грудной клетки (прямая проекция). Барием заполнен пищеводно-тонкокишечный анастомоз и отводящая петля тонкой кишки. | Рис. 2. Обзорная рентгенография органов брюшной полости и грудной клетки (боковая проекция). Барием заполнен пищеводно-тонкокишечный анастомоз и отводящая петля тонкой кишки. |
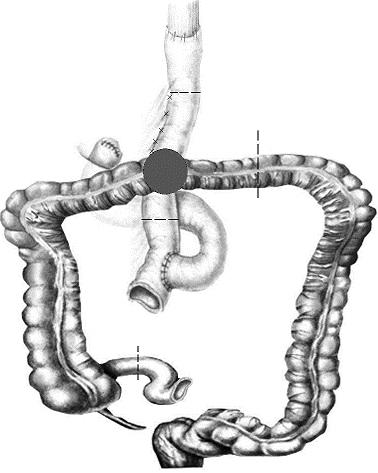
Эндоскопическом исследование данных за рецидив в анастомозе не выявило. При фиброколоноскопии обнаружена опухоль поперечной ободочной кишки. При ультразвуковом исследовании (УЗИ) и компьютерной томографии (КТ) органов брюшной полости данных за генерализацию процесса нет. 10.03.2010 взята в операционную. При ревизии выявлена опухоль поперечной ободочной кишки с метастатическим поражением лимфатических узлов ворот селезенки, прорастающая участок тонкой кишки, ранее сформированного по Ру трансплантата (рис.3). Пациентке выполнена гемиколэктомия справа, резекция поперечной ободочной кишки, спленэктомия и резекция участка тонкой кишки, идущей к пищеводному анастомозу. При этом сохранена брыжейка тонкой кишки и соответственно кровоснабжение пищеводно-кишечного анастомоза. Непрерывность желудочно-кишечного тракта восстановлена путем формирования двухрядного тонко-тонкокишечного анастомоза конец-в-конец, а также трехрядного илеотрансверзоанастомоза бок-в-бок (рис. 4).
 |
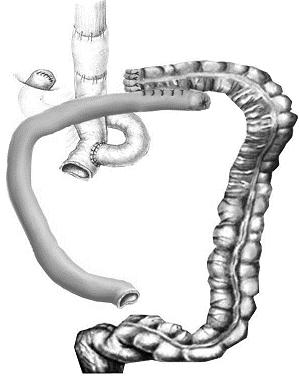 |
| Рис. 3. Опухоль селезеночного угла ободочной кишки с метастатическим поражением лимфатических узлов ворот селезенки, прорастающая участок тонкой кишки, ранее сформированного по Ру трансплантата. | Рис. 4. Схема реконструктивного этапа операции. |
Гистологическое заключение – умереннодифференцированная аденокарцинома. Послеоперационный период протекал гладко, дренажи удалены на 8-е сутки, швы сняты на 14-е сутки после операции.
При контрольном плановом обследовании (УЗИ, КТ) выявлено опухолевое образование в проекции левой почки, интимно прилежащее к хвосту поджелудочной железы. 18.07.2011 пациентке выполнена релапаротомия, при которой выявлен опухолевый конгломерат, интимно прилежащий к хвосту поджелудочной железы, включающий в себя левую почку, петлю тонкой кишки. Выполнена операция в объеме: нефрэктомия слева, резекция хвоста поджелудочной железы, резекция петли тонкой кишки. Гистологическое заключение низкодифференцированная аденокарцинома. Послеоперационный период протекал без осложнений, пациентка выписана на 12-е сутки на амбулаторное лечение.
Пациентка Г., 59 лет, обратилась в ТАО РНИОИ 12.08.2009 с жалобами на общую слабость, отсутствие аппетита, снижение массы тела. При ФГС выявлена опухоль тела желудка. Пациентке с удовлетворительной переносимостью проведено 2 курса неоадъювантной химиоиммунотерапии по вышеописанной схеме. 22.09.2009 больной выполнена гастрэктомия, спленэктомия, лимфодиссекция D2. Непрерывность желудочно-кишечного тракта восстановлена формированием позадиободочного инвагинационного пищеводно-тонкокишечного анастомоза. Гистологическое заключение - высокодифференцированная аденокарцинома.
Больная повторно обратилась в ТАО РНИОИ 01.07.2011 с жалобами на затрудненное прохождение твердой пищи по пищеводу, рвоту после приема пищи, периодические боли в эпигастральной области, вздутия живота, снижение массы тела. Болеет около 2-х месяцев, когда появился дискомфорт за грудиной во время приема пищи. При УЗИ и КТ органов брюшной полости данных за генерализацию основного заболевания не выявлено. При фиброскопии пищеводно-кишечное соустье проходимо, данных за рецидив в анастомозе нет. 12.07.2011 больная взята в операционную. После висцеролиза в верхнем этаже брюшной полости выявлен конгломерат петель тонкой кишки. После мобилизации и диафрагмотомии выше уровня диафрагмы выявлен расширенный участок тонкой кишки. Случай расценен как ущемление петли тонкой кишки в пищеводном отверстии диафрагмы. Выключена петля тонкой кишки по Ру с формированием тонко-тонкокишечного анастомоза по типу «конец-в-бок». Трансплантат проведен в окне брыжейки ободочной кишки к приводящему колену ущемленной тонкой кишки. Таким образом сформирован обходной энтеро-энтероанастомоз на выключенной по Ру петле тонкой кишки. Дренажи установлены в средостении к межкишечному анастомозу, а также по левому латеральному каналу. Послеоперационный период протекал без осложнений. Дренажи удалены на 9-е сутки, швы сняты на 14-е сутки после операции.
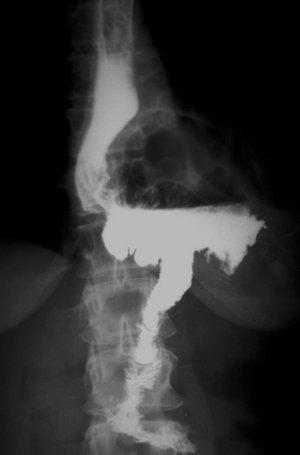
Через 2 месяца после операции пациентке выполнена обзорная рентгенография органов брюшной полости и грудной клетки в прямой и правой боковой проекциях. Барием заполнен сформированный обходной энтеро-энтероанастомоз на выключенной по Ру петле тонкой кишки (рис. 5,6).
 |
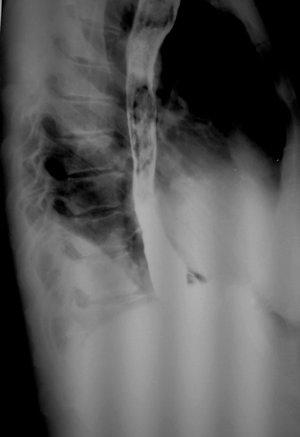 |
| Рис. 5. Обзорная рентгенография органов брюшной полости и грудной клетки (прямая проекция). Барием заполнен обходной энтеро-энтероанастомоз на выключенной по Ру петле тонкой кишки. | Рис. 6. Обзорная рентгенография органов брюшной полости и грудной клетки (боковая проекция). Барием заполнен обходной энтеро-энтероанастомоз на выключенной по Ру петле тонкой кишки. |
Выводы. Представленные наблюдения повторных операций при раке желудка после гастрэктомий показывают эффективность неоадъювантной химиоиммунотерапии в лечении рака желудка, при этом пациенты живут без рецидивов и генерализации, иногда доживая до своей второй опухоли или поздних осложнений хирургического лечения. При этом показана возможность выполнения различных по своему характеру реконструктивных операций на тонкой кишке, не сопровождающихся резекцией пищеводно-кишечного анастомоза.
