Множественная миелома (ММ) – это злокачественное В-клеточное лимфопролиферативное заболевание, субстратом которого являются плазматические клетки, продуцирующие моноклональные иммуноглобулины. Множественная миелома характеризуется выработкой моноклонального сывороточного белка (М-градиента) и остеолитическими деструктивными поражениями костной ткани [1,2].
На множественную миелому приходится 20% от всех гемобластозов. Этот патологический процесс составляет 1% от всех злокачественных опухолей. В последнее время во всем мире отмечается неуклонный абсолютный (не связанный с улучшением диагностики) рост заболеваемости ММ [2].
В нашей стране по данным выборочных исследований ММ встречается в 5,3% случаев всех заболеваний крови. По результатам наблюдения в России в структуре заболеваемости гемобластозами она стойко занимает второе место. По данным РОНЦ им. Н.Н. Блохина РАМН, заболеваемость множественной миеломой составляет 1,24 на 100000 населения, примерно 2300 случаев в год [3].
Болеют множественной миеломой преимущественно люди в возрасте старше 40 лет, медианой возраста, когда ставится диагноз ММ, является начало седьмого десятка жизни. Пик заболеваемости приходится на возраст 68 лет. В то же время заболевание может встречаться у лиц молодого возраста, начиная с 18 лет. Доля лиц моложе 40 лет среди больных миеломной болезнью составляет 5-10%. Описаны лишь единичные пациенты с ММ моложе 30 лет. Мужчины болеют несколько чаще, чем женщины (соотношение 3:2) [4].
Течение ММ характеризуется прогрессированием лейкемического процесса, которому сопутствует неизбежное накопление клеточной массы опухоли в костном мозге и продуктов ее жизнедеятельности в периферической крови и моче, которые сопровождаются такими клинико-гематологическими синдромами, как вторичные иммунодефицитные состояния, остеопороз, анемический синдром [2].
Клеточным субстратом, определяющим развитие и клинические проявления множественной миеломы, являются плазматические клетки. Определение на поверхности этих клеток помимо антигенов зрелых плазмоцитов (R1-3) пре-В-клеточных антигенов (САLLА) и антигенов моноклональных сIg позволяет говорить о том, что формирование опухолевого клона клеток, определяющего ММ, происходит на уровне стволовых полипотентных клеток-предшественниц, подвергающихся дозреванию и дифференцировке [2,3].
Фенотип плазматических клеток при ММ имеет несколько особенностей. Во-первых, в процессе трансформации В-лимфоцитов в плазматические клетки теряется большинство специфических маркеров. Вторая особенность заключается в приобретении в процессе трансформации большого количества адгезивных структур [5].
Наиболее важными иммунными маркерами плазматических клеток являются СД138+ и СД38, а также присутствие в цитоплазме IgG, IgA, редко D-, E-, L-цепи. Все плазматические клетки экспрессируют СД38+, который является рецептором к СД31+, представленным на поверхности эндотелиальных клеток. Благодаря взаимодействию СД38+ с СД31+ на клетках сосудистого эндотелия миеломные клетки приобретают способность проникать через стенки кровеносных сосудов. Кроме этого, плазматические клетки экспрессируют молекулы адгезии СД54+. Экспрессия СД54+ – антигена, который принимает участие в активации и созревании лейкоцитов, снижается на стадии плазмоклеточной дифференцировки. Для плазматических клеток наиболее характерно сочетание высокой экспрессии СД38+ с низкой экспрессией (или ее отсутствием) СД54+. Представительство этих антигенов (СД38+++, СД44+, СД45-/+, СД54+, СД138+) и cIg является характерным как для нормальных плазматических клеток, так и для миеломных [3,9].
Основным иммунным маркером, позволяющим дифференцировать опухолевые и неопухолевые плазматические клетки, служит антиген СД19+. Нормальные плазматические клетки обычно сохраняют способность к экспрессии СД19+ (одного из самых ранних В-линейных антигенов), в то время как большинство миеломных клеток теряют способность к его экспрессии. Кроме того, на поверхности миеломных клеток часто выявляются СД58+ – лимфоцитарный функционально-ассоциированный антиген-3 и СД56+ – молекула адгезии нервных клеток. Эти маркеры обычно на нормальных плазматических клетках не обнаруживаются [5].
Выраженная экспрессия СД28+ (молекула, принимающая участие в стимуляции Т- и В-лимфоцитов) выявляется при высокой пролиферативной активности миеломных клеток, обычно при прогрессировании и рецидивах болезни, и отсутствует на нормальных плазматических клетках.
На основании этого при ММ выделяют следующие иммунофенотипические варианты миеломных клеток:
- с иммунофенотипом СД138+, СД38+, СД 19-, слабой экспрессией СД45+ и высокой экспрессией СД54+ антигенов;
- с иммунофенотипом СД138+, СД38+, СД 19-, слабой экспрессией СД45+ и СД54+ антигенов;
- экстрамедуллярные клетки имеют фенотип: СД19-, СД138+, СДЗ8+, СД28+ со слабой экспрессией СД54+ антигена;
- фенотип плазмоклеточного лейкоза: СД20+, СД54-, СД28+.
При всех указанных типах ММ в процессе прогрессирования болезни количество СД28+ клеток в костном мозге нарастает [3].
Значительный интерес представляет характер иммунных нарушений при множественной миеломе. Иммунные нарушения у больных ММ могут быть индуцированы самим заболеванием в виду недостаточности антител. В то же время проводимая пациентам цитостатическая терапия вызывает нарушения клеточного иммунитета [5]. Это значительно усложняет проблему терапии ММ, когда необходимо вызвать ремиссию заболевания и избежать тяжелых инфекционных осложнений.
Первые успехи в терапии множественной миеломы связаны с синтезом в 1953 г. в России сарколизина и в том же году в Англии - его левовращающего изомера, названного мелфаланом [1,2].
В начале 1980-х годов при лечении больных с множественной миеломой стали применять высокодозную терапию с пересадкой костного мозга. Высокодозная химиотерапия дала возможность не только преодолеть резистентность у некоторых больных, но и получить полные ремиссии у 30% пациентов [6,8].
Длительный поиск оптимизации терапии ММ не позволял достигать продолжительных ремиссий заболевания и не менял на протяжении последних десятилетий показатели выживаемости больных с этой патологией. Несмотря на появление новых противоопухолевых препаратов пятилетняя выживаемость больных ММ, получающих адекватную медикаментозную терапию, составляет 35% [7]. Только применение интенсифицированных курсов полихимиотерапии (VAD, VBMP), высокодозной химиотерапии, трансплантации костного мозга изменили кардинальным образом прогноз у пациентов с ММ. Однако возрастные ограничения, наличие сопутствующей соматической патологии у большинства больных множественной миеломой не позволяли использовать указанную терапию.
Такая ситуация с лечением ММ изменилась с созданием лекарственного препарата – бортезомиб (велкейд). С 2003 г. в США и с 2004 г. в Европе его стали использовать в качестве первой линии терапии [7]. Это препарат с принципиально новым механизмом действия: он является высокоселективным ингибитором протеасомы 26S и представляет собой модифицированную борную кислоту. Протеасома 26S присутствует в ядре и цитозоле всех эукариотических клеток и является ключевым компонентом, катализирующим расщепление основных белков, участвующих в управлении жизненным циклом клеток. Бортезомиб ингибирует химотрипсиноподобное действие протеасомы, вызывает торможение протеолиза и приводит к апоптозу клеток [7,9].
В эксперименте (in vitro) было показано, что миеломные клетки почти в тысячу раз более восприимчивы к апоптозу, вызванному бортезомибом, чем нормальные клетки крови (включая лимфоциты и плазмоциты).
В открытом многоцентровом исследовании SUMMIT, проведенном в рамках второй фазы клинических испытаний бортезомиба, эффект от терапии этим препаратом был получен в 94% случаев (35% - минимальный эффект, 59% - значимый эффект со стабилизацией состояния больных) [5,10].
Однако, как и любой противоопухолевый препарат, бортезомиб не лишен токсических свойств. Прежде всего необходимо учитывать его нейро-, гепато-, кардио-, нефротоксичность. Принимая во внимание механизм действия велкейда, несомненным является его цитотоксическое действие на клетки крови и костного мозга, что характеризуется развитием возможных цитопенических состояний. Нейтропения, обусловленная прямым или опосредованным действием бортезомиба, несомненно, приводит к развитию вторичного иммунодефицита, который может манифестироваться витальными инфекционными осложнениями.
В связи с указанным, на наш взгляд, значительный интерес представляет изучение влияния бортезомиба на показатели иммунного статуса больных множественной миеломой, а также поиск объективных диагностических факторов, определяющих вероятность развития тяжелых инфекционных осложнений. Нами была предпринята попытка оценить характер иммунных нарушений у больных диффузной множественной миеломой, леченных бортезомибом в качестве терапии первой и второй линии.
В качестве объекта исследования было взято 43 пациента с множественной миеломой II-III стадии, получающие лечение в отделении гематологии клиники Ростовского государственного медицинского университета, из них 19 мужчин и 24 женщины. Средний возраст обследуемых составил 58,41±2,11 лет. Срок наблюдения составил в среднем 2,2±0,9 года. Все пациенты получили в среднем 8 курсов лечения сочетания бортезомиба с дексаметазоном. Диагноз всем обследуемым был установлен на основании наличия в миелограмме более10% плазматических клеток, обнаружения моноклональных иммуноглобулинов в сыворотке крови и/или моче, остеолитических деструктивных очагов в костях. У всех обсдедуемых определялось содержание в крови и костном мозге СД4, СД8, СД19, СД20, СД95-позитивных клеток. Цитохимическими методами оценивался уровень в гранулоцитах липидов, гликогена и активность кислой, щелочной фосфотаз.
У 16 пациентов (7 женщин и 9 мужчин) после 8 курсов лечения была достигнута полная ремиссия заболевания, характеризующаяся отрицательными результатами иммунофиксации сыворотки крови и мочи, уровнем плазматических клеток менее 5%. Частичная ремиссия была зафиксирована у 12 пациентов (5 женщин и 7 мужчин), что характеризовалось уменьшением уровня парапротеинов в крови и моче более чем на 50% по отношению к исходным значениям, снижением плазмоцитарной метаплазии костного мозга более чем на 50%. В шести клинических случаях (4 женщины и 2 мужчин) медикаментозная терапия привела лишь к стабилизации процесса, а у 9 больных (2 женщины и 7 мужчин) ММ не было получено положительного эффекта, что расценивалось как резистентность к проводимой терапии.
У пациентов, не получивших положительного результата от терапии, в среднем каждый второй курс лечения сопровождался инфекционными осложнениями: обострение хронического пиелонфрита, хронического бронхита, пневмония, herpes zoster, которые были купированы назначением антибактериальных и противовирусных средств, введением препаратов иммуноглобулинов. Среди больных, достигщих полной ремиссии ММ (16 чел.), у четверых после курсов лечения бортезомибом и дексаметазоном были отмечены те же инфекционные осложнения в спеднем по 2 эпизода на восемь курсов терапии. Регресс этих явлений был, достигнут с помощью назначения антибактериальных препаратов без использования препаратов иммуноглобулинов. В подгруппе обследуемых, достигших частичной ремиссии заболевания на фоне базисной терапии, инфекционные осложнения были отмечены практически у каждого второго в среднем по 2 эпизода за срок наблюдения. В основном у этих больных отмечались эпизоды клинической манифестации острых обструктивных бронхитов.
Оценка показателей общего анализа крови и миелограммы у пациентов с ММ на момент начала базисной терапии не выявила достоверных отличий. Средний уровень гемоглобина составил 111,6±11,39 г/л; эритроцитов – 3,53±0,58х1012 кл/л; лейкоцитов – 4,72±0,28х109 кл/л; тромбоцитов – 172,38±40,57х109 кл/л; СОЭ – 49,32±11,54 мм/ч. Уровень плазматических клеток в миелограмме всех обследуемых находился в пределах 24,89±15,37%. Ни у одного из пациентов не было зарегистрировано значимого повышения уровня креатинина, мочевины и кальция, среднее количество общего белка составило 86,23±3,78 г/л.
Результаты оцениваемых показателей иммунного статуса обследуемых представлены в табл. 1. Учитывая отсутствие достоверной разницы в уровне среднего содержания лейкоцитов периферической крови больных ММ до и после базисной терапии, нами приведены данные по относительному содержанию анализируемых субпопуляций лимфоцитов.
Таблица 1. Показатели иммунного статуса больных ММ до и после 8 курсов терапии бортезомибом в сочетании с дексаметазоном
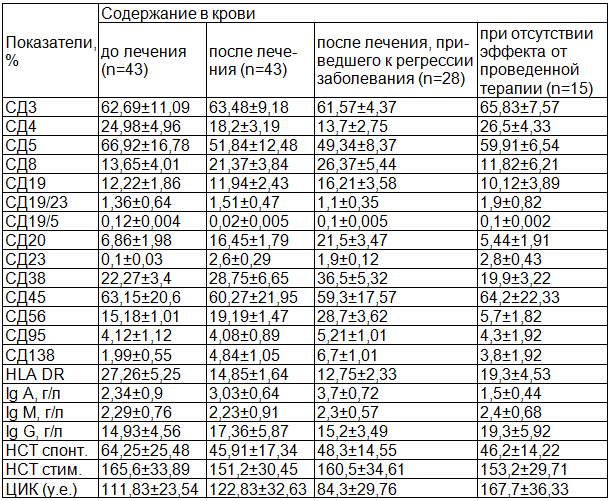
Более значимые изменения выявлены со стороны лимфоцитов, экспрессирующих на своей поверхности В-клеточные антигены. Степень снижения уровня В-лимфоцитов в костном мозге в отличие от показателей периферической крови коррелировала с активностью патологического процесса и рассчитываемой опухолевой массой. Отмечено достоверное повышение уровня СД20- и СД23-позитивных клеток, что сопровождалось резким снижением СД19/5+-лимфоцитов. Это привело к нормализации уровня и соотношения иммуноглобулинов классов А, М и G, хотя при этом уровень клеток, экспрессирующих активационные маркеры (HLA DR), заметно снизился, а уровень СД56+ и СД138+ почти в три раза увеличился после проведенных курсов гормональной и цитостатической терапии.
Изменения изучаемых Т-клеточных субпопуляций лимфоцитов проявились достоверным снижением количества СД4+, повышением количества циркулирующих СД8+-клеток.
При сопоставлении показателей иммунного статуса больных ММ по наличию эффекта от цитостатической терапии обследуемые были разделены на 2 подгруппы: 28чел. с достигнутой полной или неполной ремиссией заболевания; 15 чел. - без положительного эффекта от лечения.
На фоне регрессии опухолевого процесса получено значимое увеличение содержания в крови СД20+- и СД19+-клеток при достоверном увеличении концентрации иммуноглобулинов А и снижении иммуноглобулинов класса G. Вероятно, это обусловлено тем, что все обследуемые имели G-форму ММ.
Снижение уровня СД8+ и повышение СД4+ было характерно для пациентов, не достигших положительного эффекта от лечения бортезомибом в сочетании с дексаметазоном, при этом более значимое отличие выявлено у больных с инфекционными вирусными осложнениями. Минимальный уровень СД20+ лимфоцитов зафиксирован при развитии бактериальных осложнений (3,4±1,21), но уровень СД19+ значимо не отличался у этих пациентов. Значительное снижение СД38- и СД56-позитивных клеток было зафиксировано при отсутствии эффекта от цитостатической терапии и не имело четкой зависимости от эпизодов инфекционных бактериальных и вирусных осложнений.
Оценив цитохимические показатели костного мозга, нами было получено, что у больных при отсутствии эффекта от терапии бортезомибом отмечено значительное повышение активности щелочной фосфотазы в незрелых клетках гранулоцитарного ряда и снижение активности в зрелых. Это расценивалось как формирование дизадаптивных нарушений со стороны иммунной системы в результате токсического действия препарата при минимальном положительном эффекте в отношении сокращения опухолевой массы в организме пациента множественной миеломой. Указанные цитохимические изменения в гранулоцитах опережали развитее нейтропении и не коррелировали с выраженностью лейкопении.
Таким образом, полученные нами данные позволяют предложить использование иммунофенотипирования лимфоцитов периферической крови у больных ММ для прогнозирования и оценки достижения положительного эффекта от лечения бортезомибом и дексаметазоном, определения степени риска развития инфекционных осложнений. Повышение уровня СД19-, СД20-позитивных клеток может быть использовано как предиктор формирования значимого положительного эффекта от базисной терапии ММ. Снижение уровня СД20+, СД8+ и повышение концентрации СД4+ определяет высокую вероятность развития инфекционных осложнений.
Также анализ изменений показателей иммунного статуса больных диффузной множественной миеломой, получавших лечение бортезомибом, дает возможность предложить ранние диагностические критерии, определяющие высокую вероятность отсутствия эффекта от терапии после 4 блоков введений (уменьшение относительного и абсолютного содержания СД38+ и СД56+ клеток, цитохимические признаки дисгранулоцитопоэза по отношению активности щелочной фосфотазы в клетках гранулоцитарного ряда).
Кроме того, больным множественной миеломой, у которых наряду со снижением активности и количества Т-лимфоцитов отмечено значительное повышение активности щелочной фосфотазы в незрелых клетках гранулоцитарного ряда, показано прекращение дальнейшего лечения бортезомибом и назначение гранулоцитарных колоний-стимулирующих факторов с целью профилактики тяжелых инфекционных осложнений. Профилактическое введение таким пациентам нормальных донорских иммуноглобулинов с кратностью 1 раз в 3 дня (5 доз внутримышечно) приводит к снижению частоты развития инфекционных осложнений на 62,5% по сравнению с больными, которые не получали сопроводительной иммунозаместительной терапии.
