Актуальность. Рак поджелудочной железы (РПЖ) продолжает оставаться актуальной проблемой. Согласно статистическим данным последних лет, в структуре заболеваемости злокачественными новообразованиями органов пищеварения рак поджелудочной железы составляет 11,4%, что соответствует четвертому ранговому месту после рака желудка, ободочной и прямой кишки [1].
В России в 2003 по 2008 г. также отмечено увеличение абсолютного числа вновь выявленных больных как мужского (0,9%), так и женского пола (13,1%).
Особенности клинической картины РПЖ – длительное скрытое течение, сходство с манифестацией хронического панкреатита, крайне ограниченные возможности получения морфологической верификации процесса, обуславливают позднюю диагностику РПЖ у подавляющего большинства больных [2].
Основным методом лечения РПЖ является хирургический. Однако, многочисленные клинические и морфологические данные свидетельствуют о том, что стандартная панкреатодуоденальная резекция у больных протоковым раком поджелудочной железы к сожалению остается по объему, только как паллиативная операция, а продолжительность жизни при этом не превышает 12–18 месяцев [4-6].
Морфологическое исследование удалённых узлов брюшной полости у 80% всех умерших, страдавших раком головки поджелудочной железы, убедительно доказали наличие микрометестазов в перипанкреатических регионарных лимфоузлах и в лимфоузлах юкстарегионарного коллектора, которые при стандартном варианте панктеатодуоденальной резекции (ПДР) не удаляются [3].
Таким образом, проблема лечения больных раком головки поджелудочной железы в настоящее время далека от решения, и поиски новых методов, предусматривающих использование сочетания хирургического лечения с другими методами, в частности с лучевой и лекарственной терапией, представляются актуальными.
Цель: разработать критерии эффективности разработанной методики предоперационной химиолучевой терапии рака поджелудочной железы.
Материалы и методы. Клинический материал касается 25 больных раком головки поджелудочной железы. В основную группу вошли 15 пациентов, которым была выполнена панкреатодуоденальная резекция с предоперационной химиолучевой терапией по разработанной нами методике, в контрольную группу вошло 10 больных раком поджелудочной железы, которым выполнена только аналогичная стандартная панкреатодуоденальная резекция. Средний возраст пациентов в основной группе составил 60,3±0,3; в контрольной - 59,8±0,4 года. Мужчин среди пациентов было 7 человек в основной группе и 4 в контроле, а женщин 8 в основной группе и 6 в контрольной. Послеоперационное патоморфологическое исследование препаратов в основной группе диагностировало протоковую аденокарциному различной степени дифференцировки: высокодифференцированная – 3 (20%), умереннодифференцированная – 8 (53,3%), низкодифференцированная – 3 (20%), нейроэндокринный рак – 1 (6,7%).В контроле высокодифференцированная аденокарцинома встретилась у 2 больных (20%) , умереннодифференцированная – 5 (40%), низкодифференцированная – 2 (20%) , нейроэндокринный рак – 1 (10%). По стадиям заболевания, согласно седьмому изданию классификации TNM (аббревиатура от tumor, nodus и metastasis) пациенты основной группы распределились следующим образом: II стадия заболевания T3NoMo наблюдалась у 6 пациентов (40%), III стадия у 9 больных (60%), T2N1Mo - 4 человека (26,7%), T3N1Mo – 5 человека (33,3%). В контрольной T3NoMo (II стадия) наблюдалась у 4 пациентов (40%), III стадия у больных (60%) , T2N1Mo - 2 человек (20%) , T3N1Mo – 4 человека (40%). Различий между группами не было.
Методика. Больным до операции была выполнена катетеризацию пупочной вены под местной анестезией с последующим проведением курса дистанционной гамма-терапии укрупненными фракциями по 3 Гр на опухоль поджелудочной железы и зоны регионарного метастазирования, СОД = 40 Гр. На фоне лучевой терапии пациентам вводили в установленный катетер пупочной вены 1 раз в неделю цисплатин в дозе 30мг/м2 (суммарно 60-80 мг/м2 за курс). Цисплатин выступал в роли радиофарммодификатора. Кроме того, 2 раза в неделю (3-4 курса) вводили 500 мг 5-фторурацила, суммарно 2 г.
Для оценки эффективности проведенной терапии нами было выполнено исследование послеоперационных биоптатов опухоли на проточном цитометре BD FACS Canto II всем больным контрольной и основной группы. Так же для объективизации эффектов модифицированной химиолучевого воздействия нами был использован флуоресцентный микроскоп «AxioImager M2» Zeiss. Нами были исследованы дополнительные морфофункциональные показатели ткани и клетки удаленной опухоли железы, а также лейкоцитов и лимфоцитов, инфильтрирующих поджелудочную железу (ПЖ). Исследовали флуоресцентные показатели доксорубицина, связавшегося с клетками ПЖ, а также флуоресценцию потенциалозависимых красителей аниона АНС и катиона ДСМ, связанных как с лимфоцитами, так и с клетками опухоли ПЖ для оценки мембранного потенциала клеток [8].
Результаты исследований и их обсуждения. У всех больных основной группы переносимость химиолучевой терапии была удовлетворительной. Осложнения терапии наблюдались у 4 больных, что проявлялось тошнотой и однократной рвотой.
Предварительные клинические результаты: за первый год наблюдений в контрольной группе умерло 30% пациентов, в основной группе живы все. Дальнейшие результаты нашего исследования представлены в виде клинических примеров.
Основная группа. В основной группе наблюдений приведенные примеры отражают 2 типа типичных случая чувствительности опухоли к модифицированной химиолучевой терапии.
Пациент М-в, 65 лет, обратился в РНИОИ с жалобами на слабость, снижение массы тела. При обследовании на компьютерном томографе 27.12.11 - опухоль головки поджелудочной железы 2х3 см. Был оперирован 16.01.2012, выполнена панкреатодуоденальная резекция. Гистологический анализ №7258/12 от 16.01.2012 - умереннодифференцированная аденокарцинома.
По результатам проточной цитометрии содержание анеуплоидных клеток составило 10,50%, для характеристики анеуплоидных клеток опухоли нами вычислен индекс ДНК, который характеризует отношение интенсивности флюоресценции пика анеуплоидных клеток (номер канала) к диплоидному. При изучении клеточного цикла было установлено, что под влиянием лучевой терапии у данного пациента повысилась доля клеток в фазе G1. При гистологическом исследовании удаленного препарата нами было обнаружено ослизнение стромы опухоли на фоне некроза (рис. 1,2).
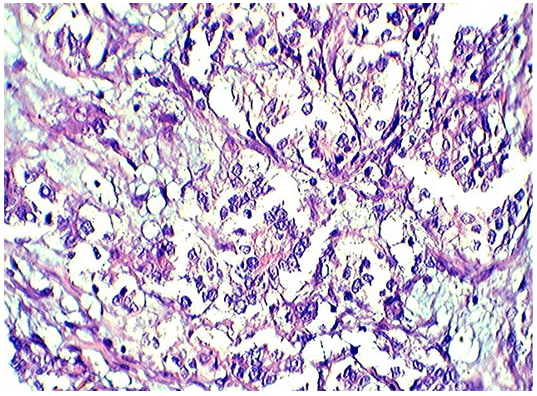
Рис. 1. Протоковый рак из желез различных размеров со слущенным эпителией, некрозом в просветах и ослизнением стромы. Окраска гематоксилином и эозином. Х400
Пациент А-в, 59 лет, обратился в РНИОИ с жалобами на быструю утомляемость, снижение массы тела. При обследовании на компьютерном томографе 13.02.12 - опухоль головки поджелудочной железы 3,5х3 см.
Был оперирован 15 февраля 2012, выполнена панкреатодуоденальная резекция. г/а №10327-8/12 от 15.02.2012 умеренно дифференцированная протоковая аденокарцинома с очагами некроза, фиброза, миксоматоза.
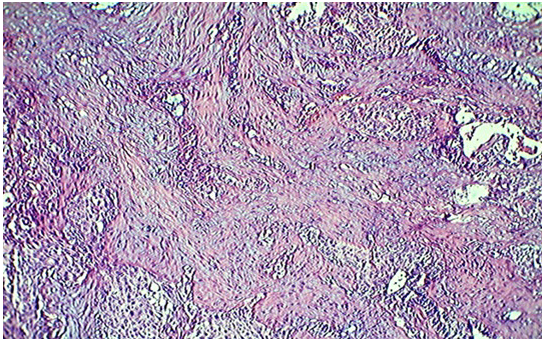
Рис. 2. Раковые железы среди крупных полей склероза с ослизнением. Окраска гематоксилином и эозином. Х 100
На проточном цитометре у данного пациента отмечалось повышение доли анеуплоидных клеток до 22,7%, тогда как в контрольной группе он составлял в среднем 9-10%. Кроме того у больного отмечалось снижение скорости пролиферации (доля клеток в S-фазе). Гистологически в опухоли отмечаются обширные очаги некроза (рис. 3), отразившиеся на ДНК-цитометрических параметрах опухоли в виде снижения параметров флюоресценции основных пиков. Таким образом, в этом случае можно было констатировать максимальный ответ опухоли на применение разработанной методики химиолучевой терапии.
Контрольная группа. Пациент Д-в, 46 лет, обратился в РНИОИ с жалобами на умеренные боли в эпигастрии, снижение массы тела. При обследовании на компьютерном томографе 13.02.12 опухоль головки поджелудочной железы 4,2х2,7 см.
Результаты проточной цитометрии. В диплоидном клоне опухоли доля клеток в G1 = 89,44%, G2 =13,77%, и S-фазе митоза = 10,56%.
Анеуплоидных клеток 9,4%, что значительно превышает показатели в группе с проведенной модифицированной химиолучевой терапией. Скорость пролиферации анеуплоидного клона опухоли (доля клеток в S-фазе) и индекс пролиферации также был повышен.
При гистологическом исследовании: опухоль на границе с неизмененной поджелудочной железой, отграниченная плотноволокнистой соединительной тканью (рис. 4).
У всех больных, получавших предоперационную лучевую терапию в клеточной взвеси наблюдали обилие лимфоцитов среди клеток опухоли ПЖ, т.е. наличие лимфоцитарной инфильтрации. У больных без предоперационной терапии также наблюдали в клеточной взвеси лейкоциты и лимфоциты, но в значительно меньшем количестве.
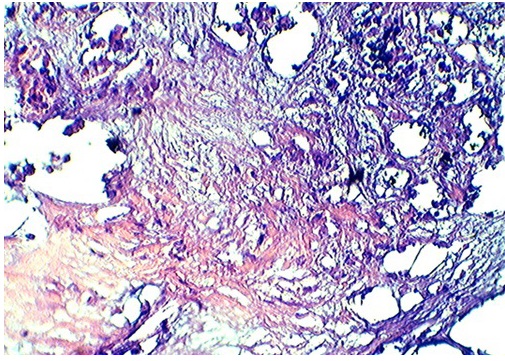
Рис. 3. Очаги некроза в раковых железах. Лимфоидная инфильтрация стромы. Окраска гематоксилином и эозином. Х400
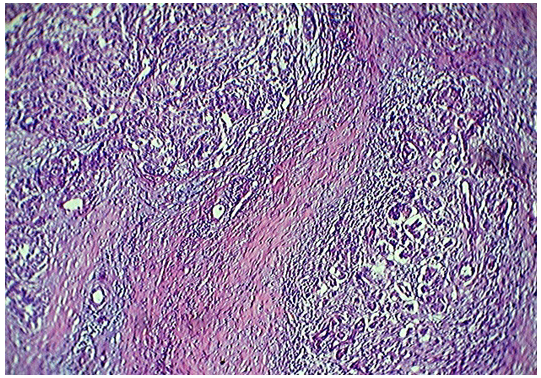
Рис. 4. Опухоль на границе с неизмененной поджелудочной железой. Отграниченная плотноволокнистой соединительной тканью. Окраска гематоксилином и эозином. Х100 ( больной без лучевой терапии)
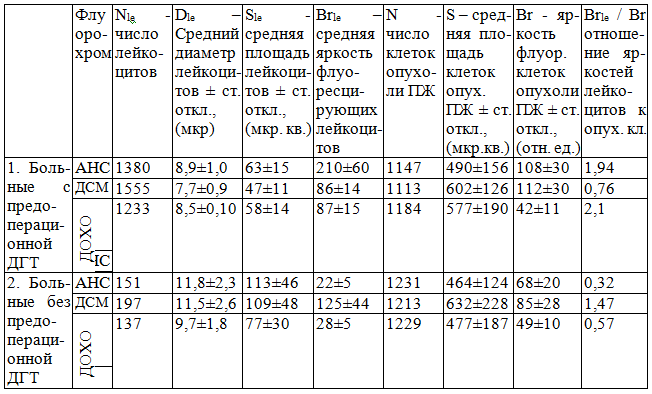
У больных, получавших предоперационную лучевую терапию яркость лимфоцитов, которые обильно располагались рядом с крупными клетками ПЖ, в окраске АНС была в 1,9 раза выше, а в окраске ДСМ была в 0,76 раз ниже, чем у клеток аденокарциномы ПЖ (рис. 5).
Это означает, что лимфоциты почти в 2 раза имели меньший мембранный потенциал, чем клетки аденокарциномы ПЖ. В окраске доксорубицином лимфоциты были в 2 раза ярче, т.е. накапливали этот цитостатик в 2 раза больше, чем раковые клетки ПЖ на единицу площади. В группе больных, не получавших предоперационную лучевую терапию картина совершенно иная: лейкоциты в окраске АНС были почти в три раза бледнее, чем опухолевые клетки (табл. 1).
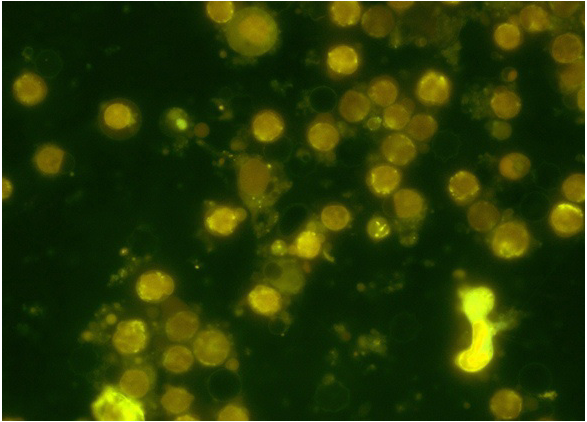
Рис. 5. Клетки аденокарциномы поджелудочной железы и лимфоцитов, экспресирующие ДСМ. Увеличение х100
Таким образом, разработанная нами методика химиолучевой терапии оказалась весьма эффективна в отношении рака поджелудочной железы, что находит свое подтверждение в частоте появления очагов некроза, миксоматоза, выраженной лейкоцитарной инфильтрации, а также увеличением анеуплоидного клона опухоли, и снижением скорости пролиферации. В представленных клинических наблюдениях основной группы обращает на себя внимание тот факт, что при одинаковой морфологии опухолей (умереннодифференцированная аденокарцинома) результаты гистограммы на проточном цитометре несколько различны. В случае ослизнения стромы опухоли отмечается число анеуплоидных клеток 9,4% и отмечается повышение скорости и индекса пролиферации анеуплоидного клона опухоли. Гистологически: небольшие очаги некроза. Если опухоль представлена аденокарциномой без ослизнения, доля анеуплоидных клеток 22,7%. Отмечается снижение скорости пролиферации (доля клеток в S-фазе). Гистологически в опухоли отмечаются обширные очаги некроза.
Таблица 1 Показатели прижизненной флуориметрии клеток поджелудочной железы (ПЖ) и лейкоцитов, инфильтрирующих ткань поджелудочной железы. Средние значения ± стандартное отклонение (отн. ед.)
Выводы
1. Разработанная схема химиолучевой терапии эффективная в отношении рака поджелудочной железы
2. Критериями эффективности применяемой химиолучевой терапии у больных основной группы являлись: очаги некроза раковых клеток, лимфоидная инфильтрация стромы, увеличение доли анеуплоидных клеток более чем в 2 раза, снижение скорости пролиферации клеток (доля клеток в S-фазе).
3. Требуют дальнейшего изучения различия в клинической эффективности разработанной методики в зависимости от морфологического строения первичного опухолевого очага.
