Введение. Рак молочной железы – гетерогенная группа опухолей. Согласно молекулярно-генетической классификации, предложенной Perou C.M. и Sorlie T., одним из определяющих критериев разделения на подтипы является наличие в опухолевой ткани рецепторов к эстрогену и прогестерону [12]. Опухоли, экспрессирующие рецепторы, относятся к люминальным и составляют 70-80% всех случаев этого заболевания [11, 12]. Основным компонентом адъювантного лечения люминального рака молочной железы является антиэстрогенная терапия, базисным препаратом для проведения которой остается тамоксифен [5, 6].
Считается, что главным предсказательным критерием эффективности эндокринной терапии является сам факт наличия рецепторов эстрогенов альфа (ERα) в ткани опухоли. В качестве дополнительных рассматриваются степень экспрессии ERα (процент опухолевых клеток, имеющих рецепторы) и интенсивность их окрашивания. Установлено, что высокие значения данных показателей ассоциированы с лучшей эффективностью проводимого лечения [4]. При стандартной оценке рецепторного статуса, как правило, не учитывается такой параметр, как характер распределения рецепторов эстрогенов альфа в ткани опухоли. Тем не менее, было показано, что гетерогенное распределение рецепторов ассоциировано с неблагоприятным исходом заболевания - высокой вероятностью лимфогенного и гематогенного метастазирования [1]. Однако предсказательная значимость этого параметра не изучалась.
Несмотря на относительно благоприятный клинический прогноз пациентов с люминальным типом рака молочной железы, данные литературы свидетельствуют о том, что у 10-20% пациентов на фоне проведения адъювантной гормонотерапии тамоксифеном отмечается прогрессирование заболевания в первые 12 мес. от начала лечения, а в последующие годы эта цифра увеличивается до 20-40% [11, 13, 4] На сегодняшний день изучение причин неэффективности антиэстрогенной терапии тамоксифеном развивается по двум основным направлениям. В качестве первого рассматривают реализацию различных путей активации рецепторов эстрогенов. Классический геномный путь активации осуществляется посредством взаимодействия эстрадиола с активационным центром AF-2 (activating functions - AF-2) рецептора. На эту же мишень воздействует и тамоксифен, являясь конкурентным антагонистом эстрадиола [8]. В то же время показано, что реализация неклассического геномного пути активации рецепторов эстрогенов альфа (ERα) происходит под воздействием ряда ростовых факторов (IGF-1, EGFR, Her-2/neu, TGF-β), способных активировать домен AF-1 ERα, который не блокируется тамоксифеном. Именно это и может обусловливать неэффективность проводимой гормонотерапии [11, 13].
В качестве второй возможной причины резистентности к терапии тамоксифеном рассматривается наличие изменений ультраструктуры самих рецепторов эстрогенов в результате однонуклеотидных полиморфизмов. Установлены области транскрипции гена рецепторов эстрогенов, ответственные за строение активационных центров AF-1 и AF-2 [3, 10]. Так, наличие полиморфизма rs2077647 (C/T) в первом экзоне гена ERα, который локализуется в А/В домене, ассоциировано со структурными изменениями функциональной области транскрипционной активации центра AF-1. Полиморфизм же rs2228480 (G/A) (594Thr) в 8 экзоне, располагающемся в E/F регионе, соответствует лиганд-зависимой функциональной области транскрипции центра AF-2. Структурные изменения в активационных центрах могут приводить к нарушению функции самих рецепторов. Проведенные исследования свидетельствуют о том, что мутации в 8 экзоне гена ERα делают невозможным связывание тамоксифена с центром AF-2, тем самым обусловливая неэффективность, а, следовательно, нецелесообразность проводимой антиэстрогенной терапии [3]. Однако эти исследования немногочисленны и в большей степени носят поисковый характер, в связи с этим целесообразно дальнейшее изучение данного направления.
Целью настоящего исследования явилось изучение взаимосвязи экспрессии рецепторов эстрогенов альфа и полиморфных вариантов гена ERα с эффективностью антиэстрогенной терапии тамоксифеном у больных люминальным раком молочной железы.
Материалы и методы. В исследование были включены 67 пациенток люминальным типом рака молочной железы со стадией T1-2N0-1M0, средний возраст составил 54,35±0,87 лет. 35 больных находились в состоянии менопаузы, у 32 менструальный цикл был сохранен, во всех наблюдениях опухоли были представлены инвазивной протоковой карциномой. Пациентки получили комбинированное лечение в виде оперативного вмешательства в объеме радикальной мастэктомии или радикальной резекции. По показаниям проводилась послеоперационная лучевая терапии и/или адъювантная химиотерапия (по схеме FAC). Обязательным компонентом адъювантной терапии явился прием тамоксифена в течение 5 лет в стандартной дозировке (20 мг/сут.). Сроки наблюдения за больными составили от 24 до 102 мес.
Отдаленные результаты лечения оценивались по факту наличия прогрессии в виде появления отдаленных метастазов. В зависимости от этого были сформированы 2 группы пациентов: без признаков прогрессирования (38) и с прогрессированием заболевания (29). Группы были сопоставимы по основным клинико-морфологическим параметрам и объему проведенного лечения.
Исследовались образцы опухолевой ткани. Подготовка материала и патоморфологическое исследование осуществлялись по стандартной методике. Экспрессию к рецепторам эстрогенов альфа изучали иммуногистохимическим методом, применяли антитела фирмы «Dako» (клон 1D5, RTU, мышиные). Оценка экспрессии к рецепторам эстрогенов альфа проводилась количественным методом гисто-счета (Histo-Score). При этом определялась степень экспрессии (процент позитивных клеток) и её интенсивность (показатель экспрессии в баллах). Наряду со стандартным определением экспрессии рецепторов половых гормонов, дополнительно оценивался характер распределения рецепторов в опухолевой ткани [2]. Если в опухоли отмечалось равномерное распределение рецепторов, независимо от интенсивности окрашивания, экспрессию оценивали как гомогенную. В тех случаях, когда наблюдались участки с позитивной и негативной экспрессией, а также с различной степенью выраженности - экспрессию рассматривали как гетерогенную.
С целью оценки ультраструктуры ERα проводилось выделение дезоксирибонуклеиновой кислоты (ДНК) из опухолевых образцов путем депарафинизации срезов с помощью наборов QIaamp DNA FFPE tissue kit (Qiagen). Качественная и количественная оценка ДНК проведена на спектрофотометре NanoDrop-1000 («NanoDrop», США). Изучение полиморфных вариантов в 8 экзоне гена рецептора выполнено с помощью полимеразной цепной реакции (ПЦР) в режиме реального времени. Последовательность праймеров и проб подбирали при помощи программы OligoAnalysisVector NTI с использованием генетического банка данных (www.ncbi.nlm.nih.gov). Реакционная смесь для ПЦР объемом 15 мкл включала 100 нг геномной ДНК; 0,5-1,5 мкл специфической пары праймеров и проб с концентрацией 1 о.е./мл; 200 мкМ каждого дезоксинуклеотидтрифосфата; 1,2-2,0 мкл буфера (60 мМTris-HCl (pH 8,5 при 25°C), 1,5 мМ MgCl2; 25 мМKCl; 10 мМ 2-меркаптоэтанол; 0.1% Тритон X-100) и 0,5-1,0 ед. Taq ДНК-полимеразы («Медиген», Новосибирск). Программа амплификации предполагала предварительную денатурацию при 95°С в течение 2 минут, с последующими 40 циклами денатурации при 95°С (10 сек), отжига при специфической температуре для каждой пары праймеров (30 сек.) на амплификаторе ICycler IQ5 («Bio-Rad», США).
Работа проведена с соблюдением принципов добровольности и конфиденциальности в соответствии с «Основами законодательства РФ об охране здоровья граждан (Указ Президента РФ от 24.12.93 № 2288), на основании разрешения локального комитета по биомедицинской этике ФГБУ «НИИ онкологии» СО РАМН. Статистическую обработку полученных данных проводили с помощью программы “STATISTICA 7.0”.
Основные результаты исследования. На первом этапе исследования были проанализированы стандартные показатели рецепторного статуса. Оценивалась связь степени и интенсивности экспрессии рецепторов эстрогенов альфа в ткани опухоли с исходом заболевания (табл.1).
Таблица 1. Взаимосвязь интенсивности экспрессии ERα с исходом заболевания
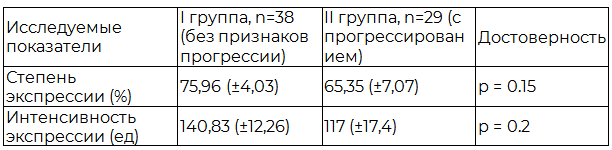
Установлено, что в группе пациентов без признаков прогрессирования заболевания степень и интенсивность экспрессии Erα была несколько выше. Однако, достоверно значимых различий выявить не удалось.
При изучении интенсивности экспрессии рецепторов в зависимости от характера их распределения оказалось, что при гомогенном распределении средняя интенсивность экспрессии составила 208±12,68, тогда как при гетерогенном она была существенно ниже – 99,74±9,4. Различия носили статистически значимый характер (р=0,0004).
В связи с полученными результатами была оценена связь характера распределения рецепторов эстрогенов альфа в ткани опухоли с отдаленными результатами лечения (табл. 2). Отмечено, что в группе пациенток, у которых было диагностировано прогрессирование заболевания, гетерогенное распределение наблюдалось у 86,2% больных, в то время как при благоприятном исходе данный показатель составил 60,5%. Выявленные различия были статистически значимы (р = 0,042; χ2 = 4,15). Полученные результаты позволяют полагать, что такой морфологический параметр, как характер распределения рецепторов эстрогенов альфа в ткани опухоли больных раком молочной железы определенным образом сопряжен с эффективностью гормонотерапии тамоксифеном.
Таблица 2. Взаимосвязь характера распределения ERα с частотой отдаленного метастазирования

У 48 пациентов в образцах опухолевой ткани оценивалось наличие полиморфизма rs2228480 (G/A) в 8 экзоне гена Erα. Он был выявлен в 20,8% случаев (20 аллелей оказались мутантными). Интересно отметить, что у больных, в опухолевых клетках которых определялась гомогенная окраска рецепторов, случаев мутации не отмечено, в то время как при гетерогенном их распределении мутации 8 экзона отмечены в 28% наблюдений (р=0,004; χ2=8,45). При этом выявлена тенденция к увеличению частоты встречаемости этой мутации в группе пациенток с прогрессированием заболевания (р=0,051; χ2=4,03).
Таким образом, полученные результаты позволяют полагать, что такие показатели, как гетерогенное распределение рецепторов эстрогенов альфа и наличие мутации в 8 экзоне гена Erα в ткани опухоли, можно рассматривать в качестве дополнительных предсказательных критериев эффективности антиэстрогенной терапии тамоксифеном у пациенток с люминальным типом рака молочной железы. А их определение в биопсийном или операционном опухолевом материале может позволить индивидуализированно подойти к назначению препарата.
