Проблема, посвященная изучению доброкачественных и злокачественных опухолей тела матки до настоящего времени остается недостаточно решенной [1, 3]. Основными методами диагностики являются ультразвуковое исследование с цветным допплеровским картированием (УЗИ с ЦДК), компьютерная томография (КТ), магнитно-резонансная томография (МРТ), гистероскопия, лапароскопия. Но все они обладают рядом недостатков – высокая цена, наличие противопоказаний, не всегда позволяют выявить опухоль на ранней стадии, гистологический же анализ материала, полученного при диагностическом выскабливании, позволяя определить наличие опухоли, не отражает реальную глубину и степень местного распространения процесса. В связи с этим становится очень актуальным поиск информативных и значимых показателей биологической активности опухоли, определяемых малоинвазивными лабораторными методами в дооперационном периоде и на ранних этапах развития миомы матки и рака тела матки, для которых характерны простота аппаратурного оформления, высокая чувствительность детектирования диагностических признаков заболевания, экспрессность. В современной диагностике для решения широкого круга задач все чаще привлекают аналитические системы с искусственным интеллектом на основе химических и биологических сенсоров, в том числе на основе пьезокварцевых резонаторов.
В настоящее время не существует значимых опухолевых маркеров для скрининга рака тела матки, которые обладали бы высокой специфичностью, хотя в мире постоянно ведется их поиск [4, 6, 8].
Цель исследования: оптимизация ранней дифференциальной диагностики лейомиомы матки, гиперплазии эндометрия и рака эндометрия с помощью установления корреляции сигналов мультисенсорной системы на основе пьезорезонаторов с селективными покрытиями.
Материалы и методы
В качестве измерительных элементов для создания массива пьезосенсоров выбраны пьезокварцевые резонаторы с частотой колебания 10,0 ± 0,5 МГц (ОАО «Пьезо», Москва). Пьезокварцевым резонатором называют электромеханическую резонансную колебательную систему, изготовленную из кварца в определенном конструктивном исполнении. В качестве покрытий пьезосенсоров выбраны пленки с универсальными сорбционными свойствам: полиэтиленгликоль 2000 (ПЭГ-2000 – сенсор 1), родамин 6 Ж (P6Ж – сенсор 2), углеродные нанотрубки (УНТ – сенсор 7), тритон Х-100 (ТХ-100 – сенсор 3); проявляющие селективность к органическим кислотам – дициклогексан-18-краун-6 (ДЦГ-18-К-6 – сенсор 4), Tween 40 (TW – сенсор 5), и аминам – полидиэтиленгликоль сукцинат (ПДЭГС – сенсор 6), бромкрезоловый синий (БКС – сенсор 8).
В качестве объектов исследования выбраны: 1) первичные, вторичные и третичные амины с алкильными и арильными радикалами, уксусная и масляная кислоты, препараты классификации «ч.д.а.», «х.ч.» - индивидуальные тест-вещества, предположительно содержащиеся в крови при деструктивных процессах (газы-маркеры); 2) образцы периферической крови пациенток. Проведено комплексное клинико-лабораторное исследование 161 пациентки. 32 больные с лейомиомой, 61 пациентка с гиперплазиями эндометрия (ГЭ), 37 пациенток с гистологически подтвержденным раком эндометрия (РЭ). И 31 пациентка «условно здоровых», составляющих контрольную группу. Забор исследуемой крови проводился из вены, натощак у больных до оперативного лечения в количестве 2 мл в стерильные пробирки со стабилизирующими гранулами и притертыми полистерольными крышками. Кровь транспортировали при температуре 20 ± 2°С в течение 15 – 20 мин и в течение 5-10 минут обрабатывали. Клиническое обследование пациентов этих групп проводилось по стандартным методам диагностики. Это ультразвуковое исследование с цветным допплеровским картированием (УЗИ с ЦДК), компьютерная томография (КТ), магнитно-резонансная томография (МРТ), гистероскопия, лапароскопия.
Результаты и их обсуждение
Исследовали состав равновесной газовой фазы (РГФ) над биопробами и индивидуальными тест-веществами объемом 2 см3 при 20 ± 2 ºC в статическом режиме на анализаторе газов «МАG-8» (ООО «СенТех», Воронеж). В программном обеспечении «МАG-Soft» фиксировали выходные сигналы пьезосенсоров, отклики системы при сорбции легколетучих веществ во времени с шагом в 1 с в виде хроночастотограмм, аналитические сигналы пьезосенсоров (ΔFmax,i , Гц) и площадь «визуальных отпечатков» (Sв.о., Гц·с) [6], где ΔF – изменение частоты колебания резонатора, вызванное нанесением плёночного покрытия, Гц.
Для получения дополнительной диагностической информации о пробах и оценки качественного состава РГФ над ними проводили расчет параметров эффективности сорбции Аijmax по формуле:
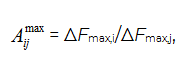
где i, j – маркировка пьезосенсоров в массиве [7].
По результатам исследования проб крови на анализаторе газов «MAG-8» получены типичные «визуальные отпечатки» максимальных сигналов пьезосенсоров от образцов крови групп пациенток с разной диагностической характеристикой: «миома», «гиперплазия эндометрия», «рак тела матки», «условно здоровые» (рис. 1).
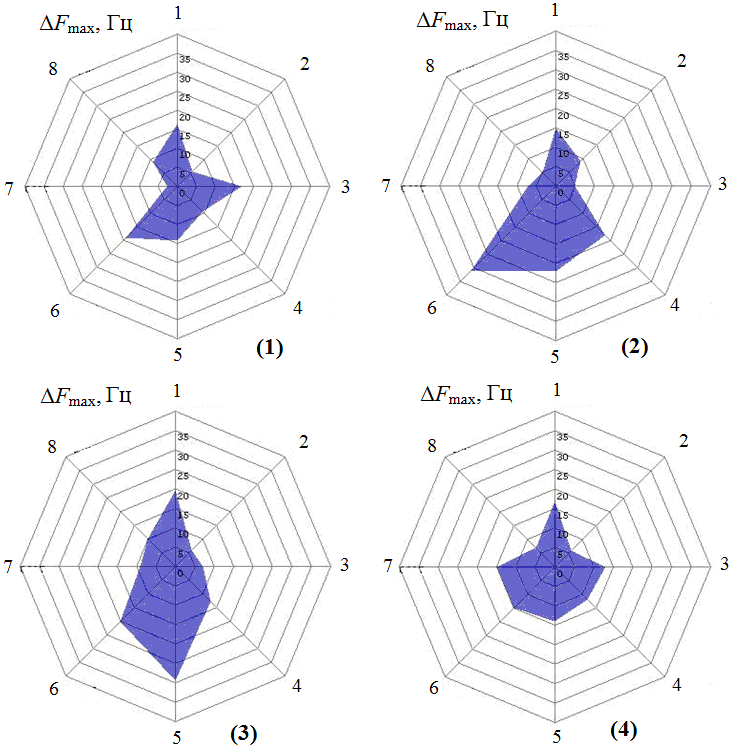
Рис. 1. Типичные «визуальные отпечатки» и площади максимальных сигналов пьезосенсоров, полученные при анализе крови от обследуемых групп 1) гиперплазия эндометрия Sв.о.= 3245 ± 444 Гц·с , 2) миома матки Sв.о.= 4206 ± 1014 Гц·с, 3) рак эндометрия Sв.о.= 5004 ± 980 Гц·с, 4)условно здоровые Sв.о. = 4462 ± 442 Гц· с
Несмотря на некоторые различия в геометрии фигур «визуальных отпечатков» максимальных сигналов пьезосенсоров для проб внутри групп ранжирования, статистически надежная средняя выборка характеризуется определенной формой, величиной площади, позволяющими их разделять по группам [2]. Установлено, что для проб из группы с меткой «ГЭ» максимальный аналитический сигнал характерен для пьезосенсора с пленкой ПДЭГС и меньшие равновеликие в пределах погрешности измерения значения аналитических сигналов пьезосенсоров с пленками ПЭГ-2000, ТХ-100 и Тween-40, что свидетельствует о наличии алифатических аминов, кислот и других классов легколетучих органических соединений (альдегиды, спирты) в РГФ над пробами крови [7]. Для проб с диагностической характеристикой «миома» максимальные сигналы характерны для пьезосенсоров с пленками ПДЭГС, Tween-40, ПЭГ-2000 и ДЦГ-18-К-6, что указывает на преобладание в РГФ над пробами алифатических кислот. Для проб из группы «РТМ» отличительной особенностью является наибольшее значение сигнала пьезосенсора с пленкой Tween-40, и уменьшение сигналов пьезосенсоров с пленками ПДЭГС, ПЭГ-2000, ДЦГ-18-К-6 и БКС, что указывает на наличие в РГФ над пробами крови различных классов летучих органических соединений с преобладанием алифатических кислот, аминов различного строения, в том числе ароматических – значительный сигнал пьезосенсора с пленкой БКС – как следствие сильных деструктивных процессов, происходящих в организме. Геометрия «визуального отпечатка» максимальных сигналов матрицы пьезосенсоров для группы «условно здоровые» и других групп существенно отличаются. Минимальные значения откликов характерны для пьезосенсоров с пленками БКС и Р6Ж, что указывает на отсутствие значительных количеств органических аминов и кислот в РГФ над пробами и наличие летучих веществ других классов органических соединений. Об общем содержании легколетучих веществ в РГФ над пробами можно судить по значению площади «визуальных отпечатков» максимальных сигналов пьезосенсоров (Sв.о., Гц·с).
Таким образом, дифференциация проб при исследовании состава РГФ над ними на группы с метками «гиперплазия эндометрия», «миома», «РТМ» по особенностям геометрии и величинам площади «визуальных отпечатков» максимальных сигналов массива пьезосенсоров (первичная аналитическая информация) возможна, однако для увеличения надежности ранжирования по результатам единичного измерения необходимо применять дополнительные (вторичная аналитическая информация) параметры микровзвешивания.
Для исследуемых групп проб с различными метками рассчитаны наиболее информативные параметры, которые представлены в табл. 1. Установлено, что по совокупности параметров А34, А13 с высокой надежностью могут быть выделены пробы из группы «миома», а при дополнении к ним параметра А56 идентифицируются пробы из группы «РТМ». При этом характерным для «гиперплазии эндометрия» является только параметр А53. Следовательно самым надежным и специфичным для выделения проб со злокачественными процессами является параметр А56, который встречается в данной группе и является диагностическим критерием.
Таблица 1. Диапазон значений параметров эффективности сорбции (Аijmax) РГФ над пробами из различных диагностических групп
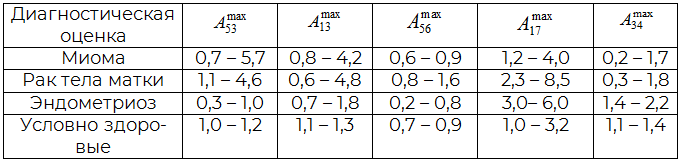
Известно, что при повреждениях тканей, в том числе деструктивных процессах, в острой фазе наблюдается ярко выраженный некомпенсированный метаболический ацидоз крови, что связано с образованием органических кислот из-за высокой концентрации активных форм кислорода и продуктов перекисного окисления липидов, по мере развития компенсации рН крови повышается [10]. Поэтому параметр А56 имеет еще и дополнительное диагностическое значение, так как фактически отражает соотношение органических кислот и аминов в РГФ над пробами. Для проб из группы «условно здоровые» значение параметра А56 равно 0,8 ± 0,1, что соответствует небольшому избытку полярных соединений в газовой фазе над пробой. При А56 меньше 0,3 в РГФ над пробами присутствует избыток алифатических аминов, что характерно для протекания глубоких деструктивных процессов и сильных структурных изменениях в тканях. По этому критерию выделяются пробы из групп «гиперплазия эндометрия» с признаками миом малых форм и «РТМ». Ранее показано, что некоторые из рассчитанных параметров являются идентификационными для веществ-маркеров состояния (аммиак, триэтиламин, уксусная кислота) [5].
Совпадение значений идентификационных параметров с табличными в пределах погрешности свидетельствует о наличии данного вещества–маркера в РГФ над биопробой с надежностью 99%. Так параметру А13 в РГФ над кровью из групп «миома» обнаружены уксусная кислота. По параметру А34 идентифицируется аммиак в РГФ над некоторыми пробами из группы «миома» (А34 = 0,3). По идентификационным параметрам Аij в РГФ над пробами крови группы «условно здоровые» не обнаружены уксусная кислота, триэтиламин и аммиак на минимальном уровне определения (идентификации).
Для получения максимальной диагностической информации необходимо применять современные методы обработки многопараметрической информации. Для этого применен широко распространенный в практике метод хемометрики – метод главных компонент (МГК). В результате получена оптимизированная модель с пятью главными компонентами. Объясненная дисперсия для первых двух главных компонент составила 81 %. Это означает, что с помощью выбранных параметров можно достаточно полно описать всю структуру данных. Кроме того, высокая корреляция объясненной и проверочной дисперсии свидетельствует о небольшой ошибке модели при прогнозе.
Для оценки возможности применения метода пьезокварцевого микровзвешивания для диагностики патологических состояний по крови предварительно проводили тренинг или обучение системы на выборке биопроб с установленными диагнозами по стандартным методам (УЗИ, гистероскопия, клиническое исследование крови). Одним из возможных способов обработки данных с целью прогнозирования значений для проб, не вошедших в обучающую выборку является метод регрессии на главные компоненты (РГК). Метод регрессии на главные компоненты относится к методам многомерной калибровки, которые исследуют два и более набора данных, иначе эти методы можно назвать многомерным моделированием [9]. Многомерное моделирование проводят в две стадии – калибровка и предсказание. Метод регрессии на главные компоненты можно рассматривать как двухэтапную процедуру: сначала с помощью метода главных компонент преобразуется исходная матрица сигналов сенсоров, а затем полученные векторы счетов используются в многомерной линейной регрессии. В качестве прогнозирующего фактора для экспресс-оценки состояния проб крови выбран критерий «здоровье», который кодировали значениями «-1» для пациенток с патологиями и «+1» для группы «условно здоровые». Для построения регрессионной модели были сформированы обучающая и проверочная выборки. Для обучающей выборки в рандомном порядке выбран представительный набор из 19 проб крови пациенток с различными патологиями (ГЭ - 6, миома - 5, РЭ - 4 и условно здоровых - 4) . В качестве переменных для всей выборки выбраны оптимальные параметры микровзвешивания, определенные ранее для проб крови по методу главных компонент. Многомерный массив данных для обучающей выборки предварительно автошкалирован. Построенную регрессионную модель применяли для процедуры предсказания фактора «здоровье» для проб крови из проверочной выборки. Проверка производилась для 31 пробы, которые также продиагностированы стандартными методами анализа. По результатам обработки матрицы данных, полученных при анализе РГФ над кровью по РГК-модели получены прогнозированные (модель) и референтные (стандартные методы диагностики) значения, позволяющие отнести состояние проб к группам «здоровые» или «больные».
Процент совпадения результатов, полученных с использованием «электронного носа» на основе 8 пьезосенсоров и обработкой результатов с помощью РГК-модели, со стандартными методами составляет 94 %. Чувствительность (Ч) и специфичность (С) предлагаемого способа получения диагностической скрининг-информации рассчитывали по формулам:
Ч = nпп/(nло+nпп),
С = nпо/(nлп+nпо),
где ni – число испытаний с i-м результатом: ПП – правильный положительный, ПО – правильный отрицательный, ЛО – ложный отрицательный, ЛП – ложный положительный.
Чувствительность и специфичность предлагаемого скрининг способа оценки состояния проб крови составляет 88% и 75% соответственно. Использование регрессионной модели для обработки результатов анализа РГФ над биопробами массивом пьезосенсоров в дополнение к стандартным анализам крови позволяет высоко специфично получить экспрессную диагностическую информацию о наличии патологии в организме.
Выводы
1. Выявлены газовые маркеры крови и произведен анализ диагностической информации сигналов «Электронного носа» с помощью применения метода хемометрики (МГК), позволяющие диагностировать активность пролиферативных процессов при опухолевых заболеваний тела матки.
2. Получена экспрессная аналитическая информация сенсорной системы, свидетельствующая о наличии патологии в теле матки при исследовании образцов крови.
3. Разработаны критерии с чувствительностью 88% и специфичностью 75%, позволяющие провести дифференциальную диагностику между группами «болен/здоров».
4. Произведена идентификация газовых маркеров, соответствующих различным заболеваниям тела матки, которая позволит улучшить диагностику активности ангиогенеза и пролиферации эндометрия и миометрия на ранних этапах развития, что оптимизирует тактику дальнейшего ведения и лечения данной категории больных.
