Плоскоклеточные карциномы головы и шеи по приросту смертности занимают одно из первых мест в мире. Во многом это объясняется тем, что диагноз ставится на поздних стадиях заболевания. Развитие персонализированной медицины позволит перевести диагностику на ранние этапы. Поэтому актуально исследование генетических аспектов данных патологий. В мире проводится изучение генов, вовлеченных в патогенез различных патологических процессов [1,3–5]. Остро стоит вопрос о роли цитокинов в развитии воспаления [2] и других процессов, лежащих в развитии онкологических заболеваний. Поэтому проводятся исследования генов цитокинов и генов супрессоров опухолевого роста, однако исследователи не приходят к однозначным выводам.
Рядом авторов была показана важная роль мутации гена белка р53 (TP53) у пациентов с плоскоклеточными карциномами ротовой полости [7] и ВПЧ-положительными карциномами гортани [9]. При изучении полиморфизмов гена фактора некроза опухолей альфа (TNFa) при плоскоклеточных карциномах ротоглотки была выявлена худшая выживаемость и высокий риск рецидивов у пациентов с гомозиготными генотипами полиморфизмов TNFа-308 и TNFа-863. Также -308G/A полиморфизм был ассоциирован с повышенным риском развития опухолей ротоглотки, но не пищевода и гортани, а также с повышенным риском развития плоскоклеточных карцином, но не аденокарцином [11]. G аллель в 1082 положении гена интерлейкина 10 (IL10) и GCC гаплотип (определенного по SNPs в позициях -1082, -819 и -592) гена IL10 связан с повышенным риском рака ротовой полости [13] и назофарингеальных карцином [12]. Существуют данные о взаимосвязи рецептора эпидермального фактора роста (EGFR) и ВПЧ-индуцированных орофарингеальных карцином [6,10]. Кроме того, повышение экспрессии EGFR у пациентов сопряжено с их пониженной выживаемостью [8].
Целью исследования является оценка особенностей распределения аллелей полиморфных локусов генов IL 10, ТР53, EGFR , TNFa у пациентов с разной локализацией опухолей головы и шеи.
Для достижения данной цели были поставлены следующие задачи: оценить частоты распределения генотипов и аллелей SNP-мутаций в позициях генов интерлейкинов IL10 G1082A, IL10 592C>A, TNF G308A у пациентов с карциномами гортани, ротовой полости и здоровых добровольцев с выявлением особенностей распределения генотипов изучаемых SNP-мутаций в зависимости от локализации опухолевого процесса и влияния их на характер течения заболевания; выявить особенности распределения генотипов SNP-мутаций в генах TP53 Pro72Arg и EGFR A2073T в зависимости от локализации опухолевого процесса с оценкой вклада генетического аспекта в развитие плоскоклеточных карцином головы и шеи.
Материалы и методы. Была исследована периферическая кровь пациентов с раком гортани и ротовой полости у 84 пациентов ВОКОД №1 возрастом от 39 до 81 лет, среди которых женщины составляли 10,71%, мужчины – 89,29%. На базе ГУЗ «Поликлиника №20» была сформирована контрольная группа, в которую вошли 36 здоровых добровольцев, не имеющих онкологической патологии, возрастом от 30 до 74 лет, среди которых женщины составляли 11,1%, а мужчины 88,9%. Исследование осуществлялось на базе лаборатории геномных и протеомных исследований отдела фармакологии Волгоградского медицинского научного центра ВолгГМУ. Определение SNP-мутаций производилось методом ПЦР с помощью наборов производства «НПФ Литех». Статистическая обработка проводилась с помощью программы Statistica 8.0.
Результаты и обсуждение. Пациенты с раком гортани и с раком ротовой полости составляли по 50% исследуемой группы. В табл. 1 показано распределение частот генотипов у пациентов с карциномами гортани и здоровых добровольцев с учетом относительного риска (ОР). Если ОР>1, то данный генотип или аллель является фактором риска, если ОР<1, то – фактором защиты.
Таблица 1. Распределение частот генотипов и аллелей у пациентов с карциномами гортани и здоровых добровольцев
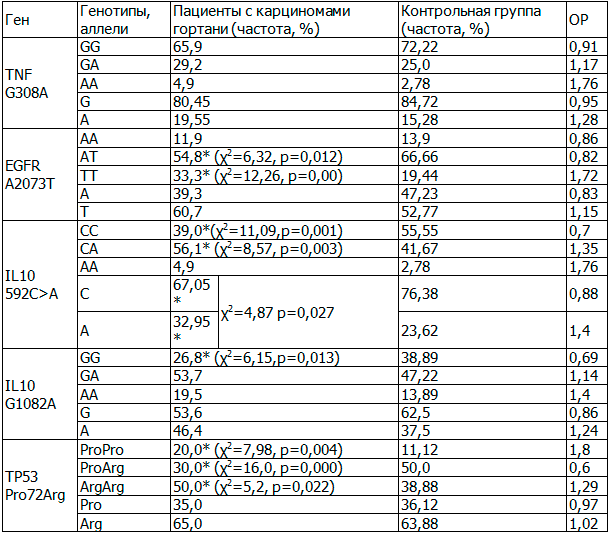
Примечание: здесь и далее *отмечены значения частот, для которых выявлены достоверные различия между исследуемой и контрольной группами при сравнении с помощью критерия χ2 наблюдаемых и ожидаемых частот генотипов, в скобках указаны значения χ2, р.
Были выявлены различия в распределении генотипов и аллелей между здоровыми добровольцами и пациентами с различными патологиями. Для рака гортани фактором риска являются генотипы ТТ в позиции EGFR A2073T, СА и аллель А в позиции IL10 592C>A, гомозиготные генотипы по аллелям Arg и Pro в позиции TP53 Pro72Arg, протективными свойствами обладают генотипы АТ в позиции EGFR A2073T, СС и аллель С в позиции IL10 592C>A, генотип GG в позиции IL10 G1082A, генотип ProArg в позиции TP53 Pro72Arg.
Аллель А в позиции IL10 592C>A приводит к снижению экспрессии сывороточного IL10 и активации клеточного иммунитета, в то время как аллель С в позиции IL10 592C>A и аллель G в позиции IL10 G1082A отвечают за повышение уровня IL10 и активацию противовоспалительных реакций. А повышение уровня IL10 у пациентов с опухолевыми заболеваниями считается прогностически неблагоприятным признаком. Так среди пациентов, имеющих аллель G, скорость прогрессирования заболевания выше по сравнению с носителями генотипа АА. Влияние генотипа GG на течение опухолевого процесса также иллюстрирует тот факт, что относительное число моноцитов у пациентов с генотипом GG по сравнению с носителями генотипа АА достоверно ниже (критерий Манна-Уитни, р=0,039), а моноциты и тканевые макрофаги обеспечивают неспецифический противораковый иммунитет. Данный факт справедлив и для носителей генотипа СС в позиции IL10 592C>A.
Изменение конформации EGFR ведет к повышению пролиферации малигнизированных клеток, росту опухоли, стимуляции процессов инвазии, патологического ангиогенеза и метастазирования. Среди пациентов, имеющих аллель А, достоверно чаще встречается степень регионарного метастазирования N0 по сравнению с пациентами с генотипом ТТ. Также пациенты с генотипом ТТ чаще имели заболевание в четвертой стадии опухолевого процесса.
Белки р53 с остатком Arg и с остатком Pro в положении 72 снижают супрессию трансформации клеточного роста и способность к апоптозу по внутреннему пути и по внешнему пути соответственно. Этим может быть объяснены протективные свойства генотипа ProArg.
В табл. 2 показано распределение частот генотипов у пациентов с карциномами ротовой полости и здоровых добровольцев с учетом относительного риска (ОР). Если ОР>1, то данный генотип или аллель является фактором риска, если ОР<1, то – фактором защиты.
Таблица 2. Распределение частот генотипов и аллелей у пациентов с карциномами ротовой полости и здоровых добровольцев
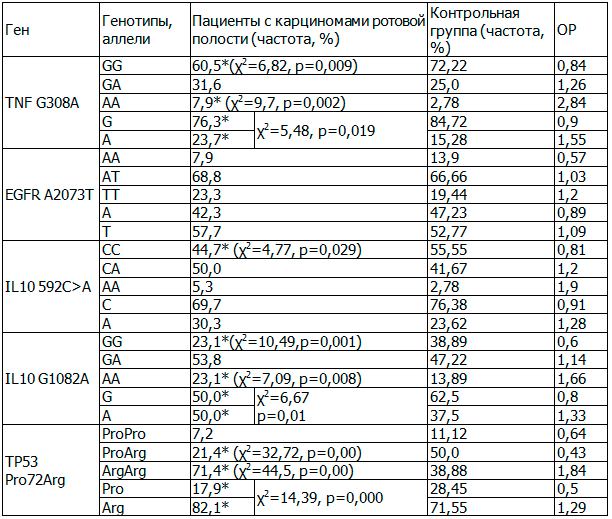
Для карцином ротовой полости канцерогенными являются генотип АА и аллель А в позиции TNF G308A, генотип АА и аллель А в позиции IL10 G1082A, генотип ArgArg и аллель Arg в позиции TP53 Pro72Arg, факторами защиты можно считать генотип GG и аллель G в позиции TNF G308A, генотипы СС в позиции IL10 592C>A, GG и аллель G в позиции IL10 G1082A, генотип ProArg и аллель Pro в позиции TP53 Pro72Arg.
Аллель А в позиции TNF G308A отвечает за увеличение экспрессии TNF, и у пациентов, имеющих аллель А, заболевание протекает с более медленным прогрессированием опухолевого процесса.
Прогрессия опухолевого роста была повышена у пациентов с генотипом ArgArg по сравнению с пациентами, имеющими аллель Pro, кроме того, у этих пациентов чаще встречались поздние стадии заболевания (III и IV).
Выявленные различия в распределении генотипов и аллелей между пациентами и здоровыми добровольцами могут указывать на роль SNP-мутаций генов интерлейкинов и супрессоров опухолевого роста в развитии карцином гортани и ротовой полости, что, в свою очередь, может внести вклад в разработку алгоритмов диагностики опухолей различной локализации и оценки возможной тяжести заболевания. Данные алгоритмы позволят снизить смертность от этих патологий.
