Онкологические заболевания головы и шеи по приросту смертности занимают одно из первых мест в мире. Во многом эта ситуация объясняется поздней диагностикой и диктует необходимость разработки новых алгоритмов ранней диагностики и определения критериев включения пациентов в группу риска [3, 5]. Известно, что возникновение карцином головы и шеи во многом связано с увеличением канцерогенной нагрузки на организм при курении и алкоголизме. Распространенность курящих людей среди населения России колеблется около 40%, однако не у всех курильщиков развиваются онкологические заболевания головы и шеи, в то время как эти заболевания возникают и у некурящих, что позволяет думать о том, что механизмы, лежащие в основе развития карцином, включающие сложные взаимодействия иммунной системы и различных супрессоров опухолевого процесса, требуют детального изучения. Кроме того, если роль вируса папилломы человека (ВПЧ) в развитии рака шейки матки (РШМ) доказана, то данные, свидетельствующие о роли ВПЧ в канцерогенезе эпителия слизистых оболочек головы и шеи [6, 7]. Различие в частоте встречаемости вируса в эпителиальной ткани у больных и здоровых людей диктует необходимость изучения возможной роли ВПЧ в возникновении карцином головы и шеи. Кроме того, вызывает научный интерес выяснение влияния ВПЧ на патогенез опухолей, а также оценка взаимосвязи между наличием паппиломавирусной инфицированности и особенностями иммунорегуляции, определяемым различными генетическими вариантами генов цитокинов. Выяснение этих аспектов возникновения и развития опухолей рта и глотки позволит персонализировать диагностику и терапию плоскоклеточных карцином такой локализации.
Целью настоящей работы является характеристика влияния папилломавирусной инфекции на развитие плоскоклеточных карцином головы и шеи с учетом иммуногенетических особенностей пациентов, а именно наличия SNP-мутаций генов ключевых цитокинов и супрессоров опухолевого роста.
Материалы и методы. В качестве обследуемых были выбраны 84 пациента отделения опухолей головы и шеи ГБУЗ «ВОКОД №1» возрастом от 31 до 81 лет, среди которых женщины составляли 11,9%, мужчины – 88,1%. Также на базе ГУЗ «Поликлиника №20» была сформирована контрольная группа, в которую вошли 36 здоровых добровольцев, не имеющих онкологической патологии, возрастом от 30 до 74 лет, среди которых женщины составляли 11,1%, а мужчины 88,9%. Определение наличия ВПЧ в образцах опухолевой ткани и буккального соскоба и генотипирование полиморфизмов промоторных участков генов интерлейкина 10, фактора некроза опухоли альфа, супрессора опухолевого роста ТР53 осуществляли методом ПЦР тест-системами производства НПО «Литех» (Россия). Обработку экспериментальных данных проводили с помощью программ Excel из пакета Office XP, программы «Statistica 6.0».
Результаты и обсуждение. Мы изучали наличие ДНК ВПЧ в образцах опухолевой ткани пациентов и в образцах буккального соскоба здоровых добровольцев и выявили с помощью точного критерия Фишера статистически значимые различия между этими группами в частоте распространенности ВПЧ. ДНК ВПЧ в образцах буккального соскоба контрольной группы присутствовала в 5,56% случаев. ДНК ВПЧ в образцах опухолевой ткани пациентов встречалась в 27,87% случаев. Причем среди образцов опухолевой ткани у пациентов с карциномами гортани ДНК ВПЧ была обнаружена в 18,18% случаев, у пациентов с карциномами ротовой полости и глотки – в 39,29% случаев. Высокий процент встречаемости ВПЧ у пациентов может свидетельствовать о роли ВПЧ в онкогенном перерождении эпителиальной ткани головы и шеи. Это подтверждается данными литературы [5, 7].
Кроме того, показано влияние вируса на характер опухолевого процесса. У носителей ВПЧ чаще встречаются опухоли с ранними степенями местной распространенности опухолей (Т1+Т2). Это может быть объяснено тем фактом, что, несмотря на возможную роль ВПЧ как фактора, провоцирующего развитие рака, наличие вируса распознается иммунной системой, опосредованно активирующей противоопухолевый иммунный ответ. Этот факт подтверждается значениями коэффициентов тяжести заболевания (отношение клинической стадии опухоли к продолжительности заболевания, мес.): для носителей ВПЧ он составляет 0,32±0,12 ед., для пациентов без ВПЧ – 0,49±0,21 ед. Многими исследователями отмечалось, что наличие ВПЧ в опухолевой ткани можно рассматривать как прогностически благоприятный фактор к лучшей выживаемости пациентов [5].
Для понимания сложных механизмов развития плоскоклеточных карцином головы и шеи необходимо учитывать не только образ жизни и наличие ВПЧ, но и индивидуальные генетические особенности пациентов [1, 2].
Возникновение онкологических заболеваний связано с иммунологическими нарушениями. Так интерлейкин 10 (IL10) является одним из важнейших противовоспалительных цитокинов. При различных опухолях отмечено повышение уровня IL10, при этом считается, что повышение уровня продукции IL10 является плохим прогностическим признаком и сочетается с выраженной прогрессией опухолевого роста. Мы обнаружили более высокую частоту встречаемости генотипа GG полиморфизма IL10 G1082A у контрольной группы по сравнению с пациентами с карциномами головы и шеи в целом (критерий χ2, р=0,079), а также высокую распространенность генотипа СС у здоровых добровольцев (критерий χ2, р=0,09) (табл.1).
Таблица 1. Распределение частот аллелей и генотипов полиморфных вариантов гена IL10
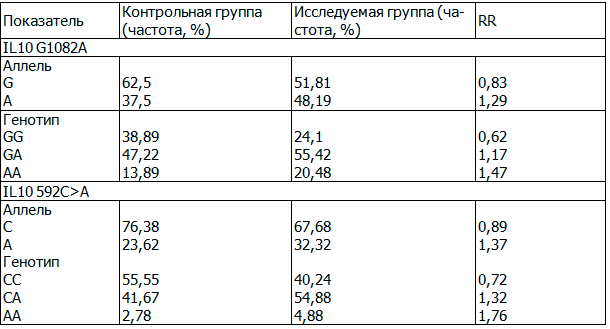
При оценке влияния различных генотипов на характер опухолевого роста с помощью точного критерия Фишера было выявлено, что у носителей генотипа СС достоверно чаще встречаются опухоли с Т1 и Т2 степенями местной распространенности и с ранними (I и II) клиническими стадиями. Снижение экспрессии IL10 у носителей генотипа СС приводит к активации клеточного иммунитета и характеризуется меньшей злокачественностью опухолевого процесса. Кроме того, ВПЧ наиболее часто встречался у пациентов с карциномами гортани с генотипом СС по сравнению с носителями аллеля А, что свидетельствует о роли ВПЧ в канцерогенезе эпителия гортани при отсутствии иммуносупрессии IL10.
При оценке распределения частот генотипов SNP-мутации в позиции TNFа G308A у пациентов с карциномами головы и шеи и здоровых людей значимых различий обнаружено не было. При анализе значений коэффициента тяжести заболевания для пациентов с карциномами ротовой полости и глотки была выявлена тенденция, что у носителей аллеля А в позиции TNF G308A по сравнению с носителями генотипа GG заболевание протекает тяжелее. А для пациентов с карциномами гортани с помощью точного критерия Фишера была выявлена более редкая встречаемость Т4 степени местной распространенности опухоли у пациентов с генотипом GG по сравнению с носителями аллеля А. Все это может быть объяснено тем фактом, что замена G на А в положении 308 гена приводит к повышению уровня экспрессии TNFa и опосредованной супрессии опухолевого роста.
При оценке распределения частот генотипов SNP-мутации в позиции TP53 Pro72Arg у пациентов с плоскоклеточными карциномами головы и шеи и здоровых людей были выявлены статистически значимые различия между этими группами (табл.2).
Таблица 2. Распределение частот аллелей и генотипов полиморфного варианта гена TP53 Pro72Arg
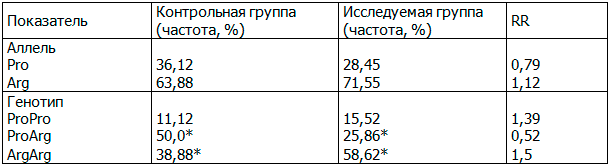
Примечание: *- статистически значимые отличия между исследуемой и контрольной группами (критерий χ2, р<0,05).
Белки р53 с остатком Pro и с остатком Arg в положении 72 снижают способность к апоптозу по внутреннему пути и по внешнему пути соответственно. Этим может быть объяснены протективные свойства генотипа ProArg. При оценке влияния различных генотипов на характер опухолевого роста было выявлено у носителей аллеля Pro достоверно чаще встречаются опухоли с Т4 степенью распространенности и более высокие степени регионарного метастазирования (N1 и N2). Для пациентов с карциномами ротовой полости и глотки и с карциномами гортани общая тенденция в распределении частот генотипов TP53 Pro72Arg сохранилась. Для карцином гортани факторами риска можно считать гомозиготные генотипы по аллелям Pro и Arg, кроме того, с помощью точного критерия Фишера была выявлена тенденция к более частой распространенности ВПЧ у пациентов с генотипом ProArg по сравнению с носителями генотипа АrgArg. Данный факт может свидетельствовать о роли ВПЧ в возникновении рака гортани при протективном генотипе гена ТР53.
Кроме того, при анализе комбинаций генотипов SNP-мутаций генов IL10, ТР53, TNFa у пациентов с плоскоклеточными карциномами головы и шеи было показано, что чаще у здоровых добровольцев встречаются генотипы ProArg GG и ProArg СС для генов TP53 Pro72Arg и TNF G308A и генов TP53 Pro72Arg и IL10 592C>A. Значения RR составили 0,39 и 0,38 соответственно.
Выводы. Таким образом, для оценки риска развития плоскоклеточных карцином головы и шеи можно рекомендовать определять наличие ДНК ВПЧ в эпителиальной ткани буккального соскоба и полиморфизмы генов ТР53 (Pro72Arg) и IL10 (592C>A и G1082A) (табл.3).
Таблица 3. Основные факторы риска развития плоскоклеточных карцином головы и шеи

Причем для карцином различной локализации рекомендации несколько различаются (табл.4).
Таблица 4. Основные факторы риска развития плоскоклеточных карцином гортани и глотки
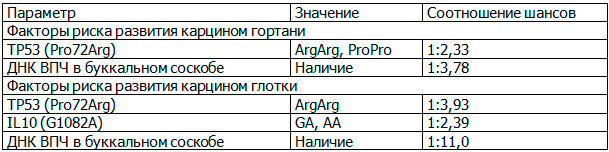
Также возможно оценивать тяжесть течения при уже возникшем заболевании: прогностически неблагоприятными факторами можно рассматривать отсутствие ВПЧ в пораженной ткани, носительство аллеля Pro гена ТР53 (Pro72Arg), аллеля А гена IL10 (592C>A), аллеля А гена TNF (G308A).
