Рак молочной железы (РМЖ) является самой частой злокачественной опухолью у женщин. Число новых случаев заболевания в мире превышает 1 млн в год. На протяжении жизни одна из 7 женщин в США, а в России одна из 12 женщин заболевает РМЖ [6]. Рак молочной железы занимает первое место в структуре заболеваемости злокачественными новообразованиями среди женщин в России и составляет 21,2 на 100 тыс. женщин [3]. В Ханты-Мансийском автономном округе (ХМАО), расположенном на севере Тюменской области, заболеваемость РМЖ выше, чем в среднем по России и составляет 26,5 на 100 тыс. женщин [9].
На фоне комплексного лечения РМЖ у больных появляется болевой синдром, который чаще обусловлен явлениями остеопороза. Причиной развития метаболических нарушений костной структуры при остеопорозе является как влияние самой болезни, так и результат воздействия большого количества факторов, в том числе полихимиотерапии, гормонотерапии и хирургической кастрации, которые являются важными методами лечения рака молочной железы [15]. Эндокринная терапия может вызвать снижение минеральной плотности кости (МПК) за счет уменьшения уровня эстрогенов (ингибиторы ароматазы, аналоги гонадотропин релизинг-гормона), так и путем влияния на соответствующие сигнальные пути (тамоксифен у женщин в пременопаузе) [6]. Кроме того, некоторые химиотерапевтические препараты способны оказывать прямое повреждающее действие на костную ткань, приводя к быстрому снижению МПК, а также вызывать дисфункцию яичников с развитием преждевременной менопаузы. Таким образом, комплексное лечение РМЖ приводит к развитию остеопороза, на фоне чего усиливается болевой синдром, ухудшая качество жизни пациентов [9].
На сегодняшний день проблема потери костной ткани в результате противоопухолевого лечения рака молочной железы является актуальной проблемой в подгруппе больных с большой продолжительностью жизни, у которых противоопухолевая терапия (эндокринная терапия, химиотерапевтическое лечение и хирургическая кастрация) приводит к снижению уровня половых гормонов - эстрогенов. Несмотря на то, что адекватная терапия остеопороза способна снизить частоту последующих осложнений на 40-60%, диагностика проводится менее чем у 25% женщин, а соответствующую адекватную терапию получает еще меньшее количество пациенток [6]. Остеопороз является серьезным нежелательным явлением, отрицательно влияющим на качество жизни онкологических больных, в первую очередь, за счет болевого синдрома, который носит постоянный характер [17].
Оценка состояния обмена химических элементов в организме позволяет с достаточной точностью судить об эффективности работы его функциональных систем и риске развития тех или иных патологических состояний [4]. В настоящее время получены многочисленные научные данные, подтверждающие взаимосвязь между неадекватной обеспеченностью организма человека биоэлементами и возникновением различных заболеваний, в т. ч. Онкологических [7]. В частности, известно, что кальций (Са) относится к металлам с непеременной валентностью, его достаточное поступление и нормальный обмен в организме рассматриваются как важный защитный антионкологический барьер [5], а в исследованиях S.O. Lee соавт. [14] доказано сдерживание роста рака молочной железы под воздействием Se.
Цель - выявление взаимосвязи остеопороза у больных раком молочной железы фертильного возраста и болевого синдрома и повышение эффективности диагностики остеопороза у данной категории больных с целью улучшения качества их жизни.
Материал и методы исследования. Работа основана на обследовании 157 женщин: из них 103(65,6%) - женщины, страдающие РМЖ, и 54(34,4%) - женщины без РМЖ. В возрасте от 30 до 50 лет обследовано 47 больных РМЖ и 54 женщины группы сравнения. Клиническими базами для проведения исследования были БУ «Няганская окружная больница» г. Нягани и онкологический центр БУ «Окружная клиническая больница» г. Ханты-Мансийска в период с 2013 по 2015 г.
Критериями включения в обследование были: больные с гистологически верифицированным диагнозом рака молочной железы в фертильном возрасте. Всем пациенткам была проведена остеосцинтиграфия для исключения метастазов в кости. Критериями исключения из обследования явились: первично-множественные опухоли, пациентки с наличием метастазов в кости, больные, принимающие более 3 месяцев глюкокортикоиды, высокие дозы L-тироксина, заболевания щитовидной железы, надпочечников. Критериями исключения из обследования группы контроля явились: ранняя менопауза, длительный прием глюкокортикоидов, заболевания щитовидной железы, надпочечников, печени и почек.
Исследования проводили с соблюдением этических норм, изложенных в Хельсинской декларации и Директивах Европейского сообщества (8/609ЕС). В соответствии со ст. 30-34, 61 «Основ законодательства РФ об охране здоровья граждан» от 22.07.1993 г. № 5487-1, ст. 18, 20-22, 28, 41 Конституции РФ все обследуемые лица давали информационное добровольное согласие на выполнение диагностических исследований и в соответствии с требованиями ст. 9 закона РФ от 27.07.2006 г. «О персональных данных» №152-ФЗ - на обработку персональных данных.
Обследование включало в себя проведение остеоденситометрии, который определялся методом DXA на денситометре EXPLORER производства Hologic (США, 2007). При стандартной остеоденситометрии нами измерялась минеральная плотность костной ткани в поясничном отделе позвоночника и проксимальном отделе бедренной кости. Время, необходимое для исследования, составило 20 минут. По результатам остеоденситометрии в соответствии с рекомендациями ВОЗ (2001) проводилась оценка Т- критерия, результаты оценивались как: нормальные - при значении Т- критерия от (+2) до (-1) ББ (стандартное отклонение), остеопения - от (- 1,1) до (- 2,5) ББ и остеопороз - менее (- 2,5) ББ.
Оценка болевого синдрома проводилась с помощью Мак-Гилловского болевого опросника [15] и по данным классификации болевого синдрома. Болевой синдром при остеопорозе характеризуется снижением работоспособности, повышенной утомляемостью, болью в спине, в том числе, после физической нагрузки, ощущением тяжести между лопатками, необходимостью отдыха в положении лежа. Появляются летучие боли в костях и суставах, непостоянные, усиливающиеся при смене погоды, минимальная утренняя скованность не более 30 минут, уменьшение объема движений. По данным симптомам нами составлены критерии классификации болевого синдрома.
В волосах обследованных лиц было проведено определение концентрации кальция (Са) и селена (Se) методами атомно-эмиссионной спектрометрии и масс-спектрометрии с индуктивно связанной аргоновой плазмой (АЭС-ИСП и МС-ИСП) в Центре биотической медицины (Москва) [2]. Показатели концентрации химических элементов в волосах сравнивали с референтными значениями [11]. Установлено, что волос является более подходящей тканью, чем кровь или моча, для исследования баланса микроэлементов.
Вычисляли среднюю величину вариационного ряда (M), среднеквадратичное отклонение (σ), в качестве мер рассеивания параметров с ненормальным распределением использовали 25 и 75 перцентили. Достоверность различий анализировали с применением критерия Манна-Уитни для непараметрических величин: за достоверные принимали различия при значениях р<0,05. Полученный материал обрабатывали с использованием программы MS Exсel и STATISTICA 8.0.
Результаты исследования и их обсуждение. В контрольной группе женщин фертильного возраста (от 30 до 50 лет) остеопения - начальные изменения костной ткани, наблюдалась в 6 случаях, что составило 11,1%. Остеопороза в группе сравнения не было. Клинические проявления в виде болевого синдрома 1 степени у здоровых женщин наблюдались 10 случаях, что составило 18,5%.
Лечение больных РМЖ зависит как от стадии, так и от гистологической и иммуногистохимической характеристики опухоли, ее степени злокачественности.
Всем 47 пациенткам проведено оперативное лечение, из них 7(14,9%) радикальная резекция молочной железы. 18(38,3%) пациенткам проведена неоадьювантная полихимиотерапия (НАПХТ) в связи с распространенностью процесса и с целью проведения органосохраняющей операции. 38(80,8%) получили АПХТ, 12(25,5%) - лучевую терапию. Гормонотерапия назначена 36(76,6%) больной РМЖ.
Всем пациенткам с диагнозом РМЖ проводилось обследование до назначения специального лечения и через полгода после проведенного лечения.
При анализе 47 больных РМЖ фертильного возраста болевой синдром до лечения основного заболевания определялся в 6 (12,7%) случаях. Через 6 месяцев после лечения РМЖ болевой синдром был выявлен в 36 (76,6%) случаях: в 18 - 1 степень, в 16 - 2 степень и в 2 случаях - 3 степень (рис. 1). Получена статистическая достоверная разница появления и усиления болевого синдрома до лечения по поводу рака молочной железы и через 6 месяцев после проведенного лечения (р<0,01).
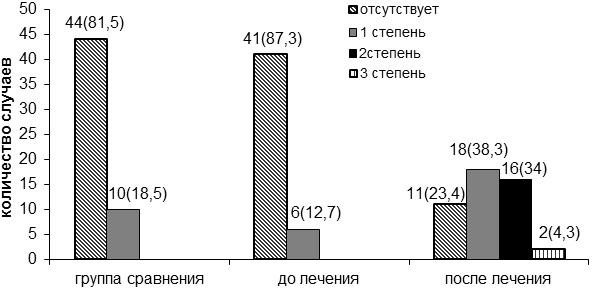
Рис. 1. Проявление болевого синдрома на фоне лечения рака молочной железы (абсолютное число и %).
Пациенткам с диагнозом РМЖ была проведена остеоденситометрия: 1 группа - нормальные значения Т-критерия, 2 группа - остеопения (отклонение Т-критерия по остеоденситометрии от -1,1 до -2,5 ББ) и 3 группа - остеопороз (показатели остеоденситометрии менее -2,5 ББ Т-критерия).
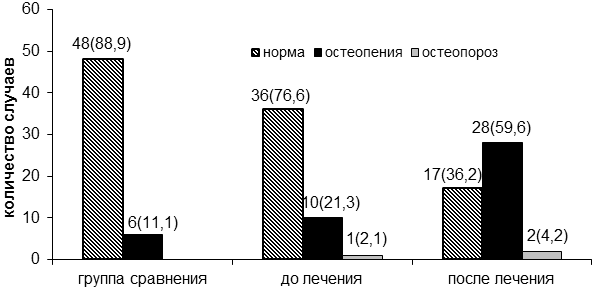
Рис. 2. Проявление остеопении и остеопороза на фоне специального лечения рака молочной железы (абсолютное число и %).
У больных РМЖ до лечения признаки остеопении и остеопороза наблюдались в 11 (23,4%) случаях, из них у 1 - остеопороз, а через полгода после проведенного лечения - в 30 (63,8%) случаев, из них 2 пациенток с остеопорозом (рис. 2).
Среднее значение абсолютных показателей МПК женщин в исследовании до лечения составило -0,01+1,23 г/см2, уже через 6 месяцев после проведенного лечения средний показатель МПК составил -0,85+1,24 г/см2. Получены статистически значимые результаты появления остеопороза и остеопении после проведенного лечения по поводу рака молочной железы (р<0,001).
На фоне проведенного специального лечения уже через 6 месяцев у больных РМЖ фертильного возраста достоверно увеличивается количество случаев развития остеопороза и остеопении на фоне проявления и (или) усиления болевого синдрома (рис. 3). Прямая корреляционная зависимость болевого синдрома от степени остеопороза и остеопении до и после проведения специального лечения подтверждена статистически (р<0,01).
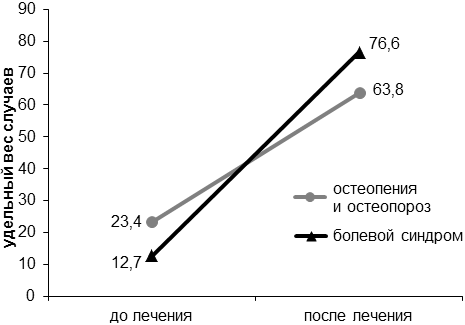
Рис. 3. Соотношение остеопороза и остеопении с болевым синдромом у больных раком молочной железы на фоне проведенного специального лечения (в %).
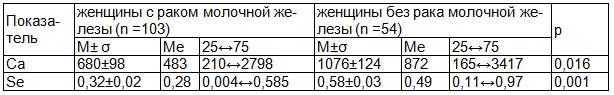
Концентрация химических элементов в волосах обследуемых лиц обеих групп находилась в диапазоне физиологически допустимых значений для здоровых лиц соответствующего возраста [11]. Однако обнаружена достоверно более низкая концентрация Са (р = 0,016) и Se (p<0,001) в волосах женщин с РМЖ по сравнению с таковым показателем у группы контроля. Доказано, что изменения содержания Ca в волосах также могут свидетельствовать об остеопорозе [5] (табл. 1).
Таблица 1. Содержание в волосах кальция и селена у женщин с раком молочной железы (мкг/г)
В табл/ 2 показано, как были распределены обследованные нами лица по степени обеспеченности изучаемыми химическими элементами.
Обращает на себя внимание, что практически у половины женщин с РМЖ и у трети обследованных женщин без РМЖ было обнаружено нарушение обеспеченности Са. При этом дефицит различной степени выраженности характеризовал элементный статус 40(38,8%) больных с РМЖ и 12(22,2)% женщин без РМЖ. Избыток Са обнаружен у 9(8,8%) женщин с РМЖ и у 6(11,1%) женщин без РМЖ (табл. 2). Избыточное содержание Са в волосах, по мнению А.В. Скального, характеризует ускоренное выведение данного биоэлемента из организма и является, по сути, стадией преддефицита [11].
Таблица 2. Структура обеспеченности кальцием и селеном женщин (%)
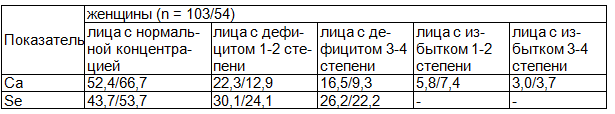
Примечание: процентное соотношение концентрации химического элемента у обследованных лиц с РМЖ к лицам без РМЖ.
Наиболее значимые достоверные (p<0,001) различия между обследованными группами женщин группы сравнения и с диагнозом РМЖ были выявлены в отношении главного микроэлемента антиоксидантной защиты организма человека - Se[1]. Результаты исследований, проводившихся в районах с низким потреблением Se, свидетельствуют о высоком риске онкологических заболеваний [13]. Нормальная обеспеченность Se является не только профилактикой некоторых видов рака, но и препятствует прогрессированию и метастазированию уже образовавшихся опухолей. Исследования Y.M. Shah с соавт. показали антиканцерогенный эффект Se при раке молочной железы. Применение Se ингибировало эстрогеновые рецепторы альфа (ER-alpha), что объясняет механизм не только превентивного действия Se у женщин с высоким риском РМЖ, но и терапевтическую обоснованность стратегии применения Se для борьбы с уже развившимся РМЖ [15].
Дефицит главного микроэлемента антиоксидантной защиты - Se наблюдается в обеих группах женщин, но в наибольшей степени выраженный у больных РМЖ: адекватно обеспечены Se оказались менее половины женщин с РМЖ и 29(53,7%) пациентов без РМЖ (табл. 2).
Выводы
- Остеопороз и остеопения у больных РМЖ фертильного возраста после комплексного лечения выявляется в 63,8% случаев, а болевой синдром в 76,6% случаев, что подтверждено статистически (р<0,01). Имеется прямая корреляционная зависимость появления и усиления болевого синдрома от степени остеопороза и остеопении до и после проведения специального лечения (р<0,01).
- Остеопороз чаще наблюдается у пациенток, которым проведено комплексное лечение с блокировкой функции яичников, т. е. наступлением искусственной менопаузы (р<0,01). Этим пациенткам рекомендовано проведение остеоденситометрии для своевременной диагностики остеопороза.
- Зарегистрировано достоверно более низкое содержание кальция (р=0,016) и селена (p<0,001) в волосах у больных раком молочной железы по сравнению с группой контроля.
- С целью профилактики и лечения рака молочной железы, наряду с общепризнанными методами, необходима оптимизация обеспеченности кальцием и селеном женщин при помощи необходимых препаратов и обогащенных данными биоэлементами продуктов питания.
