Введение. Рак молочной железы (РМЖ) является самым распространенным онкологическим заболеванием у женщин. Ежегодно в России регистрируются около 50 тыс. новых случаев РМЖ и доля этой патологии среди злокачественных новообразований женского населения составляет 20,1% [6, 9]. Основным методом лечения локализованных форм рака остается хирургическое лечение. На современном этапе, главная задача хирургического лечения рака молочной железы - это уменьшение объема оперативного вмешательства без снижения радикализма.
Основные принципы интраоперационной лучевой терапии. В настоящее время, операцией без нарушения онкологических принципов можно считать радикальную мастэктомию в различных модификациях. Органосохраняющие операции при РМЖ на начальных стадиях заболевания получили свое развитие с середины 70-х годов прошлого столетия. Многочисленные исследования при ранних стадиях РМЖ продемонстрировали не только отсутствие преимуществ радикальной мастэктомии перед органосохраняющими оперативными вмешательствами, но и показали, что различия в объеме удаляемых тканей незначительно влияют на прогноз заболевания: общая и безрецидивная выживаемость при органосохраняющем лечении не хуже, чем при радикальной мастэктомии [8, 21].
Открытие противоопухолевого эффекта лучевой терапии позволило улучшить показатели выживаемости больных раком молочной железы и сейчас дистанционная радиотерапия после органосохраняющих операций (ОСО) не вызывает сомнений, а многочисленные клинические исследования подтверждают необходимость этого [7, 14, 18, 21].
Современные данные о патологии рака молочной железы дают возможность утверждать, что скрытые и латентные поражения в тех областях молочной железы, которые расположены вдали от оперированного квадранта, не являются причиной для местных рецидивов, которые почти всегда возникают в месте первоначального удаления. В данной ситуации тщательно направленная радиотерапия на ложе удаленной опухоли с высокой дозой, проведенная во время хирургической операции, может устранить необходимость в терапии с внешним пучком, а это даст возможность сэкономить время госпитализации пациентов и сократить длительность эксплуатации аппаратуры. Более того, контакт стенок остаточной полости с аппликатором после удаления опухоли обеспечивает куда более удачную конформальную геометрию, чем имитаторы, необходимые для терапии с внешним пучком, а это теоретически должно улучшить локальный контроль над заболеванием [7, 14, 15].
В настоящее время, существует простой и надежный способ воздействия на ложе опухоли - интраоперационное облучение с помощью INTRABEAM системы. При использовании системы INTRABEAM, ткань-мишень - ложе опухоли - непосредственно прилежит к источнику излучения, таким образом, достигается максимальная точность облучения. Mackenzie P. и соавт. утверждают, что интраоперационная радиотерапия может заместить внешнюю дистанционную радиотерапию молочной железы [16].
Пожалуй, наиболее известным рандомизированным многоцентровым исследованием, посвященным изучению эффективности интраоперационной лучевой терапии (ИОЛТ) является TARGIT-А, запущенное в 2000 г.
В исследовании изучается сопоставимость результатов ИОЛТ аппаратом INTRABEAM с результатами традиционной внешней лучевой терапией у пациенток с ранними формами РМЖ. Критерии включения: операбельный цитологически или гистологически подтвержденный инвазивный рак (Т1 и T2 малого размера, N0-1, М0), возможность проведения органосохраняющей операции, возраст от 45 лет и старше и наличие возможности регулярного наблюдения не менее 10 лет. Ранее леченные и оперированные по поводу контралатерального РМЖ включались в отдельную группу. Противопоказаниями для проведения ИОЛТ были следующими: более 1 опухолевого очага в одной молочной железе, билатеральный процесс, рак ипсилатеральной железы в анамнезе, пациенты выявленной с мутацией BRCA2, дольковый рак или экстенсивный протоковый компонент по результатам предоперационной верификации, получающие неоадъювантую терапию более 4-х недель. На основании планового патоморфологического исследования, при обнаружении более 4 пораженных метастазами регионарных лимфоузлов, при наличии неблагоприятного прогностического критерия (инвазивный дольковый рак, экстенсивный протоковый компонент, инвазия сосудов или степень злокачественности III), больные исключались из протокола TARGIT-A и им проводился курс послеоперационного внешнего облучения. В этих случаях ИОЛТ считался как «boost» к ложу опухоли. Если по результатам срочного гистологического исследования края резекции содержали опухолевые элементы, полагалось производить ререзекцию с последующей радиотерапией в послеоперационном периоде. Цель исследования - сравнение эффективности и безопасности ИОЛТ в сравнении с дистанционной лучевой терапией (ДЛТ) у женщин с ранними формами РМЖ. Первая точка для прекращения наблюдения - развитие местного гистологически подтвержденного рецидива. Вторичными точками исследования были токсичность и прочие осложнения, прогрессия вне первичного очага, общая и безрецидивная выживаемость. Набор пациентов осуществлялся до 2010 г. В группе ИОЛТ были выделены две подгруппы. Первой (около 70% пациенток) сеанс интраоперационной лучевой терапии был проведен одновременно с удалением первичной опухоли. В англоязычной литературе эта группа названа ”prepathology”. Пациентки второй группы (“postpathology”) получили ИОЛТ после туморэктомии, после окончательного патоморфологического исследования удаленной опухоли.
При статистическом анализе качественных (номинальных) переменных с помощью таблиц сопряженности получали распределение частот в исследуемых группах, для их статистического сравнения использовали критерий χ2, χ2 с поправкой Йетса (в зависимости от данных в таблице ожидаемых частот). Сравнение количественных показателей с распределением, отличающимся от нормального закона, проводилось с помощью критерия Манна-Уитни.
При медиане наблюдения 29 месяцев, 5-летний риск местного рецидива составил 1,3% в группе ДЛТ и 3,3% - ИОЛТ (р=0,042). В подгруппе “prepathology” 5-летний риск составил 2,1%, а подгруппе “рostpathology” - 5,7%. Показатели общего рецидивирования (в ипсилатеральной и контралатеральной молочной железе, по регионарным лимфоузлам и отдаленным метастазам) были хуже при ИОЛТ в сравнении с ДЛТ: 69 случаев на 48 (р=0,053). Около 21% пациентов в подгруппе prepathology, получили также курс ДЛТ, так как по результатам окончательного патоморфологического ответа выявлены факторы высокого риска рецидива. Отмечено, что у пациентов, подвергнутых ИОЛТ с последующей ДЛТ, риск местного рецидива был в 3 раза меньше, чем при проведении только ИОЛТ (0,9 против 2,7%). Однако это разница не была статистически значимой, при этом показатель р не был определен. По данным за 2014 год, только у 1222 пациентов (35%) отслежены 5-летние результаты, 611 (18%) из них получили ИОЛТ. Окончательные результаты ожидаются [16, 17, 20, 23].
После того, как Американское общество по радиационной онкологии (ASTRO) и Европейское общество терапевтической радиологии и онкологии (GEC-ESTRO) опубликовали свои рекомендации, можно сказать, что у пациентов низкого риска местного рецидива, согласно рекомендациям ASTRO и GEC-ESTRO, применение интраоперационной лучевой терапии может в конечном итоге может продемонстрировать долгосрочную эффективность и безопасность сопоставимую с применением стандартной дистанционной лучевой терапией. Исследование ELIOT, предварительные данные исследования TARGIT-A показали, что ИОЛТ не уступает стандартной ДЛТ у строго отобранных пациентов [15, 19].
Цель исследования. На основании дизайна исследования TARGIT - A, в условиях онкомаммологического отделения СПб ГБУЗ ГКОД проведено собственное исследование для сравнения эффективности лечения двух групп пациенток, получивших ОСО и ИОЛТ, либо ОСО с стандартной дистанционной лучевой терапией.
Материалы и методы. В исследование было включено 259 больных раком молочной железы со стадией процесса T1-2N0M0. В ретроспективный этап исследования было взято 130 пациенток, ранее получавших комбинированное, органосохраняющее лечение со стандартной дистанционной лучевой терапией (ОСО+ДЛТ) с 2009 по 2013 г. В проспективном этапе участвовало 129 женщин, которые получили органосохраняющее лечение с интраоперационной лучевой терапией аппаратом INTRABEAM (ОСО+ИОЛТ) с 2011 по 2013 г. Все женщины, принимавшие участие в исследовании, дали на то информированное согласие, а протокол исследования был одобрен на заседании Комитета по вопросам этики при Санкт-Петербургском медицинском университете им. акад. И.П. Павлова.
Характеристика исследованных групп. Пациентки с метастазами в подмышечных лимфатических узлах, с дольковым раком и опухолями 3 степени гистологической злокачественности не включались в исследование. Также исключались больные, у которых по данным окончательного гистологического ответа выявлен выраженный внутрипротоковый компонент.
Среди пациентов основной группы и группы сравнения более 2/3 составили женщины в возрасте от 40 до 59 лет, четверть пациенток в обеих группах принадлежала возрастной группе 60-74 лет, доля пациенток старше 75 лет была минимальной (табл. 1). Проведенный анализ показал, что распределения пациенток по возрастным группам в основной группе и в группе сравнения не имели значимых различий, т.е. сформированные группы однородны по возрастному составу.
Таблица 1. Распределение пациентов основной группы и группы сравнения по возрасту
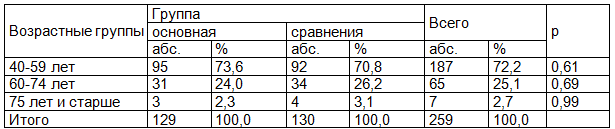
Распределение пациенток основной группы по стадиям опухолевого процесса соответствовало распределению группы сравнения (р=0,96). В обеих группах более 80% составили пациентки со стадией T1N0M0 (83% и 82,3%), менее 20% - со стадией T2N0M0 (17% и 17,7%) (табл. 2). Т.о., основная группа и группа сравнения однородны по стадиям опухолевого процесса.
Таблица 2. Распределение пациентов основной группы и группы сравнения по стадиям опухолевого процесса
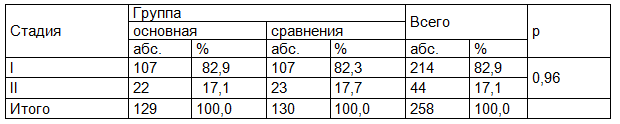
Соотношение видов системной терапии было различным в основной группе и в группе сравнения (р=0,016). Большинство пациентов в обеих группах в качестве системной терапии получали гормонотерапию (ГТ), но в основной группе доля таких пациентов была больше, чем в группе сравнения (79,8% и 63,8% соответственно, р=0,0042). Значительно реже пациенты получали комбинированную системную терапию (химиотерапия (ХТ) + гормонотерапия), в основной группе таких пациенток было значимо меньше, чем в группе сравнения (15,5% и 28,5% соответственно, р=0,012). ХТ назначалась в минимальном количестве случаев в обеих группах (табл. 3).
Таблица 3. Системная терапия у пациентов основной группы и группы сравнения
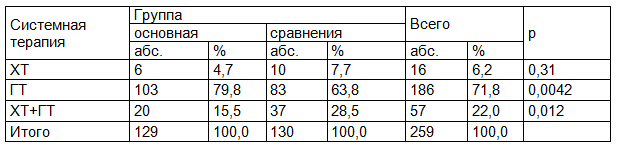
Более частое назначение ХТ в группе сравнения обусловлено тем, что до 2013 г. в СПБГКОД не определялся ki67. Тем самым определялось более агрессивное лечение части пациенток до 2013 г.
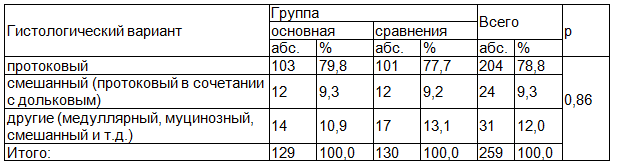
Изучаемые группы пациенток были однородны по гистологическому варианту опухоли (р=0,86), при этом протоковый тип определялся у большинства пациенток как в основной группе, так и в группе сравнения (табл. 4).
Таблица 4. Распределение пациенток основной группы и группы сравнения по гистологическому варианту опухоли
Методика проведения оперативного вмешательства. Больным исследуемой (I) группы проводилась интраоперационная лучевая терапия на аппарате ITRABEAM, установленном непосредственно в операционной. Однократная доза ИОЛТ на ложе удаленной опухоли составила во всех случаях 20 Гр. Для облучения использовались аппликаторы, которые подбирались в зависимости от размеров операционной раны.
Этапы проведения оперативного вмешательства при использовании аппарата INTRABEAM в нашем исследовании:
- До операции. Проводилась ультразвуковая (УЗИ) разметка образования в молочной железе. За 3-5 часов до оперативного вмешательства подкожно и перитуморально вводился радиофармпрепарат - Технефит 99mTc.
- Выполнялась секторальная резекция опухоли молочной железы. Интраоперационно производилась оценка краев резекции при срочном гистологическом исследовании на наличие опухолевых клеток.
- С помощью гамма-датчика Gamma Finder II в подмышечной области производился поиск сигнальных лимфоузлов. Выполнялась биопсия сигнальных лимфоузлов. Сигнальные лимфоузлы отправлялись на срочное гистологическое исследование для оценки вовлеченности опухолевым процессом.
- Оценивался размер раны и выбор диаметра аппликатора в соответствии с полученными данными. Аппликатор устанавливался в полость раны.
- Проводился сеанс ИОЛТ.
- Контроль гемостаза и отсутствия инородных тел. Послойный шов ран.
В группе сравнения (II) дистанционная гамма-терапия на оставшуюся молочную железу проводилась в стандартном режиме фракционирования дозы: РОД 2 Гр 5 раз в неделю до величины СОД 50-55 Гр.
Результаты. Сроки наблюдения за больными, вошедшими в исследование, составил от 3 до 5 лет. За этот период времени рецидивы заболевания были выявлены у 5 (3,9%) больных, получивших ИОЛТ, у 4 (3,1%) больных получивших ДЛТ.
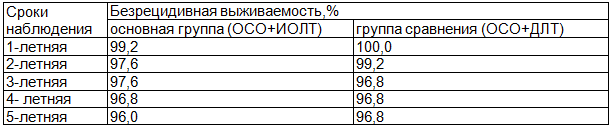
Анализ частоты и сроков появления местных рецидивов, показателей безрецидивной выживаемости представлен в табл. 5, 6. За 5-летний период наблюдения показатели безрецидивной выживаемости статистически не различались в исследуемых группах (р > 0,05).
Таблица 5. Частота и сроки появления рецидива опухоли в молочной железе после выполнения ОСО в зависимости от вида лучевой терапии
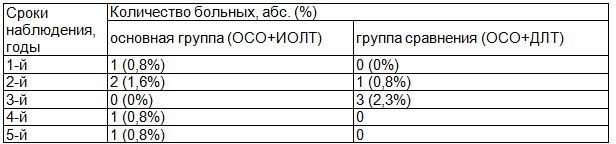
Таблица 6. Показатели безрецидивной выживаемости больных раком молочной железы после выполнения органосохраняющего лечения в зависимости от вида лучевой терапии
Анализируя данные по занятости койки пациентками основной группы, выявлено уменьшение сроков нахождения пациентов на койке до 3 дней, против 13 (p<0,001).
Выводы. В отличие от последних данных исследования TARGIT - A, полученные нами предварительные результаты показывают, что при строгом отборе пациенток (формировании группы низкого риска рецидива), показатели безрецидивной выживаемости в группе пациенток, получивших органосохраняющее лечение с интраоперационной лучевой терапией не хуже показателей в группе больных, подвергнутых ОСО со стандартной дистанционной лучевой терапией. Однако, требуются более длительные сроки наблюдения. У пациентов основной группы отмечены хорошие эстетические результаты, высокая удовлетворенность результатами лечения. Стоит отметить уменьшение койко-дня в основной группе.
