Введение. Краснодарский край - регион России, в котором патология щитовидной железы (ЩЖ) занимает одно из ведущих мест. Последние два десятилетия особенно резко обозначился рост онкопатологии ЩЖ. За последние 15 лет заболеваемость раком щитовидной железы (РЩЖ) выросла на 42% и составила 17,8 на 100000 населения (среднероссийский показатель 5,9). В Краснодарском крае один из самых высоких показателей смертности от злокачественных новообразований ЩЖ, составляющий 1,8 на 100000 населения. Прирост смертности за последние 15 лет составил 54,6%. Эти данные подтверждают необходимость определения адекватного объема операции при РЩЖ.
Аутоиммунный тиреоидит (АИТ) - заболевание, основным фактором развития которого является аутоиммунный процесс, ведущий к уменьшению объема функционирующей ткани ЩЖ. В настоящее время широкий интерес специалистов вызывает сочетание АИТ и злокачественного поражения ЩЖ. Наиболее частым показанием к проведению тонкоигольной аспирационной биопсии (ТАБ) при АИТ является наличие узловых образований в ЩЖ, требующих проведения дифференциального диагноза с аденомами или РЩЖ. Диагностическая точность ТАБ, как правило, повышена путем применения ультразвукового исследования (УЗИ) ЩЖ [1,6]. Сочетание РЩЖ и тиреоидит Хашимото (ТХ) наблюдается в 1-20% [7-9]. Сочетание высокодифференцированного рака щитовидной железы (ВДРЩЖ) с ТХ колеблется, по данным литературы, в пределах от 0,5 до 30%, а с болезнью Грейвса от 0 до 9,8%. В литературе имеются противоречивые данные на счет АИТ как о фоновой патологии для развития РЩЖ. Ранее считали, что раковая трансформация железы при ТХ обусловлена высоким уровнем тиреотропного гормона (ТТГ) в сыворотке крови, который компенсаторно повышается вследствие деструкции железы, а по последним же данным повышается чувствительность ЩЖ к ТТГ и другим ростовым факторам [6]. Дедов И.И. и соавт. считают, что лимфоцитарная инфильтрация ткани, прилегающая к участку злокачественной опухоли ЩЖ, оказывает протективное действие, снижая частоту метастазирования опухоли. О протективной роли лимфоцитарной инфильтрации указывают также Strauss M. et al. [10], результаты их исследований показали, что все пациенты с РЩЖ через 13 лет после операции живы без признаков местного рецидива или отдаленных метастазов. Авторы считают, что наличие хронической воспалительной реакции может подавлять рост и распространение метастазов одновременно существующих новообразований ЩЖ. Хирургическое вмешательство при АИТ проводится только по абсолютным показаниям: большие размеры зоба с компрессией жизненно важных органов, быстро растущий зоб (риск наличия РЩЖ), редкие болезненные формы зоба, не поддающиеся консервативной терапии [2-4]. В сочетании с АИТ могут формироваться узлы доброкачественной и злокачественной природы. До сих пор неясно, является АИТ фактором риска развития рака ЩЖ или это реакция ткани на опухоль. Не исключено, что это две независимые патологии, которые могут встречаться вместе [1].
Начиная с 6-й редакции классификации TNM (UICC, 2002) группа предгортанных, претрахеальных и паратрахеальных лимфатических узлов при РЩЖ выделена в отдельный непарный VI (центральный) уровень [5,6]. Лимфоузлы этой группы расцениваются как коллектор 1-го этапа метастазирования РЩЖ (N1a). Появилось немало работ, посвященных закономерностям метастазирования в регионарные лимфоузлы центральной зоны клетчатки шеи и методикам выполнения ЦЛА [5,6]. В опубликованных в последние годы рекомендациях по лечению РЩЖ европейских и американских ассоциаций специалистов (ЕТА, BТА, АТА, ААСЕ, NCCN) предлагается выполнять тиреоидэктомию с одновременной ЦЛА при опухолях более 1-2 см [6]. Несомненно, все зависит от гистологической структуры опухоли и степени агрессивности ее. Учитывая важность проблемы, мы анализируем собственный опыт оперативного лечения больных первичным РЩЖ в сочетании с АИТ, которым выполнялась ЦЛА.
Цель исследования. Определить частоту метастазирования в центральную группу лимфоузлов шеи при РЩЖ в сочетании с АИТ и определить необходимость удаления клетчатки этой зоны.
Материал и методы. В период с 2016 по 2018 г. в отделении эндокринной хирургии Краевой клинической больницы № 2 г. Краснодара оперативные вмешательстве на щитовидной железе с ЦЛА при первичном РЩЖ в сочетании с АИТ выполнены 224 пациентам (194 женщины и 30 мужчин). 81,6% пациентов находились в активном трудоспособном возрасте.
Статистика. При проведении анализа результатов был использован авторский пакет MedStat (Лях Ю.Е., Гурьянов В.Г., 2004-2011 г.) и статистический пакет MedCalc v. 17.9.2 (MedCalcSoftwareInc, Broekstraat, Бельгия). Для представления данных рассчитывалось среднее значение показателя (X) и стандартное отклонение (±SD). Для оценки эффективности лечения была рассчитана частота достижения эффекта (%) и ее 95% доверительный интервал (95% ДИ). При проведении сравнения двух групп использован критерий Стьюдента, для оценки гистологического исследования - непараметрический критерий Фридмана для сравнения повторных измерений (связанные выборки). Во всех случаях критический уровень значимости принят равным 0,05.
Результаты. Всем пациентам с очаговыми поражениями на фоне диффузно измененной аутоиммунным процессом ЩЖ выполнялась ТАБ под ультразвуковым контролем (УЗИ). Операцией выбора при верифицированном РЩЖ была тотальная экстрафасциальная тиреоидэктомия независимо от размеров узлового образования, учитывая, что измененная аутоиммунным процессом ткань не несет в 90% случаев гормональноактивной нагрузки и заместительную терапию получают все пациенты при подтвержденном лабораторном и цитологическом исследовании. По особенностям диагностики РЩЖ и объему оперативного вмешательства пациенты были разделены на 4 группы.
1-я группа - 192 пациента (85,7%) с цитологически верифицированным РЩЖ и опухолевыми образованиями диаметром до 4 см, которым на основании дооперационного УЗИ лимфоузлов II-VI зон шеи не было исключено метастазирование в регионарные лимфоузлы. Им была выполнена экстрафасциальная тиреоидэктомия с ЦЛА.
2-я группа - 15 пациентов (6,6%) с цитологическим результатом и цитологически подтвержденным раком диаметром до 2 см, у которых запланированный объем вмешательства - тиреоидэктомия с одновременной профилактической ЦЛА.
3-я группа - 5 пациентов (2,3%) с благополучными результатами предоперационного цитологического и гистологического исследований у которых была обнаружена фолликулярная опухоль. Им выполнена экстрафасциальная тиреоидэктомия. У этих пациентов РЩЖ диагностирован после получения окончательного результата гистологического исследования. В этих случаях в зависимости от гистологической структуры опухоли определялась дальнейшая тактика лечения.
4-ая группа - 12 пациентов (5,3%) с регионарным метастазированием в лимфоузлы II -V уровня (стадия рТ1-4aN1b) верифицированным до операции цитологически. Им выполнена экстрафасциальная тиреоидэктомия в сочетании с лечебными ЦЛА (VI уровень) и фасциально-футлярной лимфадендэктомией (II-V уровень).
Обсуждение. Оценка результатов проводилась по данным окончательного гистологического исследования. Учитывалась гистологическая структура, размер опухоли (стадия РЩЖ по TNM 8 редакции) [8] и наличие регионарных метастазов. В исследованных группах преобладали пациенты с ВДРЩЖ. В 2 раза более низкая, чем общестатистическая частота фолликулярного РЩЖ была обусловлена трудностями дооперационной цитологической диагностики этой патологии. Стадирование опухолевого процесса в ЩЖ по критерию T (классификация TNM 8-й редакции, UICC, 2018) представлено в табл.1.
Таблица 1. Стадия опухоли (T) в исследованных группах
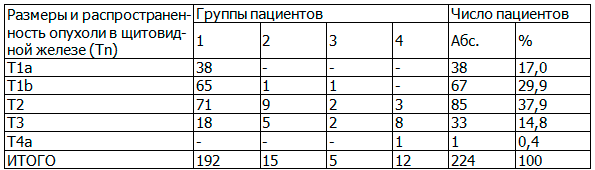
В большей части наблюдений РЩЖ был представлен опухолями диаметром от 1 до 4 см (T1b - T2), не распространяющимися за пределы ЩЖ. У 37 (16,5%) больных было внутриорганное метастазирование в контралатеральную долю (mpT1b-3), не выявленное до гистологического исследования. У 26 из них был папиллярный, а у 11 - фолликулярный рак. В первой группе пациентов по данным заключительного гистологического исследования папиллярный, фолликулярный и медуллярный РЩЖ выявлены соответственно в 154 (80,2%), 36 (18,8%), 2 (1,0%) случаях. Эти наблюдения оказалась наиболее информативными для оценки частоты регионарного метастазирования. Полученные после выполнения профилактической ЦЛА сведения о частоте регионарных метастазов в этой группе представлены в табл. 2.
Таблица 2. Частота выявления регионарных метастазов VI зоны шеи после тиреоидэктомии с ЦЛА у пациентов 1 группы
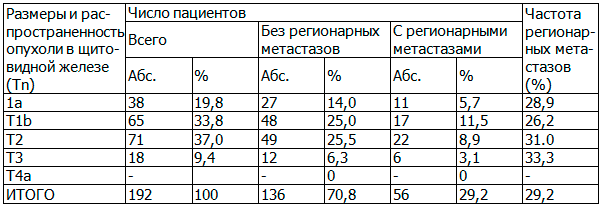
При папиллярном РЩЖ регионарные метастазы обнаружены у 53 больных (34,4%), а при фолликулярном у 3 (8,3%). В 2 случаях медуллярного РЩЖ, регионарного метастазирования не было. Метастазы в лимфатические узлы VI зоны шеи выявлены у 3 (20%) из них. У 5 пациентов 3-й группы, перенесших тиреоидэктомию, ЦЛА выполнена вторым этапом у одного пациента, учитывая, что при плановом гистологическом исследовании выявлен медуллярный рак и уровень кальцитонина в послеоперационном периоде был повышен до 350 пг/л. Учитывая гистологическую структуру опухоли минимальный объем оперативного вмешательства при медуллярном раке - тиреоидэктомия с ЦЛА. У остальных пациентов этой группы диагностировали папиллярный рак, и им было рекомендовано пройти радиойодтерапию с профилактической целью. Регионарных метастазов в этих случаях не обнаружено. Из 12 пациентов 4-й группы с РЩЖ (pT2-4; N1b) с цитологически подтвержденным метастазированием в лимфоузлы II-V зон шеи, у 10 обнаружены метастазы и во все группы лимфоузлов, включая VI зону шеи. В трех из этих наблюдений метастазы VI зоны шеи были двухсторонними. Таким образом, частота метастазирования в регионарные лимфатические узлы шеи при ВДРЩЖ высока и достигает 36,1% при папиллярной и 12,2% при фолликулярной карциноме и не зависит от размера опухоли. Частота внутриорганного метастазирования составляет соответственно 14,4% и 26,8%.
Выводы
- УЗИ метод исследования не может считаться высокоинформативным для диагностики контралатерального и регионального метастазирования при РЩЖ.
- Операция тиреоидэктомии должна являться приоритетной при выборе тактики оперативного вмешательства при гистологически верифицированном РЩЖ. т.к. не только исключает риск местного рецидивирования заболевания и обеспечивает минимальным риском осложнений, адекватное наблюдение за уровнем тиреоглобулина и антител к тиреоглобулину в крови пациента.
- Учитывая частоту микрокарцином при АИТ, возможную локализацию их вне ткани макроскопически определяемых узлов и большое количество мультифокальных и мультицентричных раков, следует сделать вывод, что при РЩЖ в сочетании с АИТ предпочтительна тиреоидэктомия с билатеральной центральной лимфаденэктомией. Выполнение этой операции позволит приблизить к 100% диагностику АИТ-ассоциированного высокодифференцированного рака.
Заключение. Таким образом, АИТ достаточно часто является фоновым заболеванием у лиц, подвергаемых оперативным вмешательствам на щитовидной железе по поводу ее узловой трансформации, причем в большинстве наших наблюдений имели место истинные узлы щитовдной железы на фоне АИТ. Злокачественный характер узла встретился у 15% оперированных больных, что почти в три раза выше, чем в популяции. Однако этот факт может объясняться тем, что перед госпитализацией нами проводился скрининг больных с узлами, направленный на выявление состояний, подозрительных на злокачественный характер процесса. Достаточно часто причиной операций у больных с АИТ являлась гипердиагностика при цитологическом исследовании. Это связано со значительными изменениями тиреоцитов у больных АИТ, поэтому для уменьшения ошибок в диагностике требуется комплекс диагностических мероприятий (ультразвуковое исследование, цитологическая диагностика, исследование крови на маркеры аутоиммунного поражения ткани щитовидной железы), причем исследование желательно производить в рамках специализированного отделения, где работают специалисты эндокринологи терапевтического и хирургического профиля. Экстрафасциальную тиреоидэктомию с центральной лимфодиссекцией необходимо осуществлять при обоснованном подозрении на рак ЩЖ.
АИТ - это взаимодействие генетической предрасположенности и факторов окружающей среды, которые в дальнейшем модифицируются под влиянием таких эндогенных факторов, как возраст и уровень секреции половых гормонов. Предполагается, что один из вероятных механизмов реализации наследственной предрасположенности может быть связан с влиянием эстрогенов на функцию Т-лимфоцитов. Заболевание обычно развивается в возрасте 25-40 лет, но наибольшее количество случаев у женщин старше 60 лет. Современные ультразвуковые и цитологические методы диагностики при РЩЖ не позволяют выявить внутриорганное и регионарное метастазирование в основной лимфатический коллектор - VI зону клетчатки шеи на дооперационном этапе. ТАБ позволяет быстро установить диагноз опухоли ЩЖ и определить объем планируемого оперативного вмешательства. Тем не менее, несмотря на кажущуюся простоту, ТАБ требует участия разных специалистов. Оптимальные клинические рекомендации по диагностике и лечению узловых образований ЩЖ должны оговаривать результаты ТАБ, клинического исследования. При размерах опухоли от 2 до 4 см и верифицированном РЩЖ, независимо от того были ли поражены лимфатический коллекторы VI зоны показан минимальный объем оперативного лечения - тиреоидэктомия с профилактической ЦЛА шеи. Это требует применения радикальной хирургической тактики с обязательным тотальным удалением ткани ЩЖ и центрального лимфатического коллектора шеи.
ЦЛА должна выполняться всем больным с РЩЖ независимо от распространенности первичной опухоли, т.к. в дальнейшем она обезопасит больных от появления возможного рецидива в этой области, поможет более точно стадировать РЩЖ по системе TNM, определять группу высокого риска с целью проведения радиойдтерапии и удалять пораженные лимфоузлы на доклиническом этапе. Большая частота микрокарцином служит прогностически благоприятным фактором, ведь почти всегда это рак I стадии, но с другой стороны, большая частота микрокарцином является причиной диагностических ошибок на всех уровнях диагностики. Это в свою очередь ведет к неадекватному хирургическому лечению, а высокодифференцированный рак, согласно теории опухолевой прогрессии, постепенно может приобретать черты агрессивной опухоли, вплоть до низкодифференцированного рака. Особенно прогностически неблагоприятны в таких случаях рецидивы после неадекватного хирургического лечения. Повторное же вмешательство на лимфоузлах центрального уровня связано с высоким риском повреждения возвратных гортанных нервов, околощитовидных желез, сосудов средостения и трахеи. Частота послеоперационного транзиторного гипопаратиреоза и пареза несколько выше у больных, перенесших лечебную ЦЛА, чем при профилактическом удалении клетчатки VI уровня. Мы считаем, что при гистологическом подтверждении РЩЖ при АИТ необходимо полное удаление ткани ЩЖ, так как при проведении гемитиреоидэктомии затруднено определение стадии онкопроцесса в ЩЖ. Было отмечено, что проведение тотальной тиреоидэктомии снижает риск местного рецидива. Кроме того, подобный объем операции позволяет при необходимости выполнить абляцию радиоактивным йодом.
