Рак пищевода и кардии занимают 5–6-е место в структуре онкологических заболеваний в мире, составляя 5–7 % от общего числа злокачественных опухолей. Основным клиническим симптомом рака пищевода и кардиального отдела желудка является дисфагия, возникающая при сужении просвета органа, по меньшей мере на 50%, что объясняет поздние проявления и плохой прогноз, связанный с раком пищевода. Обструкция пищевода может быть как внутренней, связанная с раком пищевода, так и внешней из-за компрессии пищевода извне раком легкого, лимфаденопатией и т.д. [1-3].
К сожалению, подавляющее большинство случаев рак пищевода диагностируется на более поздней стадии, когда злокачественный процесс распространяется в подслизистую оболочку и за ее пределы с вовлечением лимфатических узлов или отдаленных метастазов [4,5]. В большинстве случаев (> 50%) на момент постановки диагноза из-за наличия отдаленных метастазов невозможно выполнить радикальное хирургическое лечение.
Целью паллиативной терапии у пациентов с неоперабельным раком пищевода заключаются в уменьшении симптомов дисфагии, лечении осложнений, поддержании перорального питания, уменьшении боли, устранении рефлюкса и регургитации, предотвращении аспирации и, в конечном итоге, улучшении качества их жизни. Существуют различные эндоскопические вмешательства для восстановления перорального питания при дисфагиях такие, как реканализация суженного участка органа с использованием лекарственных препаратов, лазера или аргоноплазменная коагуляции, бужирование, которые обеспечивают лишь временное улучшение [6-9].
В настоящее время наиболее распространенным и лучшим методом восстановления питания и поддержания приема пищи является эндоскопическое стентирование участка сужения саморасправляющимися металлическими стентами [10-12]. Помимо паллиативного лечения инкурабельных онкологических больных самораспрвляющиеся металлические стенты используются при рецидиве рака пищевода или желудка со стенозом в зоне пищеводно-желудочного или пищеводно-кишечного анастомоз, при опухолевой компрессии пищевода (рак легкого и опухоли средостения), при раке пищевода, осложнившемся пищеводно-трахеальным или пищеводно-бронхиальным свищем, при послеоперационной несостоятельности пищеводно-желудочного или пищеводно-кишечного анастомоза, при острой ятрогенной перфорации стенки пищевода, при остром кровотечении из расширенных варикозных вен пищевода[13-16].
По мере накопления опыта использования металлических саморасправляющихся стентов в литературе стал обсуждаться вопрос о частоте и тяжести осложнений после их установки. Достаточно частыми осложнениями эндопротезирования являются кровотечения, миграция протезов, обструкция их просвета за счет продолжающегося роста опухоли, грануляций или плотными пищевыми массами, что требует повторных вмешательств. При этом в основном осложнения возникают в течение 1 года после вмешательства [17-21].
Таким образом, существует необходимость анализа частоты и характера осложнений после стентирования у больных с явлениями дисфагии злокачественного генеза.
Цель исследования – проанализировать частоту и характер осложнений при эндоскопическом стентировани металлическими саморасправляющимися пищеводными стентами больных с первичным опухолевым поражением пищевода, кардии и желудка.
Материалы и методы исследования. В исследование были включены 220 больных с первичным опухолевым поражением пищевода, кардии и желудка, которым в период с 2012 года по 2018 год проводилось эндоскопическое стентирование металлическими саморасправляющимися пищеводными стентами в отделении эндоскопии Национального центра онкологии МЗ АР. Данная группа пациентов включала в себя 136 мужчины и 84 женщин. Средний возраст исследуемых больных составил 62,2±5,6 года.
Перед выполнением эндоскопического исследования всем больным для определения протяженности, характеристики и степени сужения проводилась рентгеноскопия пищевода с бариевой взвесью или водорастворимым контрастным веществом. Также проводилось исследование обязательных параметров крови и мочи, УЗИ органов брюшной полости, а также КТ органов брюшной и грудной полостей. Диагноз злокачественного новообразования был подтвержден во всех наблюдениях при гистологическом исследовании.
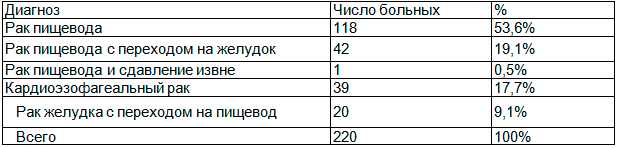
У большинства обследованных больных был диагностирован рак пищевода (118 больных-53,6%). У 42 (19,1%) больных наблюдался рак пищевода с переходом на желудок, а у 1 (0,5%) больного рак пищевода и сдавление его извне. В исследование также вошли 39 (17,7%) больных с диагнозом кардиэзофагальный рак и 20 (9,1%) больных с раком желудка с переходом на пищевод. Большей части больных злокачественный процесс был диагностирован на III или IV стадии развития. Только у 14 (6,4%) больных злокачественный процесс был выявлен на I или II стадии, но такие сопутствующие патологии как хроническая обструктивная болезнь легких, ишемическая болезнь сердца, последствия острого нарушения мозгового кровообращения явились противопоказанием для выполнения радикального вмешательства (таб.1).
Таблица 1. Распределение больных в зависимости от причины дисфагии
В 60% случаев опухоль характеризовалась преимущественно экзофитным характером роста, у 17,3% - инфильтративным, а у 22,7% пациентов поражение имело смешанную форму роста. У 174 (79,1%) пациентов опухолевое поражение было циркулярным, у 38 (17,3%) занимало более половины окружности пищевода, и лишь в 8 (3,6%) наблюдениях опухоль локализовалась преимущественно по одной стенке.
При установлении границ поражения рака пищевода было выявлено, что у 19 больных верхняя граница поражения была на уровне верхней трети пищевода, у 105 больных - средней трети, а у 37 больных нижней трети. В 15,9% случаях протяженность опухолевого поражения варьировала от 2 см до 6 см, у 58,2% больных от 7 см до 11 см, а у 25,9% больных размер опухоли составлял 12 см и больше. Максимальный размер опухолевого поражения составил 19 см, который наблюдался у 4-х больных.
У 39 больных с диагнозом кардиэзофагальный рак в злокачественный процесс были вовлечены зоны пищевода выше кардии (до 2 см) и субкардиальный отдел желудка (до 5 см). В 82% случаев протяженность процесса составила от 3 до 6 см соответственно.
У 6 больных с раком желудка с поражением кардиоэзофагеальной зоны нижняя граница опухоли находилась в антральном отделе желудка, у 8 - в нижней трети тела желудка, а у 6 больных в средней трети тела желудка.
При анализе морфологической картины строения опухолей пищевода, кардии и желудка с обязательным вовлечением кардиоэзофагеальной зоны плоскоклеточный рак наблюдался у 146 (66,4%) больных, низко дифференцированная аденокарцинома – у 33 (15%) больных, умеренно дифференцированная аденокарцинома – у 18 (8,2%) больных, высоко дифференцированная аденокарцинома – у 9 (4,1%) больных, перстневидноклеточный рак – у 14 (6,3%) больных.
Также у 9 больных с раком пищевода были выявлены патологические соустья между пищеводом и соседними органами. Из них у 5 пациентов были выявлены пищеводно-бронхиальные свищи в средней трети пищевода, а у 3 больных - в нижней трети пищевода. Ещё у 1 пациента в верхней трети пищевода был выявлен пищеводно-трахеальный свищ.
После подтверждения диагноза происходил подбор необходимого стента по имеющимся данным о протяженности опухоли и степени сужения просвета пищевода. В нашей клинике для эндоскопического стентирования пищевода используются стерты фирмы «M.I.Tech» (Seoul, Korea), общепризнанныев клинической практике мирового эндоскопического сообщества. Отличительными особенностями такого рода стентов являются наличие покрытия, которое устраняет возможность диффузного прорастания стента, также в структуре стента имеются рентгенконтрастные метки для удобства контроля. Установка производилась короткими эндоскопическими системами доставки малого диаметра. Вмешательства выполнялись под эндоскопическим или же смешанным (эндоскопически-рентгенологическим) контролем. В 95% случаев вмешательство выполнялось только под эндоскопическим контролем. Это позволило исключить лучевую нагрузку на пациента и врача, выполняющего вмешательство, давала возможность коррекции положения стента при смещении или же при его неполном раскрытии. Cтентирования под рентгенологическим контролем проводилось в случаях расположения верхнего полюса опухоли на 3-4 см ниже глоточно-пищеводного перехода.
Для установки стента минимальный диаметр просвета пищевода должен был составлять 8-10 мм. При сужении просвета пищевода меньше 8 мм стентирование проводилось с помощью педиатрических эндоскопов диаметром 5 мм. Это позволяло нам проводить стентирование только под эндоскопическим контролем, а также избегать механических травм, которые часто наблюдаются при бужировании. Если необходимого просвета не было, то производили бужирование суженного участка, что позволяло нам провести эндоскоп через участок сужения, оценить его протяженность и выбрать стент необходимой длины. В нашем исследовании перед имплантацией стента 90 (40,1 %) пациентам было проведено инструментальное расширение суженного участка пищевода с использованием бужей с диаметром 8-10 мм.
В течение 1–2 суток от момента установки происходило раскрытие стента, которое контролировалось при рентгеноскопии пищевода и желудка с водорастворимым контрастным веществом. Все пациенты под наблюдение онколога по месту жительства с рекомендациями по питанию и указанием на повторное обращение в стационар при возникновении рецидива дисфагии.
Результаты и обсуждения. При эндоскопическом стентировании пищевода могут возникнуть осложнения как при установке стента, так и после стентирования. В нашем исследовании осложнения во время установки стента наблюдалось у 20 (9%) больных. Так у 3 (1,4%) пациентов с раком средней трети пищевода во время стентирование наблюдалась перфорация пищевода и данным больным были установлены покрытые стенты. У 8 (3,6%) больных наблюдалась дислокация стента и во всех случаях коррекция положения стента проводилась путем подтягивания за петлю по верхнему краю. Также у 9 (4,1%) больных во время стентирования при раскрытии или же бужировании участка стеноза наблюдалось кровотечение с опухолевой поверхности. Кровотечение купировалось гемостатической терапией, а 2 больным параллельно была выполнена аргоноплазменная коагуляция кровоточащей зоны.
Осложнения, развившиеся в сроки до 10 суток после выполнения стентирования саморасправляющимися эндопротезами, мы считали ранними. В группе исследуемых больных ранние осложнения наблюдались в 32 (14,5%) случаях. В нашем исследовании, наиболее частым ранним осложнением была дислокация стента вниз на 2-6 см, как в пределах границ опухоли, так и за пределами границ опухоли. Вышеуказанные осложнения наблюдалось у 19 ( 8,6%) больных в сроки от 1 до 3 суток от первого вмешательства (у 3-х больных стент сместился дважды). Во всех случаях стент был установлен в нужную позицию подтягиванием за нить. У 7 (3,2%) больных с раком кардиального отдела желудка с переходом на пищевод и у 6 (2,7%) больных раком желудка с переходом на пищевод наблюдалась полная миграция стента. Во всех случаях стент был удален из полости желудка после предварительного расширения просвета пищевода, с последующим рестентированием (таблица 2).
Таблица 2. Частота и характер осложнений
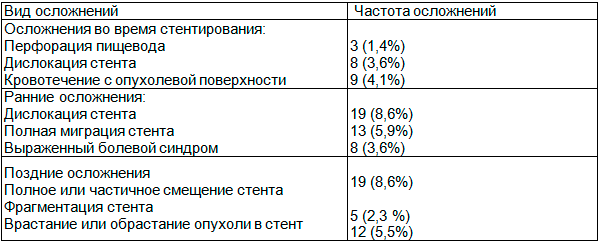
В течение первых 3–4 суток с момента установки практически у всех больных наблюдался болевой синдром разной интенсивности, который в дальнейшем был купирован. В 8 (3,6%) случаях при установке стента в зону глоточно-пищеводного перехода отмечен выраженный болевой синдром и чувство инородного тела. Этим больным, в течении 5-7 дней назначались сильные болеутоляющие средства.
Таким образом, в нашем исследовании в раннем периоде после стентирования у ряда больных возникли осложнения, в виде дислокации, полной миграции стента или же болевого синдрома. Поэтому, по нашему мнению, в раннем периоде после стентирования пациенты нуждаются в тщательном наблюдении, рентгенологическом контроле положения и степени расправления стента на следующие сутки, а при неполном раскрытии - дольше.
Осложнения, диагностированные в сроки после 2-х недель до 1 года считались поздними. В нашем исследовании они наблюдались в 36 (16,4%) случаях: от 2 нед. до 1 мес. - у 7 (3,2%) пациентов, от 1 до 3 мес. - у 10 (4,5%) пациентов, от 3 до 6 мес. - у 9 (4,1%) пациентов, от 6 до 9 мес. - у 5 (2,3%), от 9 до 12 мес. - у 5 (2,3%) пациентов.
Наиболее серьезными и часто встречающимися осложнениями при стентировании пищевода считаются разрушение и миграция стентов. В большинстве случаев точные сроки возникновения этих осложнений было достаточно трудно оценить. Основным клиническим проявлением, послужившим причиной повторного обращения в клинику, был рецидив дисфагии. Также пациенты жаловались на примесь крови в слюне, на усилившееся чувство инородного тела в пищеводе, слюнотечение и т.д.
Полное или частичное смещение стента ниже участка сужения было у 19 (8,6%) пациентов. В 15 (6,8%) случаях дислокация носила частичный характер и была устранена подтягиванием стента. У одного (0,5%) пациента с опухолью кардиального отдела желудка с переходом на пищевод через 1 месяц после стентирования установленный стент мигрировал в желудок. В данном случае нам потребовалось провести бужирование суженного участка пищевода с последующим удалением стента из желудка. Извлеченный стент был заново размещен в доставочного устройства, а затем обратно установлен в суженный участок. В последующем у данного больного никаких осложнений не наблюдалось.
В нашем исследовании в сроки от 2 до 9 мес. у 5 (2,3 %) больных наблюдалось фрагментация стентов после его установки. При этом переломы и миграция фрагментов стента возникли у 2 (1,2 %) больных раком кардиального отдела желудка с переходом на пищевод, через 10 и 12 месяцев после стентирования. В одном случае дистальный фрагмент мигрировал в желудок, в другом – в культю желудка. При фрагментации стентов с нарушением целостности покрытия во всех случаях проводилось рестентирование по механизму «стент-в-стент».
К поздним осложнениям после стентирования относится врастание или обрастание опухоли в просвет стента, которая является следствием прогрессирования основного заболевания. В нашем исследовании данное осложнение наблюдалось в 12 (5,5%) случаях. Во всех выполнялось стентирование по типу «стент-в-стент». 6 больным данная манипуляция была выполнена дважды.
У большинства больных затруднений при приеме пищи не было, если они придерживались рекомендаций по питанию, полученных ими после выполнения вмешательства. Они подразумевали исключение из пищевого рациона грубоволокнистого мяса, свежего хлеба, клейкого риса, бобовых, фруктов и овощей с большим количеством клетчатки и т.д. После приема пищи мы рекомендовали больным выпить несколько глотков теплой воды или чая, чтобы смыть остатки пищи со стенок стента. С целью профилактики обструкции стента остатками пищи мы также рекомендовали всем больным после приема пищи напиток Соса-соla.
Следует отметить, что у пациентов в разной интенсивности наблюдались такие жалобы, как ощущение инородного тела и прохождения пищевого комка по пищеводу, избыточная саливация, изжога, отрыжка. Некоторые больные жаловались на периодическую или постоянную тошноту, периодическую или постоянную рвоту или рвотные позывы перед приемом пищи, хотя эти симптомы могли быть проявлением и опухолевой интоксикации. В подавляющем большинстве эти жалобы не были связаны со стентированием, а отражали клиническую картину опухолевой прогрессии.
Таким образом, стентирование пищевода саморасширяющимися металлическими стентами является наиболее эффективным методом восстановления проходимости пищевода при злокачественном сужении у неоперабельных пациентов с раком пищевода. В разные сроки после стентирования могут наблюдаться ранние и поздние осложнения, ряд которых (дислокация, фрагментация, врастание) являются специфическими при применении металлических саморасправляющихся стентов, что требует наблюдения за пациентами в течение всего периода жизни.
