Введение. Перфторорганические соединения (ПФОС) являются важным инструментом в витреоретинальной хирургии, поскольку обладают уникальными физико-химическими свойствами [16]. Вопросы их влияния на сетчатку до сих пор не имеют однозначных ответов, а полученные результаты экспериментальных исследований не дают полного представления о сроках возможной безопасной тампонады ПФОС полости стекловидного тела.
Одним из методов экспериментальной оценки влияния ПФОС на сетчатку является электроретинография (ЭРГ) - объективный метод, основанный на регистрации биопотенциалов, возникающих при световом раздражении [2]. ЭРГ позволяет обнаружить функциональные изменения слоев сетчатки на ранних стадиях заболевания или патологического воздействия [20].
Исходя из имеющихся в литературе данных, прослеживается общая тенденция, что тампонада ПФОС полости стекловидного тела в экспериментальных исследованиях от нескольких часов до двух суток (3-48 ч) на основании ЭРГ и морфологических методик исследования является полностью безопасной. C увеличением срока тампонады (от 1 недели и более) повышается вероятность электроретинографических и морфологических изменений сетчатки глаз экспериментальных животных [5, 17-19]. В то же время, начиная с 90-х гг. появляются работы, в которых указаны более длительные сроки безопасного пребывания (до 3-х месяцев) тех же видов ПФОС в полости стекловидного тела [6, 9, 10, 15, 21]. Некоторые авторы связывают это с повышением качества очистки имеющихся ПФОС [3].
Научно-медицинская ассоциация «Оптимедсервис» совместно с кафедрой офтальмологии с курсом ИДПО Башкирского государственного медицинского университета (г. Уфа) разработали ПФОС на основе отечественной субстанции - перфтор-1,3-диметилциклогексана. Ранее проведенные нами морфологические исследования показали относительную безопасность перфтор-1,3-диметилциклогексана в срок тампонады 14 дней, что было сопоставимо с перфтордекалином. В связи с необходимостью точной и исчерпывающей экспериментальной оценки, актуально изучение и анализ изменений показателей ЭРГ сетчатки кроликов после витрэктомии с тампонадой ПФОС.
Цель - изучить и проанализировать изменения электрической активности сетчатки кроликов при различных сроках тампонады полости стекловидного тела ПФОС.
Материал и методы. Исследование проведено на 12 глазах 6 кроликов породы Шиншилла весом 2,5-3,5 кг. Эксперименты проводили с соблюдением общепринятых принципов гуманности и существующих международных нормативных документов и инструкций МЗ РФ и РАМН по работе с лабораторными животными.
Для премедикации (за 20 минут до операции) использовался 0,1 мл 0,1% раствора атропина сульфата подкожно. За 30 минут до операции вводили внутримышечно раствор ксилазина гидрохлорида из расчета 1-2 мг на кг веса животного. Непосредственно перед операцией вводили основной препарат для наркоза - «Золетил 100», из расчета 15 мг на 1 кг веса.
Для панорамной визуализации использовали систему, состоящую из контактной линзы 130 дптр и инвертора. Витрэктомия была проведена на офтальмохирургической системе «Оптимед Профи» с использованием инструментов калибра 25G и частотой резов 6000 в мин. На правом глазу (левый был контрольным) транссклерально через плоскую часть цилиарного тела на меридианах 2, 10 и 12 часов устанавливали порты для инструментов, выполняли витрэктомию с максимально полным удалением стекловидного тела. В витреальную полость правого глаза вводили 2,5 мл соответствующего ПФОС: первой группе (n=3) - ПФОС на основе перфтор-1,3-диметилциклогексана («Оптимед», Россия); второй группе (n=3) - ПФОС на основе перфтордекалина («Dk-line», США). Каждое ПФОС вводили единым пузырем, следили за равномерным распределением внутри витреальной полости и по поверхности сетчатки и оставляли в качестве тампонирующего вещества. Интраоперационных осложнений не было. По окончании операции на область портов накладывали швы, субконъюнктивально вводили 0,1 мл раствора ванкомицина и 0,3 мл бетаметазона. Послеоперационный период у всех животных протекал без осложнений. В конъюнктивальную полость в течение 5 дней инстиллировали глазные антибактериальные и НПВС-препараты (0,5% моксифлоксацин и 0,1% индометацин).
Оценку функционального состояния нейрорецепторных элементов сетчатки кроликов исследовали путем регистрации ЭРГ до операции в интактном состоянии и через 5, 14 и 30 дней после операции. ЭРГ регистрировали портативной электрофизиологической установкой «Нейро-ЭРГ» (ООО «Нейрософт», г. Иваново, Россия). В качестве активного электрода использовали ретинографический электрод «крючок», закрепляя его за нижнее веко. Референтный и заземляющий электроды находились на ушах кролика (рис. 1). Место положения активного референтного и заземляющего электродов сохранялось без изменений в ходе всего эксперимента.
Рис. 1. Положение электродов у кролика в исследовании.
Для максимальной унификации условий записи ЭРГ перед ее регистрацией вызывали медикаментозный мидриаз двухкратной (с интервалом 5 мин) инстилляцией 1% тропикамида. С целью седации за 10 минут до регистрации внутримышечно вводили раствор ксилазина гидрохлорида из расчета 1-2 мг на кг веса животного. Сопротивление под электродами не превышало 5 кОм. Световую стимуляцию проводили в условиях темновой адаптации с использованием мини-ганцфельд сферы, позволяющей получить равномерный засвет сетчатки. Частота стимуляций 0,5 Гц, полоса пропускания усилителя 2-200 Гц. Проводили 3 последовательные регистрации на каждом глазу для проверки стабильности регистрируемого ответа. При анализе использовали усредненную запись ЭРГ. Условия стимуляций и форма кривой соответствовали смешанному палочко-колбочковому ответу сетчатки и стандарту ISCEV 2015 [12].
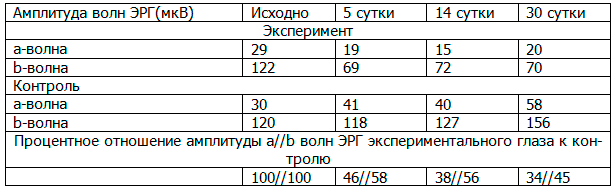
Результаты и обсуждение. Усредненные показатели амплитуды a- и b-волн ЭРГ обеих групп в различные сроки эксперимента представлены в таблице 1. Учитывали как абсолютные величины амплитуды компонентов ЭРГ, так и их процентное отношение к амплитуде парного (контрольного) глаза.
Таблица 1. Усредненные амплитудно-временные показатели компонентов ЭРГ в различные сроки эксперимента
Форма кривых ЭРГ (рис. 2-3), их амплитудно-временные характеристики в исходном (до операции) состоянии свидетельствуют об удовлетворительном функциональном состоянии сетчатки исследованных экспериментальных животных и соответствуют смешанному палочко-колбочковому ответу.
После оперативного вмешательства произошло снижение амплитуды как a-, так и b-волн ЭРГ (табл. 1, рис. 4-9), причем угнетение возникло уже на 5 сутки после экспериментального вмешательства, не зависело от типа ПФОС и оставались стабильно сниженным в ходе всего эксперимента. Изменения электрической активности сетчатки в группах животных с различным типом ПФОС имели сходный характер, что позволило оценивать динамику электрофизиологических параметров суммарно.
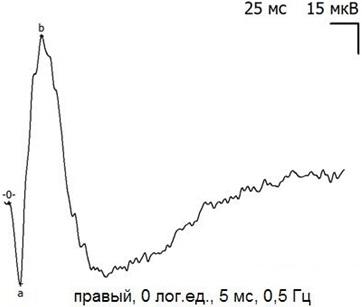
Рис. 2. Пример записи ЭРГ правого (экспериментального) глаза кролика до начала эксперимента.
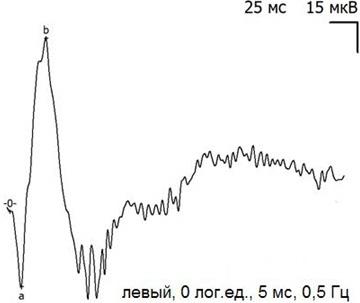
Рис. 3. Пример записи ЭРГ левого (контрольного) глаза кролика до начала эксперимента.
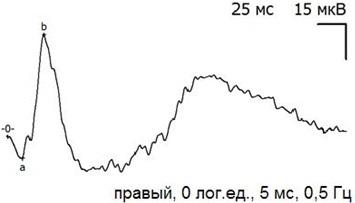
Рис. 4. Пример записи ЭРГ экспериментального (правого) глаза через 5 дней после экспериментальной операции и тампонады ПФОС.
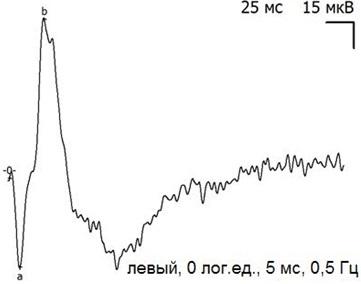
Рис. 5. Пример записи ЭРГ контрольного (левого) глаза через 5 дней после экспериментальной операции и тампонады ПФОС.
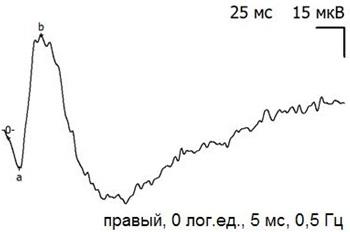
Рис. 6. Пример записи ЭРГ экспериментального (правого) глаза через 14 дней после экспериментальной операции и тампонады ПФОС.
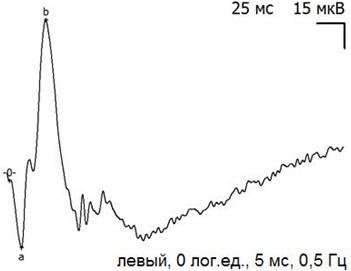
Рис. 7. Пример записи ЭРГ контрольного (левого) глаза через 14 дней после экспериментальной операции и тампонады ПФОС.
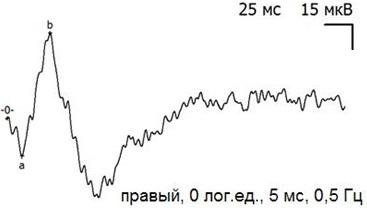
Рис. 8. Пример записи ЭРГ экспериментального (правого) глаза через 30 дней после экспериментальной операции и тампонады ПФОС.
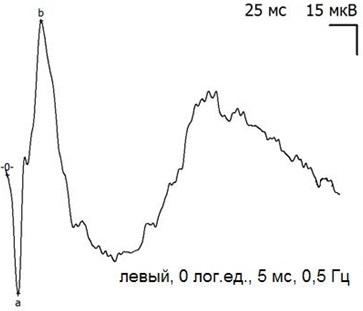
Рис. 9. Пример записи ЭРГ контрольного (левого) глаза через 30 дней после экспериментальной операции и тампонады ПФОС.
Наши гистологические исследования сетчатки кроликов на 5-сутки после интравитреальной тампонады перфторорганическими соединениями выявили начальные признаки гидропической дистрофии во внутреннем ядерном слое. Примечательно, что в наружных ретинальных слоях признаки дистрофии не обнаруживались. Это позволяет полагать, что рассмотренное выше согласованное снижение амплитуд a- и b-волн ЭРГ не определяется очагами гидропической дистрофии во внутреннем ядерном слое сетчатки.
Мы полагаем, что снижение амплитуды основных компонентов ЭРГ кроликов в ходе нашего эксперимента не связано с повреждением нейрорецепторных и глиальных элементов сетчатки, а определяется самой процедурой витрэктомии. В пользу этого предположения свидетельствует то, что морфологические изменения сетчатки в ходе всего эксперимента нарастали: увеличивался объем нарушений в различных слоях сетчатки, изменялась нормальная морфология ее различных слоев. Но вместе с тем, параметры ЭРГ оставались стабильными в течение всего срока наблюдения после первоначального снижения на 5-е сутки после вмешательства, что не согласуется с морфологической картиной. Кроме того, обнаруженные морфологические изменения затрагивали преимущественно внутренние слои сетчатки, а изменения ЭРГ затрагивали как а-, так и b-волну.
Исходя из вышесказанного, предполагается возможное изменение кровоснабжения глаза после витрэктомии, которое выражается в снижении кровотока заднего сегмента и усилении кровотока переднего сегмента глаза. При этом снижение кровоснабжения затрагивает не только внутренние слои сетчатки, но и хориоидальный кровоток [1]. Изменения, наблюдаемые нами в ходе эксперимента, могут определяться перераспределением именно в хориоидальном кровотоке, т.к. изменяется амплитуда a- и b-волн ЭРГ, что указывает на временное снижение активности элементов наружных и внутренних отделов сетчатки (биполярных клеток, клеток Мюллера и фоторецепторов). Такую гипотезу косвенно подтверждает отсутствие необратимых морфологических изменений сетчатки во все сроки эксперимента. Литературные данные других экспериментальных (а также некоторых клинических) исследований, подтверждают транзиторное снижение амплитудa- и b-волн после витрэктомии с интравитреальной тампонадой, с последующим их восстановлением [4, 7, 11, 13].
Другими факторами, по данным литературы, приводящими к временному снижению а- и b-волны, могут быть: температура и состав вводимых веществ, вид и уровень наркоза, повышенное или пониженное ВГД [14]. Стоит отметить, что определенный вклад в транзиторное снижение амплитуды волн может вносить и электрическая задержка сигнала, т.к. известно, что ПФОС являются сильными диэлектриками [8, 18].
Однако стоит учесть, что более длительный срок тампонады ПФОС все же может привести к необратимым последствиям, т.к. в проведенном морфологическом исследовании было отмечено прогрессирование гидропической дистрофии (и вовлечение наружных слоев сетчатки) к 30 суткам.
Заключение. Снижение амплитуд a- и b-волн происходило на 5 сутки после витрэктомии с тампонадой полости стекловидного тела ПФОС, независимо от типа ПФОС и оставалось стабильным в течение всего времени эксперимента. Предполагается, что снижение амплитуд волн ЭРГ не связано с прямым токсическим действием на сетчатку кроликов в исследуемые сроки, а определено, в первую очередь, изменением электрического контура в результате самой операции и, возможно, другими, более рутинными причинами.
