Актуальность темы. Реабилитация и обеспечение адекватного качества жизни больных, перенесших хирургические вмешательства по поводу стенозов гортани и трахеи опухолевого и посттравматического генеза, представляют собой актуальную и во многом нерешенную проблему.
Отмеченный в последние годы прогресс в хирургическом лечении посттравматических и опухолевых стенозов гортани и трахеи, достигнут внедрением органосохраняющих реконструктивно-пластических вмешательств на полых органах шеи. Оперативные вмешательства на гортани и трахее заключаются в устранении патологического процесса и восстановлении проходимости деформации дыхательных путей с формированием стойкой трахеостомы и последующей дилатацией сформированного просвета различными стентами. Формирование функционально стойкой трахеостомы у больных, дыхание которых длительно не может осуществляться через естественные пути, в значительной степени предотвращает возникновение тяжелой воспалительной патологии дыхательной системы, и, следовательно, является действенной профилактикой развития бронхо-легочных осложнений у трахеостомированных больных.
Особое место в этой проблеме занимают вопросы пластического закрытия стойких трахеостом или дефектов трахеи на завершающем этапе хирургической реабилитации данного контингента больных [8, 9]. По мнению некоторых авторов, следует применять опорные имплантаты при ширине стомы более 1 см и длине свыше 2-2,5 см [2, 7, 8]. Основная цель каркасных материалов заключается в противодействии разрывным нагрузкам, возникающим во время кашля и форсированном дыхании, препятствии западению вновь образованной передней гортанно-трахеальной стенки и сужению респираторного тракта во время вдоха.
В настоящее время существующие способы определения размеров и площади различных биологических объектов имеют ограниченную область применения, обладают большой трудоемкостью, времязатратностью и недостаточной точностью [1,3,4,6]. Так как в большинстве случаев трахеостома или дефект трахеи имеют вид отверстия с несимметричными контурами, все вышесказанное относится и к методу определения размера площади трахеостом у данной категории больных.
Очевидно, что существует потребность в таком способе, который позволял выполнять прецизионные измерения площади трахеостом любой конфигурации и исключал бы недостатки, связанные с применением известных способов.
Цель исследования. Повышение точности и эффективности измерения площади зияющих дефектов трахеи у больных хроническими опухолевыми и посттравматическими стенозами гортани и трахеи на заключительном этапе хирургической реабилитации.
Материалы и методы. Поставленная задача достигается новым способом измерения зияющих дефектов трахеи (заявка на изобретение №2011133466 (049458) приоритет от 09.08.2011). После туалета зияющего дефекта трахеи, пациенту придают сидячее положение со слегка отведенной назад головой. Около края дефекта накладывают специальную метку, которая представляет собой самоклеящуюся бумагу с нанесенными на нее двумя черными точками, расстояние между которыми составляет 10 мм. С помощью цифровой фотокамеры получают полноцветное изображение дефекта в условиях естественного освещения, режима макросъемки и фокусного расстояния 45-50 см.
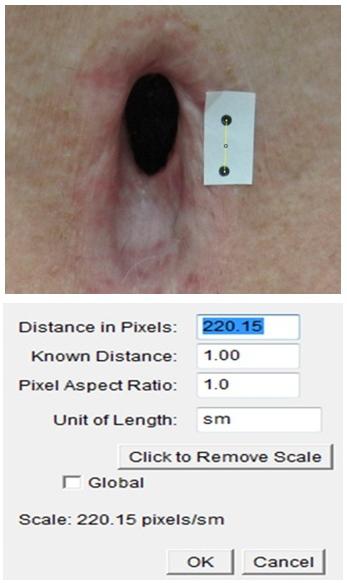
Полученное изображение анализируется на персональном компьютере с помощью морфометрического программного обеспечения. Для решения задач морфометрии используется программа «AreaMeter.Tracheostomy», созданная на основе программного движка ImageJ, которая позволяет производить прецизионные измерения на имеющемся изображении [5]. Принцип расчета основан на получении эталонного расстояния, которое дают точки. Поскольку расстояние между ними известно, это позволяет рассчитывать различные параметры зияющего дефекта трахеи в реальных единицах измерения. Для этого производится установка масштаба (соотнесение реального размера в сантиметрах с количеством пикселей изображения) на основе метки, находящейся на изучаемом изображении (рис. 1).
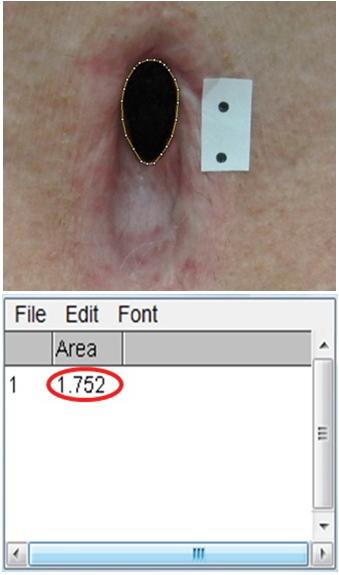
Далее с помощью инструмента выделения обводят контур дефекта и рассчитывают площадь выделенного объекта в квадратных сантиметрах (рис. 2). При этом мы можем измерять зияющие дефекты трахеи сложной конфигурации с высокой точностью до сотых значений.
 |
 |
|
| Рис. 1. Установка масштаба на изучаемом изображении. |
|
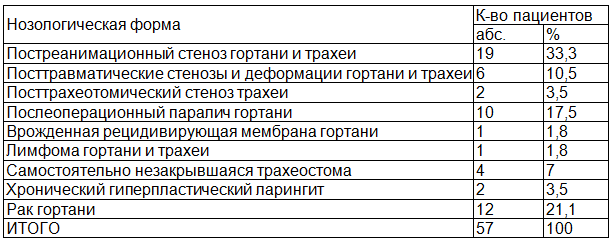
Эффективность предлагаемого способа подтверждена в клинике Томского филиала ФГБУ «Научно-клинический центр оториноларингологии ФМБА России» и в отделении опухолей головы и шеи ФГБУ НИИ онкологии СО РАМН у 57 больных хроническими стенозами гортани и трахеи посттравматического и опухолевого генеза перед пластическим закрытием бесканюльной трахеостомы или дефекта трахеи на заключительном этапе хирургической реабилитации. Из них 23 мужчины и 34 женщины в возрасте от 20 до 78 лет. Наиболее часто встречаемый возрастной диапазон исследуемых пациентов отмечен в трудоспособном возрасте — от 20 до 55 лет (65%). Распределение больных по нозологическим формам представлено в табл. 1.
Таблица 1. Распределение больных по нозологическим формам
Больным хроническими стенозами неопухолевого генеза выполнялись этапные реконструктивно-восстановительные оперативные вмешательства на гортани и трахее с устранением патологического процесса, формированием трахео- или ларинготрахеостомы и последующей дилатацией сформированного просвета респираторного тракта на Т-образном силиконовом протезе.
Больные местнораспространенным раком гортани (n=12), перенесшие органосохраняющие комбинированные хирургические вмешательства по морфологической характеристике представлены плоскоклеточным вариантом опухоли различной степени дифференцировки. Стадийность опухолей по международной классификации TNM соответствовала стадиям T3-4N0-1M0. (табл. 2).
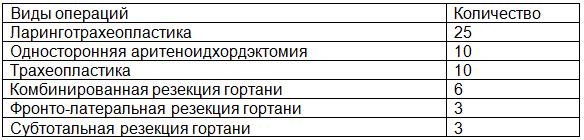
Объем хирургического вмешательства на гортани и трахее зависел от локализации и распространенности основного процесса (табл. 3).
Таблица 2. Распределение больных раком гортани в зависимости от стадии процесса

Таблица 3. Методики хирургических вмешательств
Сроки существования трахеостомы составили от 3 до 24 месяцев и определялись этиологией патологического процесса, объемом хирургического вмешательства по устранению стенозированного участка респираторного тракта, стиханием хронического воспаления и созреванием рубцовой ткани.
Результаты. В зависимости от размера бесканюльной трахеостомы пациенты были разделены на 2 группы. В первую группу вошли больные с площадью трахеостомы более 2 кв.см. (19 человек), у которых пластическое закрытие трахеостомы выполнено с применением опорных биоадаптивных имплантатов на основе никелида титана. Средняя площадь бесканюльной трахеостомы составила 2,63±0,68 кв.см. Во вторую группу вошли больные с площадью трахеостомы менее 2 кв.см. (38 человек), которым пластическое закрытие трахеостомы выполнено на основе метода Я.С. Бокштейна. Метод предусматривает послойное закрытие гортанно-трахеальных дефектов граничащими с ними собственными тканями. Средняя площадь трахеального дефекта составила 1,21±0,4 кв.см. (рис. 3 а,б).
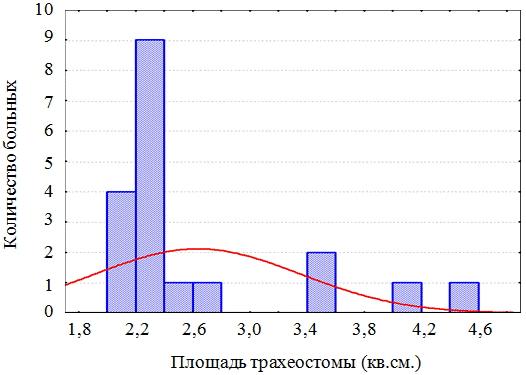
Рис. 3а. Распределение больных первой группы в зависимости от площади трахеостомы.
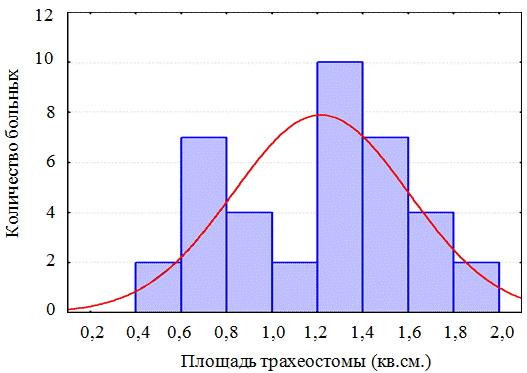
Рис. 3б. Распределение больных второй группы в зависимости от площади трахеостомы.
Все пациенты реабилитированы. Период наблюдения больных составил от 1 месяца до 2 лет, контрольные осмотры проводились через 1, 3, 6 и 12 месяцев после хирургического вмешательства. В отдаленном послеоперационном периоде отторжения или резорбции имплантата отмечено не было, реакций местных тканей на имплантацию не отмечалось. Дыхание через естественные дыхательные пути свободное, адекватное при физической нагрузке. По данным фиброэндоскопического контроля просвет респираторного тракта достаточный для свободного дыхания. Флотирования вновь образованной передней гортанно-трахеальной стенки и сужения респираторного тракта при дыхании не отмечалось. При исследовании функции внешнего дыхания по данным спирографии показатели соответствовали условной норме. Различия спирографических «кривых» после пластики бесканюльной трахеостомы в группах незначительные.
Следующий клинический пример демонстрирует эффективность предлагаемого способа.
Больная Н. 54 лет, история болезни №224, с 22.03.2011 по 30.03.2011 находилась на лечении в Томском филиале ФГБУ «Научно-клинический центр оториноларингологии ФМБА России» с диагнозом: Посттрахеотомический рубцовый стеноз трахеи. Бесканюльная трахеостома. 17.08.2010 выполнена операция трахеопластика – восстановлен просвет рубцово-измененного дыхательного тракта, оформлена стойкая бесканюльная трахеостома, в просвет трахеи установлен Т-образный силиконовый протез для стентирования сформированного просвета. После стентирования и формирования эпителизированного просвета дыхательных путей, достаточного для свободного дыхания, решался вопрос о пластическом закрытии бесканюльной трахеостомы. Для выбора метода хирургического вмешательства измерялась ее площадь предложенным способом. Полученный результат составил 2,56 см2. Учитывая значительную площадь трахеостомы, для восстановления каркасности передней стенки трахеи было решено применить имплантат из биоадаптивного никелида титана. 23.03.2011 выполнено пластическое закрытие трахеостомы с применением опорного имплантата. В послеоперационном периоде западения вновь образованной передней трахеальной стенки и сужения респираторного тракта во время дыхания не отмечалось. Больная выписана в удовлетворительном состоянии.
Заключение. При выборе метода пластического закрытия бесканюльных трахеостом и дефектов трахеи, необходимо учитывать площадь зияющего дефекта. Пластику обширных дефектов необходимо дополнять применением опорных имплантационных материалов.
Нами разработан способ измерения площади зияющих дефектов трахеи, заключающийся в анализе полноцветного изображения зияющего дефекта трахеи с нанесенной около его края меткой, с двумя черными точками на ней, расстояние между которыми составляет 10 мм, полученного посредством цифровой фотокамеры в условиях естественного освещения, режима макросъемки и фокусного расстояния 45-50 см, на персональном компьютере с использованием морфометрического программного обеспечения. Способ прост, не имеет противопоказаний, обеспечивает высокую точность и эффективность измерения площади зияющих дефектов трахеи любой конфигурации.
