Введение. В настоящее время многие отечественные и международные источники информации констатируют прогрессивный рост распространённости заболеваний носа и околоносовых пазух. Воспаление верхнечелюстной пазухи является одной из самых распространенных ЛОР-патологий, как на территории России, так и за ее пределами.
Так, в России пациенты с гайморитом составляют 20-30% среди всех госпитализированных в ЛОР-отделения. Еще более значительный удельный вес (до 40%) занимает синусит среди амбулаторных пациентов ЛОР-кабинетов больниц и поликлиник [1,2,3,4,5,6].
В последние годы в литературе активно обсуждается иммунопатогенез данного заболевания и, в частности, роль про- и противовоспалительных цитокинов, несостоятельности факторов местной защиты в очаге воспаления.
В доступной нам литературе существует большое число исследований, определяющих уровень различных групп цитокинов в сыворотке крови, что, вероятно, не может дать полной картины, так как большинство цитокинов являются биологически активными веществами локального действия.
Цель работы. Определить уровень про- и противоспалительных цитокинов и аутоантител классов IgG (иммуноглобулин G) и sIgA (секреторный иммуноглобулин А) к ним в сыворотке крови и назальном секрете больных ХГРС (хроническим гнойным риносинуситом).
Материалы и методы. Под нашим наблюдением находилось 30 пациентов в возрасте от 16 до 45 лет, проходивших лечение в стационарах г. Читы. Контрольную группу составили 10 практически здоровых добровольцев.
У здоровых и больных ХГРС после установки диагноза производили забор крови и носового секрета. Для получения смывов из полости носа пациенту в каждый общий носовой ход на 10 минут вводили сухие ватные тампоны, которые после извлечения переносили в пробирку, содержащую 1 мл 0,9% раствора натрия хлорида. Через 30 мин тампоны тщательно отжимали, и полученный смыв использовали для определения цитокинов [7].
Концентрацию цитокинов в сыворотке крови назальном секрете определяли методом иммуноферментного анализа (ИФА), реактивы фирмы «Вектор-Бест», Новосибирск.
Уровень аутоантител (ААТ) к цитокинам определяли оригинальным способом: лунки полистероловых планшетов сенсибилизировали антигенами: IL-1β (интерлейкин 1β); IL-2; IL-6; IL-8; IL-10; IF-α(интерферон-α) (реактивы фирмы «Вектор-Бест», Новосибирск) в количестве 20 мкг в объеме 200 мкл забуференного физиологического раствора (рН 7,4).
После этого лунки планшетов трижды отмывали дистиллированной водой и вносили исследуемую жидкость (сыворотка крови, назальный секрет). После инкубации в течение 30 минут при комнатной температуре лунки планшетов вновь отмывали дистиллированной водой и вводили реактивы тест-систем («Вектор-Бест», Новосибирск) для выявления IgG в сыворотке крови и IgAs в назальном секрете.
Статистическая обработка результатов исследования проводилась с использованием пакета программ «BIOSTAT». Результаты и обсуждение. Течение местного гнойно-воспалительного процесса отражается на балансе цитокинов в сыворотке крови (табл. 1).
Таблица 1. Содержание цитокинов в сыворотке крови больных ХГРС

Убольных ХГРС в сыворотке крови возрастает содержание IL-1β, IL-4, IL-6 и IF-α. Уменьшается концентрация IL-8. Исчезают IL-2 и IL-10. Полученные факты свидетельствуют о возможности проникновения интерлейкинов из местного воспалительного очага в общий кровоток.
Следует напомнить, что среди эффектов IL-1β стимуляция B-лимфоцитов, усиление двигательной активности нейтрофилов, активация фагоцитоза, прокоагулянтной активности, стимуляция синтеза провоспалительных цитокинов и экспрессии на поверхности эндотелия адгезивных молекул.
IL-4 вырабатывается тучными клетками, базофилами, В-лимфоцитами, клетками костного мозга. Вызывает активацию, пролиферацию и дифференцировку T- и B-лимфоцитов. Является ключевой регуляторной молекулой, запускающей процесс дифференцировки B-лимфоцитов в плазматические клетки, усиливает хемотаксис и адгезивные свойства лейкоцитов.
Обеспечение роста и дифференцировки B-лимфоцитов в плазматические клетки – основная задача IL-6. Замечено, что он ингибирует продукцию IL-1и TNF-α, хотя оба указанных цитокина являются стимуляторами его синтеза. IF-α индуцирует образование интерферонов другими клетками, не контактирующими с возбудителем патологической реакции, тормозит продукцию основных провоспалительных цитокинов, усиливает синтез и секрецию IL-10.
Прямая корреляция между уровнем IL-2 и IL-10 и уровнем аАт класса IgG к ним в сыворотке крови свидетельствует о потреблении этих групп цитокинов и их элиминации указанными ААТ.
Таблица 2. Содержание цитокинов в назальном секрете больных ХГРС
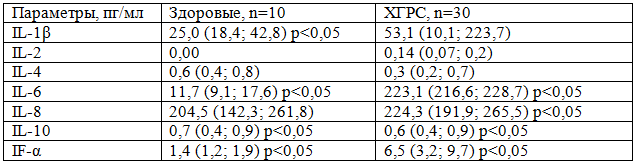
Концентрация IL-1β в назальном секрете у больных ХГРС увеличивается практически в 8 раз, также значительно возрастает уровень IL-2, IL-6, IL-8, IF-α. Следует отметить, что при ХГРС содержание IL-4 и IL-10 уменьшается, что, вероятно, связано с потреблением этой группы цитокинов и их элиминацией антителами класса sIgA.
Таблица 3. Содержание ААТ к цитокинам в сыворотке крови больных ХГР
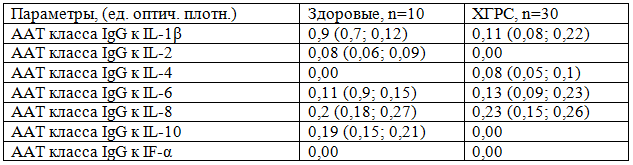
Таблица 4. Содержание ААТ к цитокинам в назальном секрете больных ХГРС
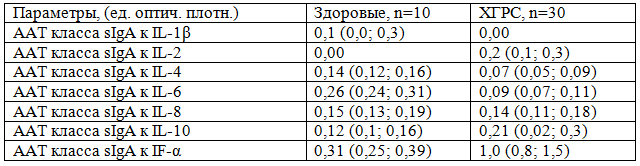
Итак, цитокиновый профиль в назальном секрете подвергается более резким изменениям, нежели чем в системном кровотоке, что свидетельствует о преимущественно местном образовании про- и противовоспалительных цитокинов и в целом отражает степень остроты воспалительного процесса.
Мы определяли уровень ААТ к цитокинам, как в сыворотке крови, так и назальном секрете. Необходимость таких исследований обусловлена нашим предположением о возможной элиминации различных групп цитокинов аутоантителами. Такая гипотеза не лишена оснований, так как бесконтрольное накопление интерлейкинов как местно, так и в системном кровотоке чревато инициацией перехода в деструктивную фазу воспаления.
Описанные к настоящему времени механизмы удаления цитокинов посредством растворимых рецепторов и пептидаз не выдерживают никакой критики в силу очевидной низкой эффективности.
Исчезновение ААТ класса sIgA к IL-1β может свидетельствовать об их полном потреблении, связанном с образованием иммунных комплексов. Вместе с тем, в других исследованиях продемонстрирована обратная реакция. Так, уровень ААТ класса sIgA к IL-2, IL-8, IF-α отражает иммуностимулирующий эффект увеличенной концентрации цитокинов.
Заключение. Хронический гнойный риносинусит развивается на фоне разнонаправленных сдвигов в концентрации про- и противовоспалительных цитокинов в сыворотке крови и назальном секрете.
Повышение концентрации в назальном секрете IL-8, являющегося мощным хемокином, в сочетании с увеличением уровня IL-1, IL-2 и IL-6 (первичные провоспалительные цитокины) [Ошибка! Источник ссылки не найден.] приводит к хронизации процесса и длительному персистированию микробной флоры.
Отмеченные изменения концентрации ААТ к исследуемым цитокинам в сыворотке крови и назальном секрете в подавляющем большинстве случаев указывают на их участие в процессах регуляции цитокинового профиля. Имеющиеся разнонаправленные изменения уровня интерлейкинов и ААТ к ним, вероятно, обусловлены хроническим течением заболевания.
