Неспецифический бактерицидный эффект озона широко используется в хирургии, в том числе для санации брюшной полости при перитоните [1, 2, 4, 5, 13, 15,20, 22]. Экспериментальные исследования в первую очередь касаются бактериальной обсемененности брюшной полости, поисков эффективной лечебной концентрации озона в растворе.
Имеются данные об отсутствии побочных эффектов озона при местном применении [3, 10, 11, 18, 19, 23]. Однако они основаны на анализе метаболических изменений - изменений процессов перекисного окисления липидов и антиоксидантной защиты, регуляции агрегатного состояния крови, состояния иммунной системы, микроциркуляции. Морфологические и ультраструктурные изменения внутренних органов в основном отражают системные эффекты озонотерапии.
Согласно большинству литературных источников, оптимальная концентрация озона для местного применения составляет 4-6мг/мл [3, 5, 6,8, 9,12,21,14]. В исследовании Родоман Г.В. озонированный физиологический раствор (ОФР) с концентрацией озона 10 мкг/мл и более оказывает полное бактерицидное действие на микроорганизмы - возбудители хирургических инфекций [17]. Однако действие озона на париетальную и висцеральную брюшину в данных концентрациях не изучено. Например, в исследовании Глухова А.А. в эксперименте на собаках установлено отсутствие необратимых изменений стенки тонкой кишки при внутрибрюшном введении ОФР в концентрации 2 мг/л [7]. Актуальным остается вопрос о побочных эффектах ОФР, в том числе о его повреждающем действии на париетальную и висцеральную брюшину при промывании брюшной полости в профилактических, а не лечебных целях.
Цель исследования: изучить морфологические изменения брюшины под действием ОФР и обосновать его клиническое применение в комплексной профилактике послеоперационных гнойных осложнений.
Задачи исследования:
- Провести в эксперименте сравнительный анализ реакции брюшины на внутрибрюшное введение:
а) озонированного физиологического раствора;
б) не озонированного физиологического раствора;
- Изучить интраоперационные биоптаты париетальной брюшины до- и после введения ОФР у пациентов при плановых операциях на толстой кишке
- Оценить безопасность и эффективность клинического применения ОФР в комплексной профилактике гнойных осложнений.
Материалы и методы. Экспериментальная часть работы основана на результатах исследований 40 лабораторных белых крыс 3-4 месячного возраста, которые были разделены на контрольную и опытную группы. Эксперименты проводились с согласия этического комитета ГОУ ВПО "НижГМА Росздрава", в соответствии с правилами, утверждёнными приказом МЗ СССР № 755 от 12.08.1977 и с соблюдением международных правил работы с лабораторными животными [16, 20]. В соответствии с литературными данными выбрана концентрация озона в ОФР 8-9 мг/л, как максимально эффективная и безопасная при однократном применении. Для оценки структурных изменений ткани париетальной брюшины в динамике проводилось гистологическое исследование кусочков брюшины, взятых в сроки 4, 8, 12 ,24 часа, а также через 2 и 3 суток после введения озонированного физиологического раствора в брюшную полость в дозе 1мл (0,2 мл на 1мл крови). В каждый срок исследовали по 5 животных. Группу контроля также составили 5 животных, которым вводили не озонированный физиологический раствор в то же дозе.
В клиническую часть исследования включено 40 пациентов в возрасте от 45 до 75 лет, которым в плановом порядке были выполнены операции на толстой кишке, сопровождающиеся вскрытием просвета (гемиколэктомии, резекции толстой кишки, внутрибрюшное закрытие колостомы, экстирпации прямой кишки), сопоставимые по объему и продолжительности вмешательства. Профилактика гнойно-септических осложнений (ГСО) включала комбинированную антибиотикопрофилактику и однократное 10-минутное промывание брюшной полости ОФР в концентрации 8-9 мг/л перед ушиванием п/о раны. Острым путем забирали участок париетальной брюшины 1х1 см в зоне вмешательства до введения ОФР и через 10 минут после его введения.
Материал фиксировали в 10% растворе формалина, проводили по спиртам восходящей крепости и заливали в парафиновые блоки. Срезы, изготовленные на ротационном микротоме толщиной 6 мкм, окрашивали с применением обзорных окрасок и просматривали в световой микроскоп при увеличении 300-600 раз. Фотографировали. Для получения объективных результатов проводилось морфометрическое исследование с анализом клеточного состава воспалительного инфильтрата и площади кровеносного русла. Применялся «слепой метод» изучения материала, патологоанатом не был информирован о том, препарат опытной или контрольной группы он исследует.
Результаты. В ходе эксперимента животные контрольной и опытной групп были спокойны, активны. Летальные исходы отсутствовали. Макроскопическая картина на фоне введения ОФР не изменялась. Динамика тканевых процессов в брюшине в разные сроки эксперимента представлена в табл. 1.
Таблица 1. Динамика тканевых процессов в брюшине в разные сроки эксперимента в опытной и контрольной группы животных.
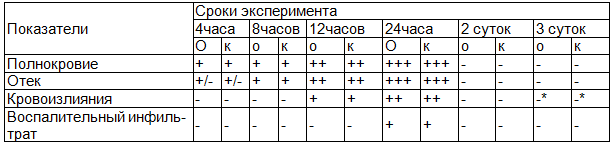
Примечание: *-наличие пигментов гемоглобина.
Как видно из табл. 1, само введение физиологического раствора не является индифферентной процедурой, поскольку у животных как опытных, так и контрольных групп в ранние сроки после введения физиологического раствора наблюдался умеренно выраженный отек; в дальнейшем нарастали нарушения гемодинамики в брюшине, что проявлялось в развитии полнокровия и отека, а также в формировании первого этапа воспалительной реакции – краевого стояния лейкоцитов в сосудах и лейкодиапедеза к концу первых суток эксперимента (рис. 1).
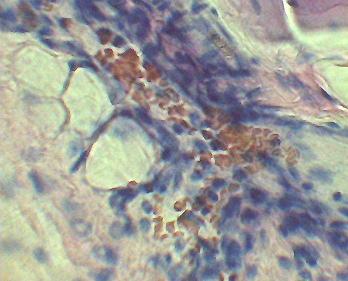
Рис. 1. Париетальная брюшина животного опытной группы через 24 часа после введения ОФР. Полнокровие, стаз, сладж, краевое стояние лейкоцитов (гематоксилин-эозин. Ув.: ок 15х, об. 40х).
Данные изменения носили кратковременный характер, поскольку к концу вторых суток опыта нарушение гемодинамики и гемореологии уже не выявлялось. На третьи сутки в брюшине опытных и контрольных животных были обнаружены фокусы отложения гемосидерина, что свидетельствовало о наличии старых кровоизлияний.
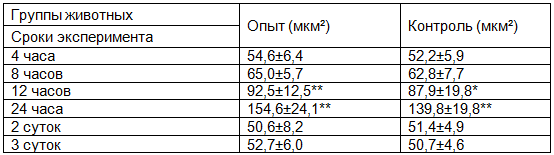
Для выяснения количественных различий в кровенаполнении брюшины в разные сроки эксперимента нами было проведено морфометрическое исследование площади сосудистого русла в 50 полях зрения у опытных и контрольных животных. Полученные данные приведены в табл. 2.
Таблица 2. Площадь кровеносного русла в ткани париетальной брюшины в разные сроки эксперимента
Примечания: *р≤0,05; **р≤0,001.
Из табл. 2 следует, что через 12 часов и особенно к концу первых суток опыта у животных контрольной и опытной групп достоверно нарастает площадь микроциркуляторного русла, которая увеличивается в 2,5- 3 раза по сравнению с исходными показателями. В то же время достоверных различий между показателями у животных основной группы и группы сравнения не найдено (р≥0,05). Морфологические и морфометрические изменения брюшины незначительно прогрессируют под действием как озонированного, так и неозонированного физиологического района и полностью стихают к концу 2х суток.
Полученные результаты, с учетом накопленного ранее опыта озонотерапии, позволили применить ОФР в концентрации 8-9 мг/л для санации брюшной полости в клинической практике.
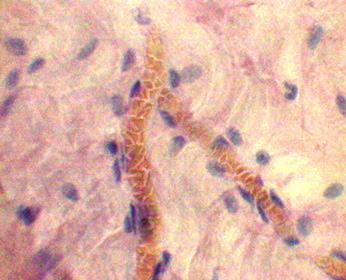
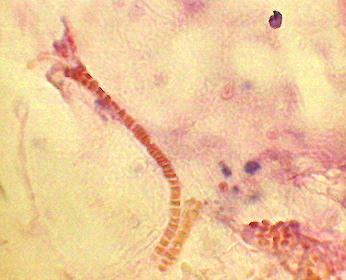
У всех 40 больных, которым производился интраоперационный забор биопсийного материала, макроскопические изменения брюшины не были зарегистрированы. Гистологическое исследование брюшины до введения озонированного физиологического раствора выявило умеренно выраженное полнокровие и умеренный отек базальной мембраны мезотелия. В кровеносных сосудах стаз, сладжи (рис. 2), нередко - краевое стояние лейкоцитов и лейкодиапедез. Воспалительный инфильтрат был умеренно выражен, носил диффузный характер и был представлен нейтрофилами и лимфоидными клетками. Гистологическая картина соответствовала реакции брюшины на обьем и продолжительность операции.
После введения озонированного физиологического раствора нами были выявлены аналогичные признаки серозного воспаления с наличием умеренного полнокровия, отека и диффузной умеренно выраженной лимфо- лейкоцитарной инфильтрации (рис. 3).
 |
 |
|
Рис. 2. Брюшина пациента до введения озонированного физиологического раствора. Стаз, сладжи в сосудах микроциркуляторного русла (гематоксилин-эозин. Ув: ок.15х, об. 40х). |
Рис. 3. Брюшина пациента после введения озонированного физиологического раствора. Стаз, сладжи в сосудах микроциркуляторного русла, умеренный периваскулярный отек (гематоксилин-эозин. Ув: ок.15х, об. 40х). |
В 8 препаратах были выявлены резко выраженное полнокровие с наличием признаков сладжирования эритроцитов, отеком, множественными кровоизлияниями и плотный диффузный воспалительный инфильтрат каак до-, так и после введения ОФР. Данные изменения брюшины, по-видимому, являющиеся следствием параканкрозного воспаления, не были диагностированы до операции и не определялись интраоперационно.
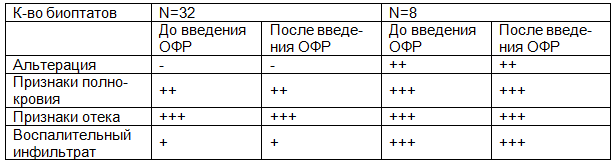
Описательные характеристики гистологических изменений в брюшине представлены в табл. 3. В изученных показателях как до, так и после введения озонированного раствора, различия отсутствуют.
Таблица 3. Тканевые изменения в париетальной брюшине до после введения озонированного раствора
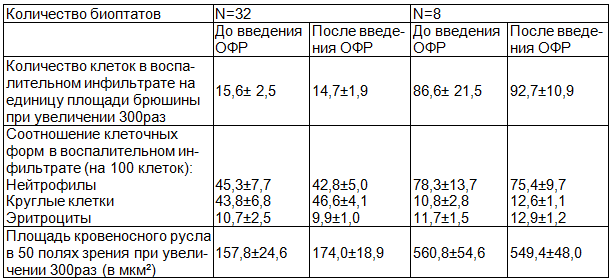
Соотношение клеточных элементов в инфильтрате и площадь кровеносного русла до и после введения озонированного раствора представлены в табл. 4. Данные свидетельствуют о том, что введение озона не приводит к достоверным изменениям клеточных элементов и площади кровеносного русла брюшины
Таблица 4. Гисто-морфометрическая характеристика брюшины до и после введения озонированного физиологического раствора
В 8 препаратах морфологические изменения, характеризующие воспаление брюшины, присутствовали как до-, так и после введения озонированного раствора, не меняясь ни по качественным, ни по количественным показателям. Все это подтверждает безопасность применения ОФР.
При анализе полученных результатов становится очевидной возможность безопасного использования ОФР для санации брюшной полости в профилактике гнойно-септических осложнений. Применение ОФР в клинике позволило уменьшить число гнойно-септических осложнений при операциях на толстой кишке с 11,5% до 6,7%.
При этом осложнения, связанные с местным применением озона, не наблюдались ни в одном случае.
Выводы
- Реакция брюшины на внутрибрюшное введение интактным животным как простого, так и озонированного до концентрации 8-9 мг/л физиологического раствора вызывает кратковременную реакцию брюшины в виде отека и нарушения гемодинамики.
- Однократное 10-минутное промывание брюшной полости ОФР в концентрации 8-9 мг/л пациентам, которым выполняются операции на толстой кишке, не оказывает повреждающего действия на брюшину.
- Применение ОФР для профилактики гнойно-септических осложнений при операциях на толстой кишке безопасно и эффективно.
