Актуальность проблемы. До настоящего времени сердечно-сосудистые заболевания остаются основной причиной смертности населения большинства развитых стран Европы, составляя до 40% всех случаев смерти. К настоящему времени установлен целый ряд факторов различной природы [5,8,12], способствующих развитию и прогрессированию ИБС – дислипидемия, артериальная гипертензия, избыточная масса тала, курение, гиподинамия, сахарный диабет. Большое внимание уделяется клеточно-молекулярным основам эндотелиальной дисфункции [9,10]. Важная роль в дисфункции эндотелия принадлежит оксиду азота [4,11].
Патогенез атеросклероза довольно сложный, однако важная роль при этом принадлежит дислипидемии, что определяет запуск каскадного механизма воспаления. Поэтому лечебные мероприятия направлены на снижение уровня холестерина и других насыщенных жиров [4,8].
В последние годы большое внимание уделяется природным биодеградирующим соединениям, в частности хитозану и его производным. В Институте химии и физики полимеров АН РУз под руководством С.Ш. Рашидовой разрабатываются различные производные хитозана [6].
Цель исследования: оценить влияние сульфапорина (сульфат хитозана) на систему оксида азота при экспериментальной гиперхолестеринемии (ГХС).
Материал и методы исследования. Для решения поставленных задач проведены эксперименты на 46 кроликах породы Шиншилла средним весом 2,5-3,0 кг, содержавшихся на стандартном режиме питания. Модель экспериментальной ГХС у животных воспроизведена введением перорально растворенного холестерина (ХС) в подсолнечном масле в соотношении 0,2 гр на 1 кг массы тела ежедневно в течение 3-х месяцев. О развитии ГХС судили по увеличению уровня общего ХС и липопротеидов низкой (ЛПНП) и высокой (ЛПВП) плотности, которые определяли на биохимическом анализаторе. Через 2 месяца от начала эксперимента кролики были разделены на 5 групп: 1 группа – интактная (6 кроликов), которым через ротовую полость ежедневно вводили растительное масло по 1,0 мл/кг; 2 группа ГХС+Н2О – контрольная (8 кроликов); 3 группа ГХС+гемфибразил по 100 мг/кг (8 кроликов); 4 группа ГХС+сульфат хитозана по 25 мкг/кг (8 кроликов); 5 группа – ГХС+сульфат хитозана по 50 мкг/кг (8 кроликов). Действие препаратов исследовано в динамике: первоначальное 3-месячное состояние и через месяц после введения препаратов. О состоянии NO-ергической системы судили по уровню метаболитов оксида азота [2], активности синтазы оксида азота (еNOS) [7], нитратредуктазной активности (НР) [3] и уровню пероксинитрита (ONOO-) [2]. Полученные результаты сравнивали по показателям контрольной и интактной групп. Цифровой материал обработан методом вариационной статистики.
Результаты исследования и обсуждение. NO-эргическая система играет наиболее существенную роль в осуществлении сосудистым эндотелием своих функций и возникновении ее дисфункции. В ходе развития патологии сосудистой системы нарушается внутриклеточная передача сигнала в системе синтеза NO при участии еNOS. Действительно, проведенные в этом плане исследования показали достоверное уменьшение содержания конечных продуктов оксида азота, выраженность которых соответствует прогрессированию ГХС. Так, содержание оксида азота, оцениваемого по количеству конечных продуктов, на 30-е, 60-е и 90-е сутки опыта снижается в 1,29 (Р<0,05); 1,53 (Р<0,01) и 2,11 (Р<0,001) раза, соответственно значениям интактных кроликов.
Такие изменения уровня оксида азота в сыворотке крови могут быть обусловлены ингибированием еNOS. Так, определение активности еNOS показало ее прогрессивное снижение в 1,25 (Р<0,05); 1,36 (Р<0,05) и 1,94 (Р<0,001) раза, относительно значений интактных животных. В целом выявленные нами сдвиги в активности фермента NOS согласуются со сдвигами со стороны уровня продукта NO-эргической системы – NOx. При этом, чем ниже активность фермента NOS, тем ниже уровень NOx.
В отличие от содержания NOx, в сыворотке крови кроликов с ГХС прослеживается повышение уровня продукта биопревращения NOx - ONOO-. Так, если уровень последнего на 30-е сутки введения экзогенного ХС повышается в 1,33 (Р<0,05) раза относительно значений интактных кроликов, то на 60-е и 90-е сутки эксперимента – соответственно в 1,93 (Р<0,001) и 2,47 (Р<0,001) раза.
Учитывая, что в условиях ГХС уровень ONOO- в сыворотке крови заметно выше, чем у интактных кроликов, нами также была определена активность другого фермента NO-эргической системы, участвующего в биопревращении оксида азота – нитратредуктазы (НР). При ГХС активность фермента НР в сыворотке крови на 30-е сутки введения экзогенного холестерина повышается лишь в 1,15 (Р<0,05) раза, на 60-е и 90-е сутки введения – в 1,3 (Р<0,05) и 1,76 (Р<0,01) раза соответственно.
Из полученных данных становится очевидным, что при ГХС происходят заметные нарушения в NO-эргической системе крови. Если учесть тот факт, что NO в сыворотке крови участвует, прежде всего, в реализации механизмов поддержания функциональной активности эндотелия сосудов, то становится понятным генез развития гипертензии при изучаемых патологиях. Это подтверждается снижением уровня в сыворотке крови экспериментальных животных NOx вследствие угнетения активности в них фермента еNOS. При этом повышение уровня пероксинитрита свидетельствует о реализации негативной роли NO-эргической системы и указывает на патологическую роль этих нарушений в генезе возникновения и прогрессирования атеросклероза.
Следует отметить, что секвенжированные модифицированные ЛПНП изменяют функцию эндотелия, снижая ее синтетические функции [5,8]. В связи с этим представляло интерес выяснение роли гипербеталипопротеидемии в изменении уровня оксида азота и еNOS. Проведенные исследования показали, что при уровне ХС в ЛПНП 2,38±0,27 ммоль/л содержание оксида азота и активность фермента составляют 16,68±0,28 пг/мл и 35,05±0,76 мкмоль/мин*мг белка соответственно. При уровне ХС в ЛПНП 4,08±0,10; 5,97±0,09 и 6,48±0,11 ммоль/л содержание оксида азота прогрессивно снижается до 12,94±0,10; 10,91±0,15 и 7,89±0,31 мкмоль/л, соответственно, активность еNOS до 28,29±0,49; 25,80±0,73 и 18,05±0,70 мкмоль/мин*мг белка, соответственно концентрации холестерина в ЛПНП.
Анализ уровня пероксинитрита и активности НР в зависимости от содержания ХС в ЛПНП показал, что при уровне ХС в ЛПНП 2,38±0,27 ммоль/л, содержание пероксинитрита и активность НР составляют 0,15±0,01 мкмоль/л и 2,72±0,19 мкмоль/мин*мг белка, соответственно. При уровне ХС в ЛПНП 4,08±0,10; 5,97±0,09 и 6,48±0,11 ммоль/л содержание пероксинитрита повышается до 0,20±0,01; 0,29±0,02 и 0,37±0,01 мкмоль/л, а активность НР – до 3,12±0,11; 3,54±0,10 и 4,78±0,14 мкмоль/мин*мг белка, соответственно уроню ХС в ЛПНП.
Следовательно, по мере прогрессирования ГХС и гипербеталипопротеинемии выработка оксида азота и активность его синтазы в эндотелиоцитах подавляется, содержание его активных радикалов прогрессивно возрастает. В динамике ГХС в сыворотке крови происходят заметные нарушения в NO-эргической системе. Эти нарушения характеризуются дефицитом NOx, обусловленного низкой активностью NOS, а также накоплением в них продукта биопревращения оксида азота – пероксинитрита за счет повышения активности нитрат-редуктазы и, видимо, несостоятельности системы антиоксидантной защиты. Несомненно, дефиниции оксида азота в сыворотке крови сопровождаются неполноценным функционированием механизмов, направленных на регулирование функциональной активности не только эндотелия сосудов, но и форменных элементов крови, способствуют запуску соответствующих эндотелиальных механизмов по принципу обратной связи, что отрицательно сказывается на течении и исходе изучаемой патологии [1]. Это обстоятельство требует учета выявленных нами нарушений в выборе стратегии и тактики лечения ГХС.
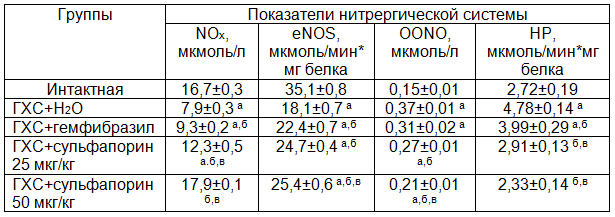
Фармакотерапия гемфибразилом в течение 1 месяца приводила к достоверному увеличению уровня конечных продуктов оксида азота в 1,18 раза относительно значений контрольной группы животных (таблица 1). Однако, несмотря на такое повышение, содержание их оставалось низким (снижение в 1,79 раза, Р<0,001), что свидетельствовало о низкой активности эндотелиоцитов, вырабатывающих оксид азота. Подтверждением этому явились низкие значения активности еNOS. Значения ее возросли лишь в 1,24 (Р<0,05) раза относительно значений контрольной группы, однако сохранялись статистически значимо ниже показателей интактных кроликов в 1,57 (Р<0,01) раза.
Фармакотерапия сульфапорином в дозах 25 и 50 мкг/кг статистически достоверно повышала значения контрольной группы по уровню оксида азота в 1,56 и 2,26 раза, соответственно. Если при дозе 25 мкг/кг уровень оксида азота сохранялся низким в 1,36 (Р<0,05) раза по сравнению с показателями интактных кроликов, то при использовании дозы 50 мкг/кг он не отличался от вышеперечисленных параметров. В то же время, по сравнению с гемфибразилом доза 50 мкг/кг оказалась более эффективной в плане коррекции оксида азота: уровень оксида азота был в 1,32 (Р<0,05) и 1,92 (Р<0,001) раза выше, чем в группе кроликов, леченных гемфибразилом.
Наряду с этим, мы наблюдали также активизацию синтазы оксида азота. Так, активность еNOS статистически значимо возросла в 1,37 (Р<0,05) и 1,41 (Р<0,05) раза относительно значений контрольной группы животных, соответственно дозам 25 и 50 мкг/кг. Эти показатели сохранялись ниже нормативных величин в 1,42 (Р<0,05) и 1,38 (Р<0,05) раза, соответственно. Следует отметить, что эти значения лишь незначительно превышали показатели группы кроликов, леченных гемфибразилом.
Таблица 1. Влияние фармакотерапии на показатели нитрергической системы крови кроликов с гиперхолестеринемией (n=6-8)
Примечание: а – достоверно по отношению к показателям интактных кроликов; б – достоверно по отношению к показателям контрольной группы; в – достоверно по отношению к показателям кроликов ГХС+гемфибразил (Р<0,05).
Фармакотерапия экспериментальной ГХС гемфибразилом приводила к снижению уровня пероксинитрита в 1,21 раза и активности НР – в 1,2 раза относительно значений нелеченной группы животных. Изучаемые показатели сохранялись высокими, превышая значения интактных кроликов в 2,07 (Р<0,001) и 1,47 (Р<0,01) раза, соответственно. Фармакотерапия ГХС сульфапорином в дозах 25 и 50 мкг/кг снижала высокие значения пероксинитрита в 1,38 и 1,73 раза, соответственно относительно значений нелеченной группы. По сравнению с группой, получавшей гемфибразил, это снижение составило 1,15 и 1,45 раза, соответственно дозам. Вместе с тем, следует указать на то, что относительно значений интактных кроликов уровень пероксинитрита при использовании сульфапорина 1,81 и 1,43 раза превышал, соответственно дозам 25 и 50 мкг/кг. Фармакотерапия сульфапорином в дозах 25 и 50 мкг/кг снижала высокую активность нитратредуктазы в 1,64 и 2,05 раза относительно значений нелеченной группы животных. При этом относительно значений животных, леченных гемфибразилом, это снижение составило 1,37 и 1,71 раза, соответственно дозам.
Из полученных данных становится очевидным, что при ГХС фармакотерапия сульфапорином более эффективнее корригировала нарушения в системе оксида азота. Его действие более выраженно проявлялось в коррекции уровня оксида азота и нитратредуктазы. В то же время активность синтазы оксида азота сохранялась низкой. Видимо, существенное снижение уровня оксида азота на фоне сохраняющейся низкой активности синтазы оксида азота связана с ускоренным взаимодействием его с активными формами кислорода и образованием пероксинитрита. Это подтверждается сохранением высоких значений пероксинитрита в сыворотке крови экспериментальных животных. На наш взгляд, более эффективным в плане коррекции системы оксида азота целесообразно использование дозы 25 мкг/кг.
Выводы. Таким образом, в основе развития дисфункции эндотелия при ГХС важную роль играют уменьшение синтеза эндотелиального оксида азота и увеличение его активных радикалов, обусловливающие модификацию липопротеинов низкой плотности. Сульфатированный хитозан снижает высокий уровень пероксинитрита и эндотелина-1, повышает активность eNOS и содержание оксида азота.
