В последние годы исследователи проявляют интерес к межсистемным и межорганным взаимосвязям на уровне жизнедеятельности клетки, особенно в органах, ответственных за функционирование всего организма, поддержание его гомеостаза при всевозможных патологических ситуациях, возникающих как внутри организма, так и на фоне привнесенных в него извне причин [2,29]. Из-за особого структурно-функционального положения и значения печени особое место отводится гепатоцитам, поскольку их функционирование подвергается постоянному влиянию эндогенно образовывающихся и экзогенно поступающих ксенобиотиков [25,27]. Печеночная паренхима обладает способностью нивелировать все эти угрозы. Функциональная активность гепатоцитов определяется состоятельностью ферментов монооксигеназной системы [19,20]. Физиологическая стабильность и гибкая приспособляемость этой системы в полной мере можно оценить и проследить на фоне применения индукторов или ингибиторов лекарственного метаболизма. Доказано, что первые повышают активность монооксигеназ, а вторые, напротив, снижают их активность [21,26]. Однако до сих пор нет ответа на вопрос, каким образом индукторы и ингибиторы монооксигеназ влияют на активность нитрергической системы. Уже известно, что маркерами активности последней являются оксид азота (NO), эндотелиальная (eNOS) и индуцибельная NOS (iNOS ) NO-синтаза и пероксинитрит (ONO2-) [10,11].
Цель исследования – изучение активности монооксигеназ и параметров NO-системы в микросомах гепатоцитов на фоне действия индуктора бензонала и ингибитора циметидина.
Материал и методы. Исследования проводились на 48 белых беспородных крысах-самцах массой 180-250 г, которых разделили на серии и группы в зависимости от условий опыта. Первая серия – группы животных, которым в течение 6 суток внутрижелудочно вводили 1% водную суспензию бензонала в дозах 25, 50 и 100 мг/кг; вторая – группы животных, которым внутрижелудочно вводили 1% водный раствор циметидина в аналогичных дозах. Животные содержались в стандартных условиях вивария и рационе кормления. Забой экспериментальных крыс, находившихся под рауш-наркозом, проводили посредством мгновенной гильотинной декапитации. В выделенных с помощью препаративной ультрацентрифуги VAC-601 (Германия) при 105000g микросомальных фракциях ткани печени определяли на двухлучевом спектрофотометре с компьютерной обработкой типа UV-2100 (Ltd, Китай) содержание цитохромов Р-450, Р-448, Р-420 и b5классическим методом Т. Omura, R.Sato[30]; активность микросомальных ферментов: НАДФН-цитохром с-редуктазу (НАДФН-цит.С-ред.) по C.H.Williams, H. Kamin [32]; бенз(а)пи-ренгидроксилазу (Б(а)ПГ) –по C.H.Yang, L.P.Kicha [33];N-деметилазу амидопирина (N-АП) - по A. Bast, J. Nordhosck [23]; анилингидроксилазу (АГ) - по А.И. Арчакову и соавт. [3]; глюкоза-6-фосфатазу (Г-6-Фаза) - по N.S. Gnosh, N.C. Kar [24]; микросомальный белок (мг/мл) – по O.H.Lowry и соавт [31].
Одновременно в выделенных микросомах и в сыворотке крови определяли содержание NO по основным стабильным его метаболитам - NO2- и NO3- - по методу П.П. Голикова и соавт. [14]; активность еNOS - по В.В. Сумбаевой, И.М. Ясинской [22]; активность iNOS и концентрацию пероксинитрита (ONOO-) - по М.Ю. Раваевой, Е.Н.Чуян [17].
Полученные данные обрабатывали методом вариационной статистики. Достоверными считали результаты, удовлетворяющие р<0,05.
Результаты и обсуждение. Действие бензонала характеризовалось дозозависимым повышением активности всех изучаемых ферментов монооксигеназной системы (табл. 1).
Таблица 1. Активность монооксигеназ в микросомах печени крыс при действии бензонала и циметидина, M±m
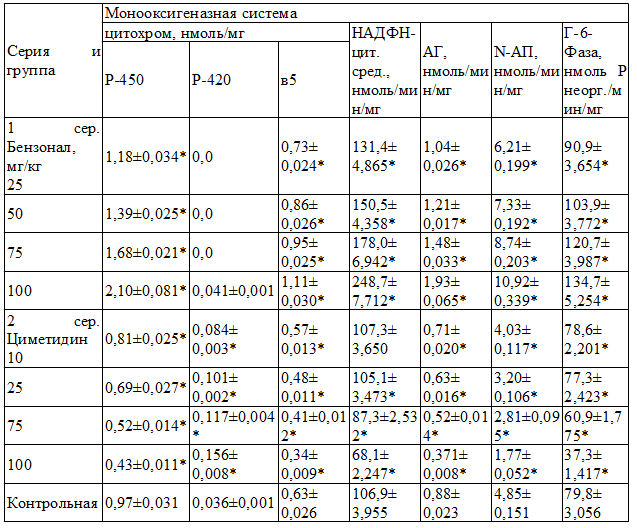
Примечание: здесь и далее * - р<0,05 по сравнению с контролем
Одновременно существенно изменялись показатели NO-системы. При этом в дозах 25 и 50 мг уровень NO, активность eNOS повышались, а активность iNOS и содержание ONO2-, напротив, снижались. В дозах 75 и 100 мг/кг, наряду с повышением уровня NO и активности eNOS, наблюдалось статистически значимое возрастание активности iNOS и содержания ONO2- (табл. 2).
Таблица 2. Активность NOS в микросомах печени крыс при действии бензонала и циметидина, M±m
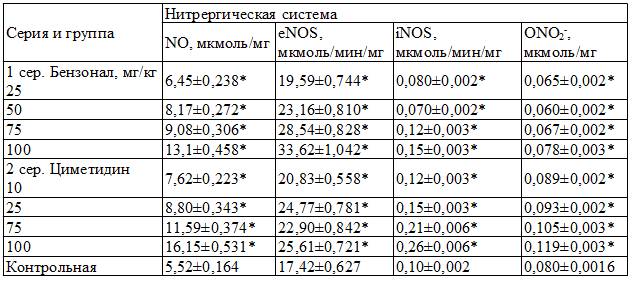
При введении животным циметидина, по мере увеличения его дозы с 10 до 100 мг/кг, отмечалось постепенное угнетение количественных показателей цитохромов P-450, b5, активности ферментов N-AП, АГ. Ферменты НАДФН-цит. с-ред и Г-6-Фаза в дозах 10 и 25 мг/кг практически оставались в пределах контрольных значений, а в дозах 75-100 мг/кг снижались (табл. 2).
При использовании циметидина в дозах 10 и 25 мг/кг уровень NO и активность (eNOS конституитивной) повышались; одновременно увеличивалась экспрессия iNOS и ONO2-. В дозах 75 и 100 мг/кг при сохранении высокого уровня NO и активности eNOS (на уровне действия препарата в дозе 10-25 мг/кг) активность iNOS и содержание ONO2- динамично возрастали. Следовательно, реакция систем цитохрома Р-450 и NOS в микросомах печеночной ткани неоднозначна на действие различных по своей химической природе ксенобиотиков. Ответные биохимические проявления в этих системах зависят как от фармакологических свойств препарата, так и от введенной дозы.
Свойственное бензоналу индуктивное действие на систему цитохрома P-450 [28], а также повышение содержания NO, экспрессия eNOS, проявляющиеся при введении малых доз индуктора (25-50 мг/кг), можно рассматривать с позиций необходимости увеличения контакта активного центра цитохрома Р-450 с ксенобиотиками. Для этого необходим приток кислорода, который должен поступить в гепатоцит через механизмы усиления процессов микроциркуляции в печеночной ткани. Поэтому подъем активности eNOS и NO при индукции системы цитохрома Р-450, по-видимому, связан с необходимостью усиления экспрессии ферментов монооксигеназной системы. Доказано, что увеличение eNOS и, соответственно, расслабляющего фактора эндотелия сосудов NO приводит к повышению процессов микроциркуляции и более эффективному обеспечению тканей кислородом [12,13]. В дальнейшем, с увеличением активности микросомальных ферментов, возрастает количество продуктов «летального синтеза», одним из элементов реализации которого является возрастание активированных форм кислорода, свободных радикалов, осуществляющих стимуляцию активности iNOS (неконституитивная форма NOS) [4]. При этом активная зона iNOS с большей готовностью доступна к связыванию с кислородом и образованию радикала ONO2-, обладающего цитотоксическим и мембранолитическим свойствами [8,16]. ONO2- угнетает ферментативную активность систем жизнеобеспечения клетки, стимулирует лизосомальные ферменты, процессы ускоренного апоптоза и некроза [9]. Возрастание активности iNOS и ONO2- в микросомах под действием индукторов лекарственного метаболизма, возможно, связано с истощением запасов аргинина, необходимого субстрата для синтеза NO, с участием изоформ цитохрома P-450 [7] и eNOS [1,6]. При назначении ингибиторов монооксигеназ повышение активности NO и eNOS, несомненно, обусловлено необходимостью обеспечения микросомальных ферментов кислородом. Но вместе с тем, аргинин как субстрат для активирования цитохрома Р-450, в большей степени расходуется, по-видимому, для активации как eNOS, так и iNOS. При этом перенасыщение клеток NO и iNOS, возможно, в еще большей степени тормозит реакции ферментов системы цитохрома Р-450. Возрастание активности iNOS как следствие гиперэкспрессия NO при высоких концентрациях циметидина (75, 100 мг/кг), происходит на фоне угнетения активности микросомальных ферментов НАДФН-цит. с-редуктазы и Г-6-Фазы – главных лимитирующих факторов функционирования цитохрома Р-450 [18].
По-видимому, НАДФН-цит. c-редуктаза и Г-6-Фаза являются основными мессенджерами возможной взаимосвязи между системой цитохрома P-450 и NOS. Чтобы подтвердить эту гипотезу, нами изучены корреляционные отношения между НАДФН-цит. c-редуктазой, Г-6-азой и цитохромом Р-450 и активностью NOS, уровнем NO, активностью eNOS и iNOS и содержанием ONO2-. Как видно из полученных данных, при назначении бензонала рост содержания цитохрома Р-450, НАДФН-цит. с-редуктазы и Г-6-Фазы напрямую коррелирует (р≤0,001) с увеличением параметров NO и eNOS и противоположно (р≤0,001) – с экспрессией iNOS и ONO2-. При назначении циметидина наблюдается отсутствие связи между сниженными параметрами НАДФН-цит. с-редуктазы и Г-6-Фазы и количеством цитохрома Р-450 с уровнем NO, активности eNOS, iNOS и ONO2- при малых дозах препарата (от 10 до 25 мг/кг), обратная сильная зависимость угнетения активности ферментов монооксигеназ и степенью гиперэкспрессии NOS, ONO2-, iNOS и прямая с угнетенной активностью eNOS при назначении высоких доз (75 и 100 мг/кг) циметидина.
Заключение. Таким образом, реакция монооксигеназных ферментов и NOS в микросомах при действии индуктора бензонала проявляется в синхронном режиме ее интенсификации. При действии ингибитора монооксигеназной системы циметидина угнетение скорости реакций монооксигеназ характеризуется нарастанием активности NOS как за счет ее конституитивной (eNOS), так и неконституитивной (iNOS) с одновременным повышением в микросомах содержания NO и ONO2-. Выявленные корреляционные связи между показателями монооксигеназной системы и NOS свидетельствуют об их четкой обоюдной функциональной зависимости, которая, к сожалению, до сих пор не учитывается в экспериментальной и клинической фармакологии, а также при терапии больных, в курс лечения которых назначают индукторы и ингибиторы лекарственного метаболизма.
Выводы
1. Монооксигеназная и NOS- системы синхронно стимулируются в микросомах печени при назначении индуктора лекарственнго метаболизма бензонала с увеличением дозы от 25 до 100 мг/кг
2. При назначении ингибитора монооксигеназной системы циметидина снижение экспрессии ферментов системы цитохрома Р-450 происходит на фоне экспрессии NO, конституитивной и неконституитивной форм NOS – eNOS и iNOS, значительного увеличения уровня пероксинитрита ONO2-.
3. Выявленная корреляция между ферментами монооксигеназной системы и NOS свидетельствует об их функциональной зависимости и ответной реакции при действии на организм различных по природе этиологических факторов.
