Эпидемия ВИЧ-инфекции способствует распространению эпидемии туберкулеза во всем мире [8]. По мере прогрессирования ВИЧ-инфекции количество CD4-лимфоцитов уменьшается и их функция нарушается. Иммунная система утрачивает способность задерживать рост и распространение M. tuberculosis. Чаще развиваются диссеминированные и внелегочные формы туберкулеза (ТБ) [5]. Присоединение ТБ к ВИЧ-инфекции значительно утяжеляет течение основного заболевания, способствует прогрессированию иммунодефицита, что приводит к быстрому переходу в стадию выраженного иммунодефицита и раннему летальному исходу [9]. Хорошо известно, что на фоне ВИЧ-инфекции видоизменяются клинические формы ТБ с преобладанием процессов генерализации. Последнее способствует увеличению числа случаев, где ТБ является основной причиной смерти у ВИЧ-инфицированных больных[7]. В ряде стран эта цифра колеблется от 38% до 47%, из которых только у половины ТБ диагностировался еще при жизни больных [10]. Высоким показателям смертности от ТБ у больных ВИЧ-инфекцией способствует не только изменение классических форм течения ТБ, но и значительные трудности в диагностике [6]. Классические методы лучевой диагностики, микроскопии, кожные тесты у больных сочетанным инфицированием значительно теряют в чувствительности [7,3]. Поэтому в современных условиях сохраняется актуальность изучения и оценки состояния гуморального иммунного ответа на туберкулезную инфекцию у больных ВИЧ-инфекцией с целью совершенствования серологических методов диагностики.
Материалы и методы. Методом сплошной выборки было обследовано 34 больных ТБ (первая группа), из них мужчин - 29, женщин - 5, в возрасте от 29 до 54 лет; 45 больных сочетанной ВИЧ/ТБ-инфекцией (вторая группа)- из них мужчин -38 , женщин - 7, в возрасте от 25 до 49 лет, госпитализированных для лечения в республиканскую клиническую противотуберкулезную больницу. Контрольную группу составили 23 здоровых добровольца.
Диагноз ВИЧ-инфекции устанавливали на основании общепринятых клинических, эпидемиологических и лабораторных данных. Для определения вирусоспецифических антител в сыворотке периферической крови проводили иммуноферментный анализ на тест-системах «ВИЧ-1, ВИЧ-2, ИФА-Авиценна» фирмы «Авиценна», Россия и «Комби Бест анти ВИЧ 1+2» фирмы «Вектор-Бест», Россия, «ДС-ИФА-ВИЧ-АГАТ-скрин», Россия и иммунного блоттинга в соответствии с прилагаемыми к тест-системам инструкциями (New Lav Blot 1, Bio Rad, Франция).
Диагноз ТБ выставлялся на основании клинико-рентгенологических и лабораторных методов. Были применены как обязательные (рентгенологическое исследование, анализ мокроты на M. tuberculosis, анализ крови и мочи, туберкулиновая проба), так и дополнительные и факультативные методы (расширенная бактериологическая диагностика, углубленное рентгенологическое исследование).
Известно, что высокоинформативным диагностическим признаком для большинства больных ТБ является наличие в сыворотке крови противотуберкулезных антител (ПТАТ), которые по-разному оцениваются исследователями в качестве маркеров ТБ. Так, ряд авторов указывают на то, что высокие уровни антител присущи больным с тяжелыми, распространенными формами ТБ легких, а низкие уровни отражают положительную динамику процесса на фоне антибактериальной терапии [4]. Существует и иная точка зрения: высокие уровни антител наблюдаются при ограниченных процессах с преобладанием продуктивной тканевой реакции, а при выраженном экссудативном компоненте с казеозным некрозом и распадом легочной ткани доминируют низкие уровни антител [1]. Вместе с тем авторы приходят к выводу о том, что уровни антител к антигенам микобактерий отражают степень активности заболевания.
В проделанной нами работе была проанализирована частота обнаружения ПТАТ в сыворотке крови больных с сочетанным инфицированием (ВИЧ/ТБ), больных ТБ без ВИЧ-инфекции и у здоровых добровольцев.
Суммарнный пул специфиечких антител к антигенам M.tuberculosis определяли методом иммуноферментного анализа, с использованием тест-системы «АТ-Туб-Бест-стрип» (производитель - ЗАО «Вектор-Бест», Новосибирск). Определение ПТАТ в составе специфических циркулирующих иммунных комплексов (ЦИК) проводили по методу Герасимова И.Г., Зорковой Е.В. [2].
Результаты собственных исследований. У пациентов первой группы были диагностированы следующие формы ТБ легких: очаговый ТБ – у 7 (20,6%) человек, инфильтративный ТБ без распада – у 9 (26,5%) человек, инфильтративный ТБ в фазе распада – у 11 (32,4%), фиброзно-кавернозный ТБ легких – у 7 (20,6%) человек. Микобактерии туберкулеза были обнаружены у 22 (64,7%) пациентов.
У больных второй группы были диагностированы следующие формы туберкулеза: инфильтративный туберкулез легких – у 10 (22,2%) больных, инфильтративный туберкулез легких в фазе распада – у 9 (20%), фиброзно-кавернозный туберкулез легких – у 8 (17,8 %), диссеминированный туберкулез легких - у 8 (17,8%), генерализованный туберкулез – у 6 (13,3%), туберкулезный плеврит - у 4 (8,9%) больных. M. tuberculosis были обнаружены у 29 (64,4%) пациентов.
В опытной группе сочетанного инфицирования ВИЧ и M. tuberculosis было обнаружено значительное изменение соотношения клинических форм ТБ в пользу увеличения внелегочных, генерализованных форм, при этом у них практически полностью отсутствовали очаговые формы поражения легких (рис. 1).
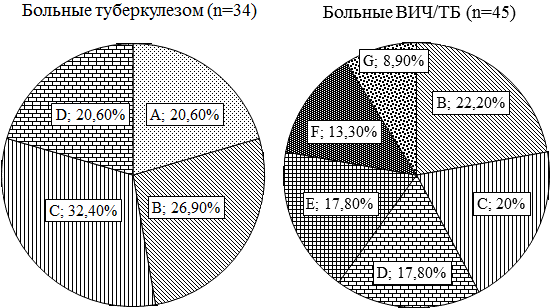
Рис. 1. Формы туберкулеза у исследуемых групп больных: здесь и далее А - очаговый туберкулез легких; В - инфильтративный туберкулез легких; С - инфильтративный туберкулез легких в фазе распада; D - фиброзно-кавернозный туберкулез легких; E - диссеминированный туберкулез; F-генерализованный туберкулез; G - туберкулезный плеврит.
Анализ обнаружения противотуберкулезных антител (ПТАТ) в сыворотке больных ТБ свидетельствовал о том, что чувствительность ИФА метода значительно зависела от формы заболевания и возрастала с 28,6% при очаговой форме ТБ легких до 85,7-90,9% у больных с наличием более тяжелых форм (табл. 1).
Таблица 1. Частота выявления ПТАТ в сыворотке крови и в составе ЦИК у больных туберкулезом и при сочетанной инфекции ВИЧ/ТБ (%)
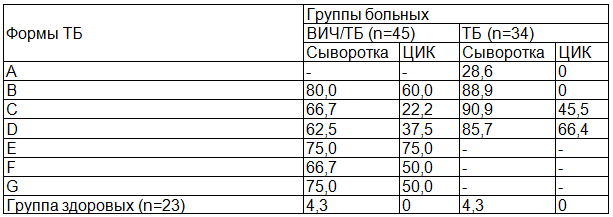
При оценке результатов по обнаружению ПТАТ в составе специфических ЦИК необходимо учитывать два условия формирования последних: во-первых, должно быть наличие достаточного уровня сывороточных ПТАТ и, во-вторых, необходимо наличие в циркуляции антигена M. tuberculosis в эквивалентной антителам концентрации. В группе больных очаговыми формами ТБ легких на фоне низкого уровня ответа по частоте встречаемости ПТАТ и низким их титром, не превышающим 1:100 и 1:200, мы ни в одном случае не обнаружили ЦИК, несущие ПТАТ. В группе больных инфильтративным ТБ легких без распада, когда почти 90% больных имели свободно циркулирующие ПТАТ, последние не обнаруживались в составе ЦИК. Обе эти формы ТБ легких объединяет один общий компонент - отсутствие признаков распада. Поэтому можно предположить, что отсутствие ПТАТ в составе ЦИК в основном связано или с отсутствием антигена М. tuberculosis в свободном состоянии или же его концентрация или форма не были доступны для образования ЦИК.
Данное предположение оказалось обоснованным, поскольку переход больных ТБ легких в стадии заболевания с распадом практически не увеличили частоту положительных результатов на наличие ПТАТ в свободном состоянии, но доводили процент больных, несущих специфические ЦИК до 45,5% и 66,4% в случае инфильтративного ТБ легких с распадом и фиброзно-кавернозного ТБ соответственно.
В группе больных с сочетанным ВИЧ/ТБ инфицированием чувствительность метода ИФА в диагностике ТБ возрастала до уровней 75,0-80,0% за счет изменения форм ТБ преимущественно в виде генерализованных форм.
В случаях инфильтративной и фиброзно-кавернозной форм поражения легких отличий в чувствительности метода ИФА в сравниваемых группах не было обнаружено.
Сопоставление титра сывороточных ПТАТ с долей их участия в формировании ЦИК у больных сочетанным инфицированием ВИЧ/ТБ, указало на соответственно высокие уровни их одновременной встречаемости у больных с инфильтративными формами ТБ легких. При инфильтративном ТБ легких без распада при 80,0% встречаемости ПТАТ свободно циркулирующих в сыворотке крови, ПТАТ обнаруживаются в составе ЦИК до 60,0%.
Как мы отметили, определенное несоответствие выявлено при анализе изменения сравниваемых показателей у больных с однотипными формами ТБ легких (инфильтративный ТБ легких без распада) при моноинфекции М. tuberculosis и в группе сочетанного инфицирования М. tuberculosis и ВИЧ.
В случае сочетанного инфицирования при высокой частоте встречаемости свободно циркулирующих ПТАТ (до 80% случаев), мы также обнаружили их в составе ЦИК у 60% больных. Если сопоставить эти результаты с полным отсутствием ЦИК, содержащих ПТАТ у больных инфильтративным ТБ легких также без распада в случае изолированного течения инфекции без ВИЧ, то следует предположить возможность того, что элементы генерализации инфекции М. tuberculosis на фоне ВИЧ инфицирования наступают на самых ранних стадиях заболевания. То есть, рентгенологическая картина инфильтративного ТБ легких у больных сочетанного инфицирования ВИЧ и М. tuberculosis не отражала истинного состояния, не идентифицируя элементов распада легочной ткани. Оптимальными формами ТБ процесса для образования специфических ЦИК были диссеминированные и генерализованные формы, при которых перефирическая кровь содержала в достаточном количестве не только ПТАТ, но и антиген M. tuberculosis в доступной для образования ЦИК форме.
Таким образом, метод ИФА с определением ПТАТ в сыворотке крови в комплексе с определением специфических ЦИК позволяет выявлять ранние стадии распада и генерализации процесса, особенно в случаях сочетанного инфицирования ВИЧ/ТБ.
