Актуальность проблемы. Лекарственно-индуцированные поражения печени (ЛИПП) при лечении туберкулеза заслуживают особого внимания в связи с тем, что в последние десятилетия наблюдается рост заболеваемости туберкулезом и распространение его не только среди асоциальных слоев общества как в мире [1], так и в Российской Федерации [2]. А также широкое распространение лекарственно-устойчивых форм микобактерий туберкулеза (МБТ), достигающее в последние годы 47,5–54,2% [3], что вынуждает фтизиатров назначать одновременно несколько противотуберкулезных препаратов, при том, что все они в той или иной степени гепатотоксичны и назначение их в комбинации усиливает этот эффект. Следствием такого положения является частое (до 70%) развитие поражений печени и гепатобилиарного тракта, что обусловлено различными факторами (воздействием туберкулезной интоксикации; длительным приемом гепатотоксичных туберкулостатических препаратов хроническим алкоголизмом, употреблением наркотиков, наличием сопутствующих заболеваний) [4]. Данные о гепатотоксичности противотуберкулёзных препаратов достаточно противоречивы, поскольку это свойство связано не только с химическим строением препарата, но и с особенностями метаболических возможностей печени каждого больного, величиной печёночного кровотока, уровнем развития портокавальных анастомозов, степенью связывания препаратов белками плазмы [5]. Важной задачей в профилактике лекарственного гепатита, возникающего на фоне противотуберкулезной терапии (ПТТ), является применение фармакологической коррекции до возникновения его клинических проявлений, что невозможно без определения времени начала изменений биохимических показателей крови – маркеров цитолиза гепатоцитов. Учитывая высокую распространенность лекарственно-индуцированных поражений печени, разработка методов их профилактики и лечения является актуальной научной проблемой.
Цель исследования. Разработать современный комплексный метод мониторинга состояния печени у больных туберкулезом легких, получающих специфическую терапию. Исследовать гепатопротекторную активность таурина, и разработать рекомендации по профилактике и лечению лекарственно-индуцированных поражений печени.
Дизайн исследования:
Первый этап: ретроспективное исследование: была изучена первичная медицинская документация 250 пациентов с туберкулёзом лёгких, получавших лечение в ГКУЗ «Волгоградский областной клинический противотуберкулезный диспансер» (ВОКПД).
Второй этап: сравнительное проспективное исследование в параллельных группах: в клиническом исследовании приняли участие 50 пациентов с туберкулезом легких, получающих специфическую терапию по 1 режиму. Контрольную группу составили 30 здоровых лиц сопоставимых по полу и возрасту.
Третий этап: сравнительное проспективное исследование в параллельных группах: в клиническом исследовании приняли участие три группы пациентов по 20 человек с туберкулезом легких, получающих специфическую терапию по 1 режиму и дополнительно гепатопротекторные, антиоксидантные препараты или их комбинацию. Группу сравнения составили 20 больных туберкулезом, получающих специфическую терапию по 1 режиму, не получающих дополнительных гепатопротекторных средств, не отличающихся по полу и возрасту.
Материалы и методы. Для постановки диагноза гепатита и оценки функционального состояния печени применялся комплекс лабораторных исследований, включающий общий клинический анализ крови, общий анализ мочи, биохимические тесты: количественное определение общего билирубина и его прямой фракции, определение активности аланинаминотрансферазы (АлАТ), аспартатаминотрансферазы (АсАТ), щелочной фосфотазы (ЩФ), холестерина, триглицеридов (ТГ), концентрации белка и др. У всех больных методом иммуноферментного анализа (ИФА) определялись основные маркеры вирусных гепатитов. Обязательным условием включения пациента в исследование являлось отсутствие злоупотребления алкоголем в анамнезе и отрицательные результаты анализов на маркеры вирусных гепатитов. Оценивалась длительность пребывания больного в стационаре, выделение микобактерий после окончания курса химиотерапии. Переносимость лечения учитывалась при ежедневном опросе пациентов.
Статистическая обработка данных проводилась с помощью пакета статистических программ «Statistica 6.0 для Windows» с использованием непараметрического метода анализа с коэффициентом корреляции Спирмена [6,7].
Результаты ретроспективного анализа (I этап). На данном этапе были проанализированы истории болезни 250 пациентов с туберкулезом легких, находившихся на лечении в ВОКПД в 2007-2008 г., с отрицательными результатами анализов на маркеры вирусных гепатитов и не злоупотребляющие алкоголем по анамнезу. Среди них 165 мужчин (66%) и 85 женщин (34%). Возраст больных от 15 до 73 лет (средний 38,9±6,6 лет). Преобладали пациенты с впервые выявленным туберкулезом легких, ранее не получавшие противотуберкулезные препараты – 231 пациент (92,4%).
В зависимости от формы процесса и чувствительности микобактерии туберкулеза (МБТ) к антибактериальным препаратам больные получали лечение по стандартным режимам химиотерапии: 1-й режим (изониазид, рифампицин, этамбутол, пиразинамид) – 166 человек (66,4%), 2а режим (изониазид, рифампицин, этамбутол, пиразинамид, стрептомицин) - 12 человек (4,8%), 2б режим (изониазид, рифампицин, этамбутол, пиразинамид + протионамид/ капреомицин + канамицин/ фторхинолон) – 52 человека (20,8%), 3-й режим (изониазид, рифампицин, этамбутол, пиразинамид ) – 8 человек (3,2%), 4-й режим (этамбутол, пиразинамид, протионамид, капреомицин + канамицин/ фторхинолон/ рифабутин/ циклосерин/ ПАСК) – 12 человек (4,8%).
Функциональные показатели оценивались ежемесячно по данным биохимических анализов крови (АлАТ, АсАТ, общий билирубин, тимоловая проба), входящих в стандарт обследования больных туберкулезом легких. Были выявлены достоверные гендерные различия в скорости развития цитолитического синдрома. Так, вне зависимости от схемы лечения у женщин наблюдался более выраженный подъем уровня АлАТ за первый месяц терапии - на 60%, при этом, у мужчин подъем составил 30% от исходного уровня. Уровень АсАТ у женщин повысился на 28,5%, у мужчин – на 21%. Тимоловая проба возросла у женщин – на 22,8%, у мужчин – на 12,8%.
Оценивалась также разновидность поражения печени на основании расчета коэффициента R (cоотношение АлАТ/ЩФ). При 1 и 2-м режимах терапии преобладали гепатоцеллюлярные типы поражения печени (при значениях коэффициента R>5). При третьем режиме терапии преобладали комбинированные типы поражения печени (2<R<5). При четвертом режиме – холестатические (R<2).
В результате ретроспективного анализа было установлено, что для профилактики цитолиза гепатоцитов необходимо учитывать динамику аланинаминотрансферазы, аспартатаминотрансферазы, особенно, в первые 2 месяца от начала терапии, независимо от применяемого режима, что согласуется с литературными данными [2]. Показатели тимоловой пробы не информативны. Уровень общего билирубина наиболее значимо повышается к пятому месяцу.
Результаты проспективного исследования (II этап). В представленном клиническом исследовании приняло участие 50 больных туберкулезом легких (35 мужчин и 15 женщин), получающих специфическую терапию, средний возраст которых составил 39,7 лет. Все больные получали химиотерапию по первому режиму (в соответствии с приказом МЗ РФ № 109) (изониазид – 0,6 г/сут; рифампицин – 0,45 г/сут; этамбутол – 1,2 г/сут и пиразинамид – 1,5 г/сут) в течение месяца. Контрольную группу составили 30 здоровых лиц – добровольцев (18 мужчин и 12 женщин), средний возраст которых составил 36,9 лет. Все протоколы исследования проходили экспертизу в этическом комитете.
Перед началом проспективного исследования, нами был проведен корреляционный анализ взаимозависимости биохимических маркеров у здоровых лиц и больных туберкулезом легких перед началом химиотерапии.
При анализе корреляционных зависимостей в группе здоровых лиц установлено, что все изученные биохимические показатели, кроме АсАТ и АлАТ, абсолютно не связаны друг с другом, а АсАТ и АлАТ имеют умеренную положительную взаимосвязь (r=0,626). C учетом представленной ниже регрессионной модели, из рутинных биохимических тестов, для лабораторного контроля проводимой терапии с удовлетворительной точностью можно использовать только показатели АсАТ и АлАТ.
Таблица 1. Динамика биохимических показателей до и после лечения по режиму 1 в сравнении со здоровыми лицами.
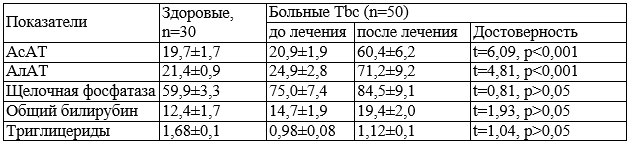
Был проведен анализ динамики биохимических показателей до и после химиотерапии по режиму 1. У больных туберкулезом легких до начала терапии в сравнении со здоровыми лицами было установлено превышение уровней АсАТ в 1,16 раза и щелочной фосфатазы в 1,25 раза. На фоне специфической терапии достоверным изменениям подверглись только уровни трансаминаз: уровень АсАТ достоверно повысился в 2,85 раза, АлАТ – 2,89 раза, изменения других биохимических показателей были статистически не значимыми (см. табл. 1). Повышенные уровни трансаминаз были выявлены у 34 пациентов, что составило 68%.
При анализе динамики показателей коагулограммы до и после лечения по режиму 1 в сравнении со здоровыми лицами, было установлено незначительное превышение в 1,1 раза уровней протромбинового индекса (ПТИ) и международного нормализованного отношения (МНО) у больных туберкулезом легких (см. табл. 2).
По окончании курса терапии уровень ПТИ и МНО снизились недостоверно. Наиболее достоверным было изменение показателя активированного частичного тромбопластинового времени (АЧТВ), изменение которого на 17,6 % при низкой вариации (12%) и доверительном интервале (1,9) можно считать наиболее значимым для мониторинга лечения.
Результаты III этапа исследования (клиническая часть). На данном этапе исследования было обследовано 80 больных туберкулезом легких (56 мужчин и 24 женщины), получающих специфическую терапию, средний возраст которых составил 39,7 лет. В фазе интенсивной терапии все больные получали химиотерапию по первому режиму (в соответствии с приказом МЗ РФ № 109) (изониазид – 0,6 г/сут; рифампицин – 0,45 г/сут; этамбутол – 1,2 г/сут и пиразинамид – 1,5 г/сут). Все протоколы исследования проходили экспертизу в этическом комитете.
Таблица 2. Динамика показателей коагулограммы до и после лечения по режиму 1 в сравнении со здоровыми лицами.

Наиболее часто нежелательные побочные эффекты вызывали рифампицин (19,7%) и изониазид 15,1%. Большинство нежелательных реакций на противотуберкулезные препараты возникало на первом и втором месяцах лечения. Это связано с адаптацией организма к вводимым лекарствам и с тем, что инфильтративная фаза туберкулезного процесса сама по себе является стадией аллергической настроенности организма, способствует неспецифической сенсибилизации к применяемым химиопрепаратам. Основными жалобами пациентов после начала химиотерапии 1 режима были: тошнота, рвота, боли в животе. Данные побочные явления не потребовали отмены лекарственной терапии.
Итак, больные, страдающие туберкулезом легких, получают стандартную противотуберкулезную терапию с интенсивной фазой в течение 2-3-х месяцев. Необходимо учитывать, что большинство пациентов данной категории находятся в состоянии тяжелой интоксикации, истощения функциональных и метаболических резервов организма, что часто приводит к осложнениям терапии. Однако, существующие стандарты химиотерапии не включают гепатопротекторы. В связи с этим представлялось важным оценить эффективность антиоксидантов и гепатопротекторов в лечении и профилактике лекарственных поражений печени. Для этого были набраны три группы больных, получавшие в течение трех месяцев в дополнение к стандартной противотуберкулезной терапии средства, улучшающие метаболизм и трофику тканей печени. I группу составили 20 больных Tbc в возрасте от 20 до 62 лет, из которых 9 женщин и 11 мужчин, дополнительно получавшие в течение 3-х месяцев таурин (Дибикор (ПИК-Фарма ООО, Россия)) 500 мг 2 раза в день в течение месяца. II группу составили 20 больных Tbc в возрасте от 18 до 64 лет, из которых 4 женщины и 16 мужчин, дополнительно получавшие в течение 3-х месяцев урсодеоксихолевую кислоту (Урсосан (PRO.MED.CS Praha a.s., Чешская республика)) 250 мг 2 раза в день. III группа – 20 больных Tbc в возрасте от 18 до 59 лет, из которых 7 женщин и 13 мужчин, дополнительно получавшие комбинацию таурина и урсодеоксихолевой кислоты в тех же дозах и также в течение 3-х месяцев. IV группу (сравнения) составили 20 больных туберкулезом легких, сопоставимых по полу и возрасту (в возрасте от 18 до 60 лет, из которых 4 женщин и 16 мужчин) не получавших гепатопротекторных средств в дополнение к стандартной противотуберкулезной терапии.
Учитывая, что на первом этапе данного исследования было выявлено, что на фоне лечения туберкулеза легких при любых режимах химиотерапии отмечается достоверное увеличение маркеров цитолиза со второй по восьмую недели от начала терапии, представлялось важным определить роль сроков проведения превентивных мероприятий. Для этого каждая из исследуемых групп была разделена на две подгруппы по 10 пациентов. Больным из подгрупп Iа, IIа, IIIа дополнительные гепатопротекторные средства назначались одновременно со специфической терапией. В подгруппы Iб, IIб, IIIб были набраны пациенты уже получающие специфическую противотуберкулезную терапию в течение 2 - 8 недель с уже развившимся лекарственно-индуцированным поражением печени.
Таблица 3. Влияние таурина и урсодеоксихолевой кислоты на динамику АсАТ и АлАТ у больных туберкулезом легких на фоне специфической противотуберкулезной терапии.
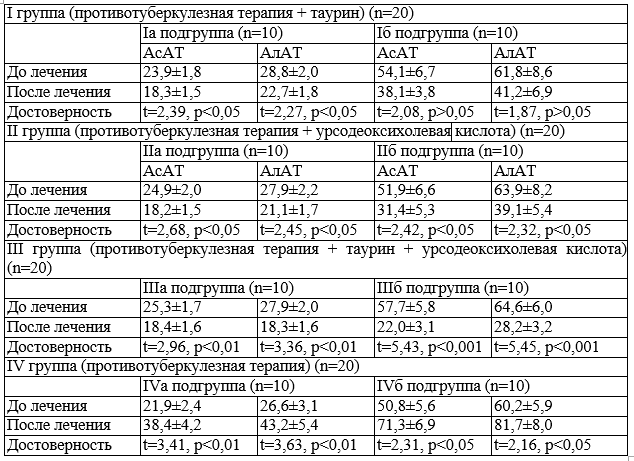
Для оценки эффективности гепатопротекторной терапии необходимо было выделить показатели, наилучшим образом отражающие динамику состояния печени при специфической терапии туберкулеза. Проспективное исследование на II этапе данной работы методом регрессионного моделирования показало, что для лабораторного контроля проводимой терапии из рутинных биохимических тестов удовлетворительной точностью обладают только динамические изменения АсАТ и АлАТ. Результаты исследования представлены в табл. 3.
Из табл. 3 видно, что в подгруппах профилактики, получающих одновременно со специфической терапией гепатопротекторные или антиоксидантные препараты, лекарственное повреждение печени удается предупредить: уровень АлАТ и АсАТ достоверно снижается (р<0,05), комбинированное назначение этих средств обладает наибольшей эффективностью (р<0,01).
Лечение развившегося цитолитического синдрома менее эффективно, чем его профилактика.
Уровень АлАТ и АсАТ на фоне явлений поражения печени при лечении таурином удается снизить незначительно (р>0,05), урсодеоксихолевая кислота обладает достаточной эффективностью (р<0,05), однако наилучшие результаты дает назначение комбинации гепатопротектора с антиоксидантом. В тоже время в группе сравнения без гепатопротекции негативное влияние специфической терапии на клетки печени продолжает нарастать, наблюдается значительный подъем уровня изучаемых ферментов, что привело к вынужденной отмене противотуберкулезной терапии.
Выводы:
1. Лекарственное поражение печени было выявлено у 68% больных туберкулезом легких, получающих специфическую терапию.
2. Для лабораторного контроля безопасности проводимой химиотерапии туберкулеза легких целесообразно исследование уровней АсАТ и АлАТ, т.к. другие «рутинные» показатели – малоинформативны.
3. Необходимо проводить превентивные мероприятия, с целью снижения гепатотоксических реакций, с учетом сроков появления цитолитического синдрома (2-3 недели). Оптимально одновременное со специфической терапией назначение гепатопротекторных средств. Лечение развившегося цитолитического синдрома менее эффективно, чем его профилактика.
4. Для профилактики лекарственного поражения печени достаточно назначения стандартных доз антиоксидантов (например, таурина) или гепатопротекторов (урсодеоксихолевой кислоты), наибольшей эффективностью обладает их комбинация. 5. Для лечения развившегося цитолитического синдрома необходимо назначение комбинации гепатопротекторов с антиоксидантами.
