Введение. Проблема гиперактивного мочевого пузыря (ГАМП) является одной из актуальных для урологов, гинекологов, неврологов, врачей общей практики. Симптомы ГАМП наблюдают примерно у 100 млн. человек в мире, наибольшую часть в возрасте до 60 лет составляют женщины [1,5]. Значительный интерес представляют неврологические аспекты патогенеза ГАМП. Так, тревога и депрессия, вызывающая недостаточность серотонинэргических и норадреналинэргических структур центральной нервной системы, уменьшают количество серотонина в сегментарных центрах мочеиспускания. Именно это способно снижать симпатический рефлекс наполнения и удержания мочи в мочевом пузыре и вызывать расторможенность парасимпатического рефлекса его опорожнения с дисбалансом вегетативных регуляторных механизмов при пустом и наполненном пузыре [2]. На сегодняшний день в литературе существует небольшое количество работ, рассматривающих роль вегетативной нервной системы (ВНС) в рамках симптомокомплекса ГАМП [2,7,8]. Впервые метод кардиоинтервалографии (КИГ) при заболеваниях с нарушением функции мочеиспускания был предложен для оценки состояния вегетативной нервной системы у детей с ночным энурезом [9]. В дальнейшем Blanc F. et al. (2001) [7] провели КИГ у женщин со стрессовой, смешанной и ургентной инконтиненцией в покое, выяснив, что общая вариабельность ритма сердца ниже при ургентном недержании. Следующим шагом в функциональной оценке ВНС при ГАМП были исследования K. Hubeaux et al. (2007) [8], которые изучили КИГ при пустом мочевом пузыре и в момент искусственного заполнения мочевого пузыря у 7 женщин со стрессовым недержанием и у 3 пациенток с ГАМП. У первых не наблюдалось изменения показателей, в то время как при ГАМП отмечалась повышение симпатической активации в конце заполнения мочевого пузыря, что являлось, по мнению исследователей отражением тревоги во время удержания мочи. Все вышесказанное говорит об актуальности изучения этого вопроса и необходимости разработки новых современных патогенетически обоснованных методик лечения этой категории больных.
Цель исследования. Разработать и научно обосновать методики коррекции вегетологических нарушений у женщин, страдающих гиперактивным мочевым пузырем, на этапе санаторно-курортного лечения.
Материалы и методы. Под наблюдением находились 90 женщин с идиопатическим гиперактивным мочевым пузырем. Всем пациенткам проводили базовое обследование для исключения урологических заболеваний, способных вызвать ургентное и учащенное мочеиспускание: клинический анализ мочи, включающий исследование физических, химических свойств мочи и исследование осадка мочи, для исключения признаков воспаления в стенке мочевого пузыря, почках, инфекции нижних мочевыводящих путей, ультразвуковое сканирование почек и мочевого пузыря и уретроцистоскопию для исключения мочекаменной болезни и опухолей мочевого пузыря, урофлоуметрию для измерения скорости мочеиспускания. На этапе отбора для исследования мы исключили из дальнейшего анализа больных с инфекционно-воспалительными заболеваниями мочевых и половых органов.
Больные были проконсультированы врачом-неврологом. При оценке неврологического статуса обращали внимание, прежде всего, на чувствительную сферу, двигательную активность, вегетативный статус, психоэмоциональное состояние. Кардиоинтервалография была проведена 60 пациенткам с ГАМП (по 20 человек из каждой группы). Исследования проводили при функциональной нагрузке на мочевой пузырь. Состояние вегетативной нервной системы оценивали на основании анализа вариабельности сердечного ритма (ВСР) с использованием диагностического автоматизированного комплекса ЭЭГА-21-26 «Энцефалан-131-03» (Россия, НПКФ «Медиком МТД», г. Таганрог), регистрируя кардиоинтервалы в одном из стандартных отведений в положении лёжа на спине (фоновая проба - ФП) и стоя (активная ортостатическая проба - АОП, активный тилт-тест). По данным спектрального анализа ВСР определялись следующие показатели: высокочастотные колебания (HF%) частотой 0,15-0,40 Гц, отражающие активность парасимпатического кардиоингибиторного центра продолговатого мозга (колебания парасимпатического отдела ВНС); низкочастотные колебания (LF%) частотой 0,04-0,15 Гц, отражающие активность симпатических центров продолговатого мозга (кардиостимулирующего и вазоконстрикторного), реализующиеся через влияния симпатической и парасимпатической нервной системы, но преимущественно за счёт импульсов от верхнего грудного (звёздчатого) симпатического ганглия; очень низкочастотные колебания (VLF%) частотой 0,003-0,04 Гц, отражающие активность центральных эрготропных и гуморально-метаболических механизмов регуляции сердечного ритма, реализующиеся через изменения содержания в крови гормонов; коэффициент LF/HF - отношение мощности волн низкой частоты к мощности волн высокой частоты; ТР (общая мощность спектра), отражающая суммарный эффект воздействия на сердечный ритм всех уровней регуляции [6]. Количественно адаптационные и реабилитационные возможности организма оценивали по характеру вегетативной реактивности и общему уровню вегетативного обеспечения до и после проведения лечебных комплексов.
Изучена эффективность 3-х лечебных комплексов: больные 1-й группы (30 чел.) получали углекислые минеральные ванны температурой 36-37°С, продолжительностью 10-15 минут, на курс 8 процедур и грязевые аппликации на трусиковую зону температурой 38-40°С, продолжительностью 15 минут, на курс 8 процедур; больные 2-й группы (30 чел.) получали бальнеопелоидотерапию по вышеописанной методике и М-холиноблокатор «Спазмекс» по 15 мг 1 раз в день перед сном в течение всего курса лечения; пациенты 3-й группы (30 чел.) получали бальнеопелоидо- и медикаментозную терапию по вышеописанной методике и физиотерапевтическое воздействие методом глубокой осцилляции от аппарата «Хивамат-200» на проекцию мочевого пузыря с автоматическим переключением частот от 160 до 15 Гц, продолжительностью 15 минут, на курс 10 процедур. Общим для всех комплексов был лечебный режим, рациональное питание и внутренний приём углекисло-гидрокарбонатно-сульфатной натриево-кальциевой воды малой минерализации (3,6-3,7 г/л) из расчета 3-5 мл на килограмм массы тела 3 раза в день за 40-45 минут до еды.
Статистическая обработка данных проводилась с применением программных пакетов «Statistica» 6,0 версии. Уровень значимости различий между связанными выборками при соблюдении условий нормальности распределения и равенства дисперсий определялся с помощью критерия Стьюдента. Качественные показатели анализировались по критерию углового преобразования Фишера. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05.
Результаты. В урологическом отделении Железноводской клиники под наблюдением находились 90 женщин в возрасте от 30 до 55 лет, в среднем, 43,4±3,2 года. Средний возраст дебюта заболевания различался в возрастных группах: у женщин 30-39 лет он составил 34,9±2,7 года, среди пациенток 40-49 лет - 42,2±3,4 года, у женщин 50-55 лет средний возраст начала заболевания составил 48,8±3,8 лет. Длительность заболевания была от 2 до 8 лет, составив в среднем 4,6±2,2 года. Таким образом, пик заболеваемости ГАМП у женщин оказался в возрастном периоде от 42 до 48 лет, т.к. в этом возрасте у женщин происходит угасание менструальной функции [1,4]. Происходящие в этот период процессы гормональной перестройки оказывают влияние на функцию нижних мочевых путей, повышая чувствительность рецепторов мочевого пузыря, что является, по нашему мнению, одним из «пусковых факторов» развития ГАМП, что совпадает с литературными данными [1,4,5].
Все женщины были опрошены относительно возможной причины развития симптомов ГАМП. Пациентка могла назвать только одну, по ее мнению, основную причину заболевания. Из 90 больных 36 (40%) не смогли связать развитие ГАМП с какой-либо одной определенной причиной. В порядке убывания частоты причины развития ГАМП у женщин представлены следующим образом: наступление менопаузы - у 21 (23,3%) пациентки, роды - у 15 (16,7%) пациенток, опущение тазовых органов - у 10 (11,1%) пациенток, перенесенные инфекции мочевых путей — у 8 (8,9%) пациенток.
При подробном опросе выяснилось, что у 40 (44,4%) пациенток дебют заболевания совпал по времени с некоторыми проявлениями вегетативной дисфункции, по поводу которой женщины обращались за медицинской помощью к неврологу. Среди особенностей течения заболевания отмечен ремитирующий характер в половине наблюдений. Заслуживает внимания тот факт, что обострение заболевания в 57,7% связано с психотравмирующими ситуациями. При этом пациентки отмечали, что в определенных благоприятных социальных условиях (дома, на отдыхе, при выполнении интересного занятия) ургентные позывы или учащенное мочеиспускание отсутствовали.
При анализе жалоб больных с ГАМП была выделена группа основных клинических симптомов, свидетельствующих о патологии вегетативной нервной системы, динамика которых под влиянием различных лечебных комплексов представлена в табл. 1.
Таблица 1. Динамика клинической симптоматики, свидетельствующей о дисфункции вегетативной нервной системы у больных с гиперактивным мочевым пузырем, под влиянием различных лечебных комплексов
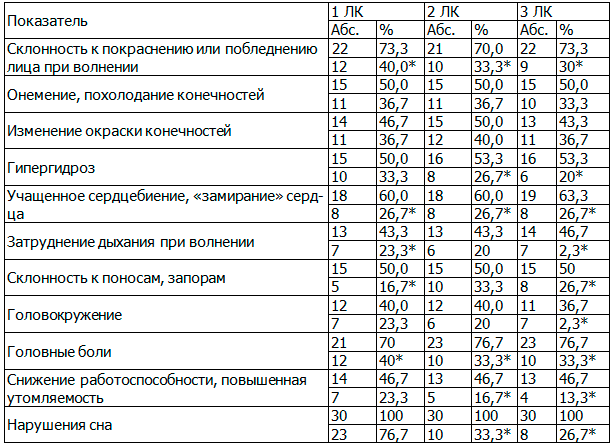
Примечание: здесь и далее в числителе показатели до лечения, в знаменателе – после лечения, *р<0,05.
Как следует из представленных в табл. 1 данных, головные боли перестали беспокоить 42,8% (р<0,05) женщин 1-й, 56,5% (р<0,05) 2-й и 3-й групп, головокружения после лечения не отметили 41,7%, 50% и 36,4% пациенток соответственно, на снижение работоспособности, повышенную утомляемость перестали жаловаться 50%, 61,5% (р<0,05) и 69,2% (р<0,05) пациенток соответственно, жалобы на учащенное сердцебиение перестали предъявлять 55,5% (р<0,05) пациенток 1-й и 2-й групп и 57,8% (р<0.05) 3-й группы, нормализация сна отмечена у 23,3%, 66,7% (р<0,05) и 73,3% (р<0,05) женщин соответственно.
Разнообразные клинические проявления вегетативной дисфункции у больных с ГАМП послужили основанием для проведения анализа вариабельности сердечного ритма у изучаемых больных. Кардиоинтервалография была проведена 60 пациенткам с ГАМП (по 20 пациенток из каждой группы). Исследования проводили при функциональной нагрузке на мочевой пузырь. Так, при исследовании исходного текущего функционального состояния в покое у больных выявлено снижение значимости сегментарных механизмов в регуляции тонуса с компенсаторным напряжением надсегментарных. У женщин с ГАМП в покое в положении лежа наблюдалась выраженная симпатикотония за счет преобладания надсегментарных влияний VLF, сегментарных LF с соответственным повышением симпатико-парасимпатического индекса (табл. 2). Таким образом, можно сделать вывод о том, что при ГАМП даже незначительная водная нагрузка на мочевой пузырь может восприниматься как значимый физиологический стресс, сопровождающийся адаптацией в виде симпатических влияний. Это совпадает с данными исследований ряда авторов, доказавших, что нормальной адаптивной реакцией на физиологическое наполнение мочевого пузыря является увеличение парасимпатической активации [2].
Таблица 2. Динамика вегетативных показателей по данным вариационной пульсометрии и спектрального анализа под влиянием различных лечебных комплексов
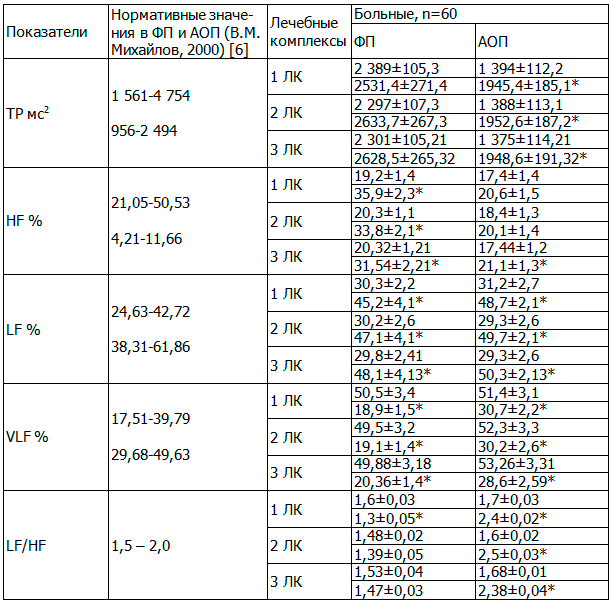
После курсового лечения общая спектральная мощность ТР увеличилась в 0,9 раза у пациенток всех лечебных групп. Вклад волн HF диапазона достоверно увеличился в 1,9, 1,7 и 1,5 раза соответственно, снизился вклад волн VLF в 2,7, 2,6 и 2,4 раза соответственно (p<0,05). Проведение АОП сопровождалось повышением по сравнению с исходными данными общей спектральной мощности ТР в 0,7 раза (р<0,05) у женщин трех групп и процентного вклада волн HF диапазона в 1,2 раза, что указывает на положительную динамику под влиянием всех лечебных комплексов. Снижение коэффициента LF/HF в фоновой пробе в 1,2 раза в 1-й группе, 1,1 раза во 2-й и 3-й позволяет говорить о благоприятной динамике в отношении восстановления баланса между разными отделами ВНС (табл. 2). Таким образом, после проведенного лечения во всех изучаемых группах мы выявили увеличение значимости сегментарных механизмов и соответственное уменьшение напряженности надсегментарных в обеспечении деятельности.
После лечения отмечено снижение у 30,8% женщин 1-й группы, 46,2% пациенток – 2-й и у 50% больных 3-й группы симпатического типа регуляции ВНС (р<0,05) за счет увеличения числа больных с сохраненным балансом отделов вегетативной нервной системы (р<0,05) (табл. 3).
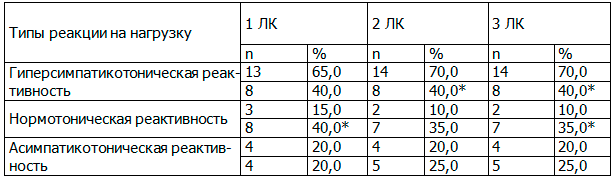
Таблица 3. Динамика текущего функционального состояния у больных с гиперактивным мочевым пузырем под влиянием различных лечебных комплексов

При проведении АОП прослежена та же тенденция – гиперсимпатикотоническая реактивность перестала быть преобладающим типом реакции на нагрузку у 38,5% женщин 1-й группы и у 42,98% пациенток 2-й и 3-й групп (табл. 4).
Таблица 4. Динамика вегетативной реактивности больных с гиперактивным мочевым пузырем под влиянием различных лечебных комплексов
Заключение. Таким образом, в результате лечения во всех терапевтических группах отмечена тенденция к улучшению вегетативных показателей, субъективной оценки пациентками своего состояния. Это объясняется тем, что больные, находясь в условиях санаторно-курортного учреждения, подвергались влиянию всей суммы лечебных факторов: бальнеопелоидотерапия, диетическое питание, длительное пребывание на воздухе, положительное воздействие ландшафта, активный двигательный режим (чередование покоя и дозированного движения, прогулки, экскурсии). Также бесспорна ведущая роль углекислого газа в перестройке вегетативной регуляции сердечно-сосудистой системы, обусловленная его действием (рефлекторным и непосредственным) на центры вегетативной регуляции [3]. В свою очередь, физиотерапевтическое воздействие методом глубокой осцилляции от аппарата «Хивамат-200» на проекцию мочевого пузыря позволило статистически достоверно улучшить клиническую симптоматику, свидетельствующую о дисфункции вегетативной нервной системы, у женщин с ГАМП.
