Актуальность
Патогенез ХОБЛ на современном уровне знаний рассматривается в рамках мультифакториальной модели, учитывающей генетические, экологические, поведенческие, иммунопатологические факторы. Недостаточное внимание уделяется, особенно в отечественной литературе, влиянию гормонального статуса на течение бронхолегочной патологии. В рамках этой модели можно рассматривать гипогонадизм как один из факторов, воздействующих на патогенез ХОБЛ, поскольку гипогонадное состояние ухудшает течение заболевания, по сравнению с больными без гипогонадизма.
По данным Makarevich A.E. [12], Karadag F. [11], Svartberg J. [14], степень дыхательной недостаточности у больных с обструктивной болезнью легких (ХОБЛ) была обратно пропорциональна уровню тестостерона.
Низкий уровень тестостерона у мужчин следует рассматривать как один из компонентов метаболического синдрома [1].
Тот факт, что у пациентов с андрогенодефицитом был больше индекса массы тела, чем у пациентов без андрогенодефицита можно объяснить несколькими механизмами. Во-первых, у мужчин, тестостерон стимулирует липолиз, вызывая увеличение свободных жирных кислот из релиза висцеральных жировых депо [3]. Во-вторых, низкий уровень тестостерона у мужчин, как правило, связан с увеличением жира в брюшной полости[15]. В-третьих, еще один механизм, который может способствовать увеличению массы тела у пациентов с гипогонадизмом это состояние лептинорезистентности [8]. Действуя на гипоталамус, лептин может подавлять прием пищи и стимулирует расход энергии [6].
Наиболее тяжело пациенты с ХОБЛ переживают утрату трудоспособности, что сопровождается чувством беспомощности, ненужности обществу и близким. Болезнь вызывает ощущение стыда, отчаяния и страха перед будущим, приводит к развитию депрессии и тревоги [5]. Распространенность депрессии среди пациентов с ХОБЛ составляет от 12 до 50%, что значительно выше, чем в общей популяции (не более 5%). У больных ХОБЛ чаще наблюдается тревожный синдром (20—50%, по разным источникам) в сравнении с населением в целом (не более 15%) [4, 9, 10]. При этом, тяжесть депрессивного и тревожного синдромов напрямую связана со снижением толерантности к физической нагрузке и ухудшением качества жизни [7]. Свой вклад в усугубление течения депрессии вносит возрастное снижение уровня тестостерона [2, 13].
В настоящее время выявлена связь между уровнем тестостерона и депрессии [13]. Снижение уровня андрогенов прогрессирует с возрастом и связано с наличием таких симптомов, как усталость, низкий уровень либидо и др., а также депрессией, которая достоверно выше у больных с недостатком мужских половых гормонов [13].
На сегодняшний день у большинства специалистов не вызывает сомнений необходимость коррекции возрастного гипогонадизма.
Материалы и методы
В основную группу были включены 103 мужчины, страдающие хронической обструктивной болезнью лёгких II-III стадией с андрогенодефицитом, в возрасте от 42 до 62 лет (средний возраст составил 52±10 лет). В контрольную группу было включено 40 мужчин с хронической обструктивной болезнью лёгких II-III стадией в возрасте от 42 до 62 лет без андрогенодефицита.
Основанием для включения в исследование было наличие у больных анамнеза, характерного для ХОБЛ, типичных клинических симптомов заболевания. Наличие у больных среднетяжелой и тяжелой степени заболевания подтверждалось выраженностью клинических симптомов и оценки ФВД с обратимостью обструкции <12%.
Критериями исключения из исследования были: крайне тяжелая степень заболевания, обратимость обструкции >12%, бронхиальная астма, бронхоэктатическая болезнь, легочный туберкулез, облитерирующий бронхиолит.
Диагноз ХОБЛ устанавливался на основании типичной клинической картины, анамнеза, результатах рентгенологических исследований, данных спирометрии согласно критериям GOLD 2008 г. Уровень тестостерона в сыворотке определялся иммуноферментным методом.
Исследование андрогенного статуса включало лабораторное обследование с определением уровней в сыворотке крови общего тестостерона иммуноферментным методом. Для анализа использовалась проба крови, взятая в 9-11 ч. утра (время пика секреции половых гормонов).
Структура тревожно-депрессивных проявлений определялась с помощью шкалы самооценки тревоги Ч. Спилберга и шкалы Цунга для самооценки депрессии.
Статистическая обработка полученных результатов проводилась с помощью пакета прикладных программ STATISTICA 6.1. Показатели представлены как M±SD, где М - выборочное среднее, SD (standard deviation) – стантартное отклонение. Для анализа связей между изучаемыми признаками (корреляций) применяли метод Pearson.
Сравнение количественных показателей проводили с помощью теста Mann-Whitney(для независимых групп). Нулевую гипотезу отклоняли при p<0,05.
Результаты и обсуждение
По результатам исследования все больные были разделены на две группы. В первую группу вошли мужчины с ХОБЛ II степени тяжести и анрогенодефицитом (n=39), а во вторую мужчины, страдающие ХОБЛ III степени тяжести и анрогенодефицитом (n=22), в возрасте от 42 до 62 лет. В контрольную группу вошли пациенты с ХОБЛ II и III степени тяжести без анрогенодефицита (n=27 и n=15, соответственно). Таким образом, наличие андрогенодефицита, определенного с помощью иммуноферментного анализа, выявлены у 61 мужчины с ХОБЛ II и III степени тяжести (рис.1).
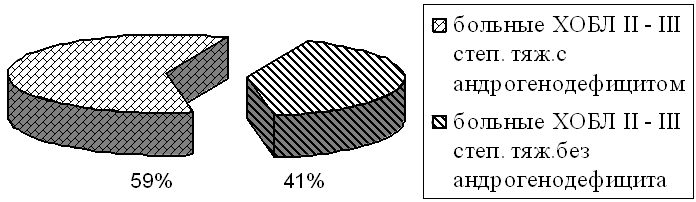
Рис.1. Частота выявления андрогенодефицита у обследованных больных.
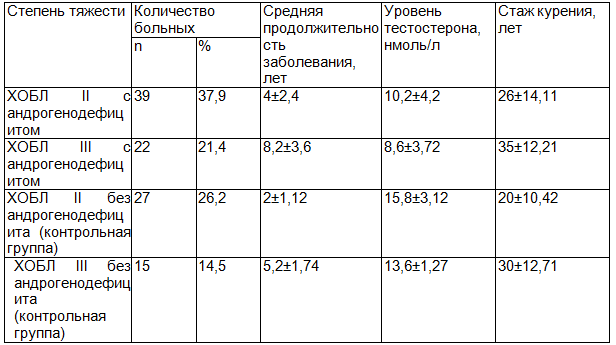
Средний уровень тестостерона для основной группы у больных с ХОБЛ II степени тяжести составил 10,2±4,2 нмоль/л, а больных с ХОБЛ III степени тяжести 8,6±3,72 нмоль/л, т.е. соответствует биохимическим критериям андрогенодефицита (согласно международным рекомендациям, снижение сывороточной концентрации тестостерона ниже 12 нмоль/л). В контрольной группе средний уровень тестостерона составил у больных с ХОБЛ II степени тяжести 15,8±3,12 нмоль/л, а больных с ХОБЛ III степени тяжести 13,6±1,27 нмоль/л. Распределение больных по группам приведено в табл. 1.
Таблица 1. Клиническая характеристика основной и контрольной групп обследованных больных
В ходе проведенного исследования установлена прямая корреляционная связь умеренной силы тестостерона с ОФВ1 и обратная – с частотой обострения хронической обструктивной болезни легких, длительностью заболевания, стажем курения, количеством выкуренных сигарет (пачка/день), шкалой Цунга и Спилберга. Результаты корреляционного анализа приведены в табл.2.
Таблица 2. Взаимозависимость уровня свободного тестостерона с клинико–лабораторными и инструментальными методами исследования

Выводы
1.Выявлено влияние уровня общего тестостерона в плазме крови на частоту обострения и степень тяжести хронической обструктивной болезни легких.
2. Тревожно-депрессивные состояния у пациентов с ХОБЛ средней и тяжелой степени тяжести и андрогенодефицитом более выражены, чем без него.
3. На уровень тестостерона непосредственно влияет длительность заболевания, стаж курения и количество выкуренных сигарет за сутки.
