Острые и хронические заболевания лёгких, являются одними из наиболее распространенных заболеваний. Смертность при лёгочной патологии занимает третье место, уступая сердечно-сосудистым и онкологическим заболеваниям. По данным ВОЗ в 2002г., более 10% всех госпитализаций с острой патологией связано с пневмониями. По данным Республиканского информационно - аналитического центра в Республике Узбекистан в 2003г. госпитализировался каждый второй больной пневмонией, больничная летальность от пневмоний составляет 2,97% [5]. В настоящее время получены убедительные данные об участии эндотелиальных факторов в развитии и прогрессировании кардиальной патологии, в то же время отмечается дефицит научной информации относительно роли эндотелия в механизмах развития легочных заболеваний, а именно при внебольничной пневмонии (ВП). Дальнейший научный поиск в данном направлении представляется перспективным в аспекте более глубокого понимания сосудистых звеньев патогенеза, разработки диагностическо-прогностических критериев этого заболевания и обоснованных лечебно-профилактических мероприятий.
Цель исследования. Изучение функционального состояния эндотелия и агрегатного состояния крови при внебольничных пневмониях.
Материал и методы исследования. Обследовано 98 больных с ВП на базе Республиканского научного центра экстренной медицинской помощи МЗ РУз. в возрасте от 15 до 59 лет (средний возраст – 39,7±5,64 года), мужчин было 44 (44,9%), женщин 55 (56,1%). Степень тяжести ВП оценивали по шкале Fine. Среди обследованных больных ВП преобладали лица молодого – 15-29 лет (35,7%) и среднего – 30-34 года (49,0%) возраста. В зависимости от метода лечения все обследуемые больные ВП были разделены методом случайной выборки на две группы: в первой (основной) группе, состоявших из 48 (49%) больных ВП проводили стандартную терапию с включением препарата N-ацетилцистеин (N-АЦЦ) в суточной дозе 600 мг фирмы «Гексал АГ», Германия. Вторую группу (сравнения) – составили 50 (51,0%) больных ВП получавших стандартное традиционное лечение. Контрольную группу составили 20 здоровых лиц давших информативное согласие на проведение клинико-лабораторных исследований – 10 (50%) мужчин и 10 (50%) женщин сопоставимого возраста – 43,3±5,2 лет. Дизайн исследования включал исходную оценку показателей (до лечения) и через 5-7 дней лечения. Для оценки функции эндотелия и агрегатного состояния крови использовали: определение концентрации основных метаболитов NO по методу П.П. Голикова и соавт [4], агрегационную активность тромбоцитов индуцированных АДФ (АТ-АДФ) по методу Born G. (1962) [2] и количество десквамированных циркулирующих эндотелиоцитов в венозной крови (ЦЭК) с использованием функциональной «манжеточной» пробы (МП) [2], основанной на оценке способности эндотелиальными клетками продуцировать биологически активные вещества, которые принимают непосредственное участие в поддержании сосудистого тонуса, атромбогенности сосудистой стенки, регуляции адгезии и агрегации тромбоцитов, участвуют в процессах бронходилатации, (преимущественно в крупных бронхах), сохранение бронхоальвеолярного тонуса, цилиарный транспорт, воспаление и иммунную защиту, проницаемость легочных капилляров, а также регулирует активность цитокинового каскада в бронхолегочной системе [3]. МП проводили в утренние часы, путем накладывания манжеты сфигмоманометра на плечо пациента, создавая в ней давление, превышающее систолическое на 10 мм рт. ст., в течение 5 мин. в условиях положения больного лежа на спине после 10-15 минутного отдыха. Все бронхо- и вазоактивные препараты отменяли за 12 часов до этого. Исследуемые показатели крови, характеризующие функцию эндотелия, оценивали до и после МП. Статистическая обработка полученных результатов производилась при помощи пакета программ Statistica version 6,0 2003. Показатели представлены в виде M±m. Достоверность различий оценивали с помощью критериев Стюдента и Вилконсона в зависимости от правильности распределения выборок. Межгрупповые различия определяли с помощью критерия Х2. Статистически значимыми считали различия при p<0,05.
Результаты и обсуждение. При оценке степени тяжести по шкале Fine преобладающее большинство больных 51 (52,0%) были отнесены к I классу, а остальные - 47 (48,0%) соответствовали II классу. Клиническое наблюдение в течение 5-7 дней лечения показало более эффективное купирование интоксикации во 2-й группе больных по сравнению с 1-й, где ремиссия снижения температуры тела наступала значительно раньше на 2,1±0,11 суток (р<0,01). Одновременно исчезли такие симптомы, как одышка у больных 2-й группы через 4,3±0,26 (р<0,05) суток, а в 1-й - через 5,7±0,29 суток, кашель – 5,3±0,25 (р<0,05) и 6,9±0,33 суток, выделение мокроты через 3,9±0,18 (р<0,01) и 4,8±0,25, озноб и головные боли 2,6±0,14 (р<0,05) и 3,7±0,15 суток, слабость – через 2,8±0,10 (р<0,01) и 4,2±0,23 суток, восстановилось давление, частота пульса до уровня контроля через 4,2±0,23 (р<0,01) и 5,5±0,27 суток, частота дыхания до 19,6±0,98 мин – через 3,3±0,18 (р<0,01) и 4,9±0,27 суток исчезновение хрипов через 3,8±0,16 (р<0,01) и 4,6±0,19 суток. Использование N-АЦЦ приводило к положительной динамике патологических процессов в легких (уменьшение кашля, улучшение отхождения мокроты, уменьшение количества хрипов в легких), что свидетельствовало о восстановлении эффективного мукоцилиарного клиренса у больных ВП и добиться снижения концентрации патогенных микроорганизмов в бронхоальвеолярной системе, улучшение основных показателей функции внешнего дыхания (ЖЕЛ и ОФВ1). Так, уже через 3-4 (в среднем 3,8±0,22) суток от начала терапии у пациентов первой группы показатели ЖЕЛ и ОФВ1 были существенно выше, чем во второй группе. Эта же тенденция динамики ЖЕЛ и ОФВ1 сохранилась и к концу 6-7 суток от начала лечения. К 5-7 суткам лечения у 46 (95,8%) больных первой группы показатели ЖЕЛ и ОФВ1 были в пределах контрольных значений, и у 39 (78,0%) больных второй группы (рис.1).
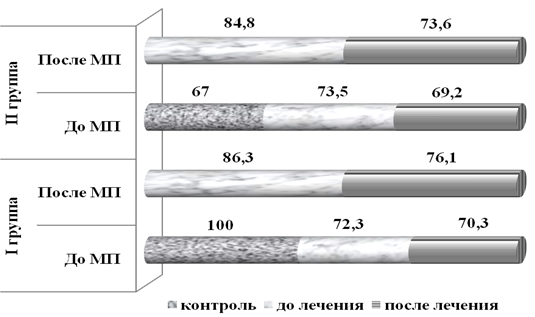
Рис. 1. Динамика показателей функции внешнего дыхания ЖЕЛ и ОФВ1 в исследуемых группах по сравнению с данными до лечения; * – р<0,05 по отношению ко 2 группе.
Следовательно, при комбинированной терапии N-АЦЦ больных ВП нормализация таких функциональных показателей, как ЖЭЛ и ОФВ1, а также других клинических показателей происходит быстрее, нежели при общепринятой терапии, несмотря на одинаковые условия проводимой антибактериальной терапии. Логично предположить, что высокая эффективность N-АЦЦ обусловлена наряду с муколитическими свойствами препарата его местным противовоспалительным и антиоксидантным действием, которое было продемонстрировано рядом зарубежных и отечественных исследователей [1,7]. При оценке эффективности N-АЦЦ в комплексной терапии на генерацию оксида азота в плазме крови и тромбоцитах у больных с внебольничной пневмонией показано, что после 5-7 суток терапии больных второй группы уровень основных стабильных метаболитов NO в плазме крови существенно снизился по сравнению с исходными данными. Одновременно повысилась резистентность эндотелия при действии нагрузочного теста с МП. Так, после лечения, у больных второй группы уровень NO статистически достоверно снизился в плазме крови на 11,5% (р<0,05), после МП на 72,8% (р<0,001). Вместе с тем, у больных первой группы уровень NO в плазме крови снизился на 21,1% (р<0,01), а после МП на 88,9% (р<0,001). У больных второй группы по сравнению с контролем уровень NO до МП превышал 13,1% (р<0,05), а после МП - на 20,0% (р<0,01), тогда как у больных первой группы показатель уровня NO как до МП, так и после был в пределах контрольных значений (рис. 2).

Рис. 2. Динамика уровня NO в плазме крови до и после МП у больных ВП при лечении их различными методами терапии по сравнению с контролем; * – р<0,05 по отношению к контролю; ∆ – р<0,05 по отношению к данным до МП; ** – р<0,05 по отношению к данным ко второй группе.
При исследовании содержания NO в тромбоцитах выявлено, что после лечения у больных ВП второй группы сохранялся его низкий уровень, даже после 5-7 дней традиционной терапии. У больных второй группы по сравнению с исходными данными (до лечения) концентрация NO в тромбоцитах статистически значимо повысилась на 12,5% (р<0,05), после МП на 36,1% (р<0,01). У больных первой группы после лечения на 7-е сутки уровень NO в тромбоцитах до МП по сравнению с исходными данными (до лечения) повысился на 25,1% (р<0,05), а после МП 64,3% (р<0,001). При оценке содержания ЦЭК в венозной крови при назначении в стандартную терапию N-АЦЦ больным с ВП показано, что после традиционной терапии на 5-7 сутки лечения в крови больных ВП второй группы все ещё сохранялось высокое содержание ЦЭК. Вместе с тем, по сравнению с исходными данными, их количество было снижено на 19,3% (р<0,05), а после МП на 27,5% (р<0,001). В тоже время, в первой группе больных содержание ЦЭК к этому сроку лечения снизилось на 32,8% (р<0,01), при исследовании этого показателя по сравнению с данными до лечения (исходные данные), а после МП на 52,9% (р<0,001) (рис.3).

Рис. 3. Динамика содержания ЦЭК в венозной крови до и после МП у больных ВП при лечении различными методами терапии по сравнению с контролем; * – р<0,05 по отношению к контролю; ∆ – р<0,05 по отношению до МП; ** – р<0,05 по отношению к данным II гр.
При изучении АДФ-АТ до и после МП на фоне стандартной терапии больных ВП наблюдалось существенное снижение показателя АДФ-АТ, который был ниже исходных данных (до лечения) – на 10,8% (р<0,05), а после МП на 26,5% (р<0,01). В тоже время, при назначении в базисную общепринятую терапию препарата N-АЦЦ показатель АДФ-АТ снизился на 23,2% (р<0,01), а после МП на 45,1% (р<0,001). У больных второй группы традиционная терапия не привела к восстановлению до уровня контроля исследуемый показатель, а у больных первой группы этот показатель на 7-е сутки лечения был в пределах контроля, что ассоциируется с повышением атромбогенности сосудистого эндотелия как в состоянии покоя, так и при физическом воздействии на эндотелий с помощью МП. Таким образом, проведенные исследования показали, что дополнительное назначение в курс базисной терапии препарата N-АЦЦ ассоциируется с восстановлением у больных ВП до контрольного значения уровня NO в плазме крови и тромбоцитах, показателей ЦЭК, АДФ-АТ, характеризующие состояние функции эндотелия. Применение МП позволило нам повысить чувствительность и специфичность для выявления дисфункцию эндотелия у больных ВП. Оптимизация фармакотерапии ВП при назначении в традиционное лечение N-АЦЦ осуществляется через воздействие на патогенетическое звено ВП-ДЭ путем эффективность базисной антибактериальной терапии, обладает эндотелийпротективным действием через механизмы нормализации уровня NO в плазме крови и тромбоцитах, снижение ЦЭК, активности АДФ-АТ, повышение резистентности сосудистого эндотелия к действию патогенных факторов внутренней среды в организме больных ВП.
Выводы:
1.Дисфункция эндотелия является важным патофизиологическим субстратом формирования ВП, о чем свидетельствуют данные снижения в тромбоцитах после «манжеточной пробы» основных стабильных метаболитов оксида азота (NO) – на 23,2% (Р<0,01), увеличение АДФ индуцированной агрегации тромбоцитов (АДФ-АТ) – на 86,4%, в сыворотке крови циркулирующих эндотелиальных клеток – на 83,8%.
2.Назначение N-ацетилцистеина, в состав комплексного лечения больным с ВП ускорение клинического выздоровления и повышения эффективности терапии ассоциируется более выраженным, по сравнению с группой контроля улучшением функции эндотелия – увеличение уровня в эритроцитах NO, снижения в крови – циркулирующих эндотелиальных клеток, агрегационной активности тромбоцитов, индуцированных АДФ.
3.«Манжеточная» проба позволяет диагностировать развитие у больных с ВП дисфункцию эндотелия. Определение уровня NO, циркулирующих эндотелиальных клеток, агрегационной активности тромбоцитов, индуцированных АДФ до и после «манжеточной пробы» являются ранним информативным показателем ДЭ у больных с ВП. Выявление ДЭ по результатам МП, является прогностическим маркером неблагоприятного течения ВП, что следует учитывать при подборе терапии.
