Введение. Ацетилсалициловая кислота и другие нестероидные противовоспалительные препараты (НПВП) относятся к широко и длительно используемым лекарственным средствам в лечении различного рода воспалительных процессов и болевых синдромов. В то же время, на прием препаратов этой группы часто развивается лекарственная непереносимость, которая может проявляться в виде бронхиальной астмы (БА) и хронической крапивницы (ХК) [1,2]. В целом, распространенность непереносимости аспирина и других НПВП, в виде различных клинических проявлений составляет 5-6% [3,4]. Среди всех вариантов бронхиальной астмы, аспирининдуцированная форма составляет 20%, а крапивница с повышенной чувствительностью к ненаркотическим анальгетикам диагностируется в 30% случаев ХК [5]. Показано, что непереносимость нестероидных противовоспалительных препаратов (ННПВП) обусловлена нарушением метаболизма арахидоновой кислоты. Работы, посвященные изучению лейкотриенового механизма у больных ХК единичные [3,6-12]. Причем доказано, что именно цистениловые лейкотриены С4D4Е4 и В4, образующиеся путем активации липооксигеназного пути, играют ведущую роль в бронхоконстрикции и развитии воспаления у больных БА и возможно ХК [10,11,13,14]. Общность механизмов ННПВП показана в работе зарубежных авторов, продемонстрировавших, что изменения уровня эйкозаноидов аналогичны как у пациентов с БА, так и крапивницей [14]. Также известно, что в 10% случаев аспириновая бронхиальная астма сопровождается развитием крапивницы и отека Квинке [15,16]. Тем не менее, диагностика лекарственной ННПВП в настоящий момент представляет значительные трудности для практического врача, в связи с тем, что кожное тестирование с лекарственными средствами является малоэффективным способом, результаты специфических иммунноглобулинов Е (IgE) in vitro оказались противоречивыми, а провокационная проба имеет большой процент ложных результатов и небезопасна для пациентов [5, 17]. Таким образом, безопасным и надежным способом выявления гиперчувствительности к аспирину, НПВП и изучения механизмов, лежащих в ее основе, в частности, роли лейкотриенов, высвобождащихся из клеток больных под влиянием указанных препаратов, является определение уровня лейкотриенов [2]. Контроль уровня эйкозаноидов может быть критерием эффективности проводимой терапии [20].
Цель работы. Нами было проведено изучение клинических особенностей течения хронической крапивницы с непереносимостью к нестероидным противовоспалительным препаратам и бронхиальной астмы, осложненной хроническим полипозным риносинуситом (ХПРС) и уровня лейкотриенов C4D4E4 и В4.
Материалы и методы. Проведено обследование 46 больных ХК с ННПВП и 53 пациентов БА с ХПРС на базе кафедры аллергологии и иммунологии. Возраст пациентов от 18 до 60 лет. В качестве групп контроля для сравнительной оценки уровня лейкотриенов обследованы пациенты с психогенной крапивницей (ПК) (20 человек), хронической аутоиммунной крапивницей (ХАК) (25 человек) и здоровые доноры (25 человек). Диагноз крапивница и степень тяжести заболевания устанавливались на основании соответствующих критериев, изложенных в национальном согласительном документе «Крапивница и ангиоотек» [18]. Диагноз бронхиальная астма установлен в соответствии с Международным консенсусом по диагностике и терапии БА [19]. При поступлении пациентов в аллергологическое отделение проводилось клинико-лабораторное и аллерго-иммунологическое обследование. Для уточнения имеющихся сопутствующих заболеваний назначались консультации различных специалистов. Суммарные лейкотриены C4D4E4 и лейкотриен B4 в плазме крови определяли методом иммуноферментного анализа (ИФА), наборами фирмы Neogen corporation согласно инструкции. Статистическая обработка материала проводилась с помощью пакета прикладных программ «Статистика 6» на персональном компьютере. При сравнении двух выборочных средних при сравнении групп между собой использовали критерий Манн-Уитни.
Результаты и обсуждение. Проведенный нами анализ распространенности лекарственной ННПВП показал, что в структуре ХК в г. Пенза и Пензенской области данная форма составляет 5,8%, а в структуре БА - 15,3%.
Далее нами было проведено изучение клинических особенностей течения ХК с ННПВП и БА с ХПРС. Мы отметили достоверное (р<0,01) доминирование пациентов с тяжелым течением – 31 человек (67,4%) в группе больных ХК с ННПВП. Средняя степень тяжести отмечена у 11(23,9%) больных, легкое наблюдалось только у 4 (8,7%) больных. Количество обострений у больных ХК с ННПВП колебалось от 1 до 7 в год, среднее значение составило 2,87±0,3 раза в год.
У всех пациентов БА преобладающей сопутствующей патологией был хронический полипозный риносинусит. ННПВП без полипов выявлена у 21 (39,6%) пациента и полная аспириновая триада (БА, полипоз и НПВП) у 15 (28,3%) больных. Средняя длительность течения БА составила 9,88±0,60 лет. Течение БА, осложненной ХПРС, характеризовалось тяжелыми клиническими проявлениями. У пациентов наблюдалось в среднем 4,21±0,34 обострения в год, средней длительностью до 11,92±1,06 дней. Такая форма БА отличается сочетанием иммунных механизмов с инфекционным процессом, выражающимся очагами хронической инфекции в респираторном тракте (хронический бронхит, тонзиллит, гайморит, полипоз и т.д.) с частыми обострениями и применением антибактериальных препаратов, в среднем до 3,19±0,22 курсов в год. Показатели ОФВ1 составили 69,30±0,90% от должных значений, суточный разброс ПСВ - более 17,21±0,67% . По анализу клинико-функциональных параметров полный контроль БА отсутствовал у всех пациентов, результаты АСТ теста составили 17,58-0,52 баллов (полный контроль - 25 баллов). Все пациенты получали базисную противовоспалительную терапию, доля пациентов с высокими дозами ИГКС составила 41,5%.
При анализе спектра ННПВП оказалось, что непереносимость в моновиде препаратов данной фармакологической группы практически не встречается. У всех больных отмечалась непереносимость нескольких препаратов из разных химических групп, хотя большая часть больных реагировала на аспирин и анальгин в сочетании с другими лекарственными средствами. Исследования показали, что даже полная отмена аспирина и НПВП не способна полностью изменить клиническую симптоматику и предотвратить последующие обострения ХК связанной с ННПВП, потому что по данным анамнеза при последующих рецидивах крапивницы не всегда прослеживалась четкая связь с приемом лекарств этой группы, что отмечено у 16 (34,8%) пациентов. Возможно, это связано прежде всего с тем, что пациенты с данной формой крапивницы имели комбинацию с аспириновой триадой, и не четко соблюдали рекомендации в диете. Особый интерес представил анализ сопутствующих заболеваний у наших пациентов. Выявленные при данной форме ХК и БА заболевания желудочно-кишечного тракта у 28,7% больных в виде нарушений функции печени и желчного пузыря, оказывают влияние на метаболизм аспирина и других НПВП, а также синтез и элиминацию лейкотриенов. Обращает на себя внимание частое сочетание данной формы ХК с отеком Квинке, выявленное у 38 человек (82,6%). Как у больных БА, так и у пациентов с ХК с ННПВП первое место среди сопутствующих заболеваний занимал ХПРС (39,1%). В целом комбинация с заболеваниями, которые имеют общую патогенетическую основу, составила 56,5% (полипозный риносинусит, смешанная бронхиальная астма и полипозный риносинусит и смешанная бронхиальная астма без полипов). Выявленная нами комбинация свидетельствует о системности развития данного патогенетического механизма. При изучении клинических особенностей течения данной формы ХК мы выделили две подгруппы: собственно крапивницу с ННПВП (43,5%), и крапивницу в составе симптомокомплекса в сочетании с ХПРС и БА (56,5%). Оказалось, что подгруппы достоверно отличаются по тяжести течения, длительности и количеству обострений. У пациентов с системными проявлениями патологического процесса отмечено более длительное и тяжелое течение крапивницы (в среднем 32,96±1,5 месяца, тяжесть клинических проявлений 5,04±0,3 балла), частые рецидивы (в среднем 3,46±0,4 в год) (тест Mann–Whitney, р=0,006, р=0,028 и р=0,029 соответственно) по сравнению с пациентами ХК в виде монопатологии. Сопутствующие заболевания формируют тяжелое течение ХК с ННПВП. Таким образом, сочетание ХК с ХПРС и БА способно формировать тяжелый симптомокомплекс, который поддерживает прогрессирование данной формы крапивницы даже в отсутствии последующего приема НПВП.
При оценке последовательности развития патологического процесса установлена этапность появления симптомов. У 15 (57,7%) человек из пациентов 2 подгруппы имелось развитие вначале полипов, риносинусита и бронхиальной астмы, а у 11 (42,3%) человек наоборот, симптомы крапивницы появились раньше респираторных. Длительность течения ХПРС и БА до развития крапивницы составила в среднем 10,4±0,8 лет, тогда как течение крапивницы, предшествующее развитию патологии верхних и нижних дыхательных путей составило в среднем 3,7±0,3 года. Ни в одном случае в нашем исследовании не совпало одновременное развитие данных патологических состояний.
В соответствии с целью нашей работы мы провели изучение уровня суммарных лейкотриенов С4D4Е4 и лейкотриена В4 в плазме крови методом ИФА у пациентов ХК, обусловленной ННПВП. При сравнительном анализе полученных данных выявлено достоверное увеличение высвобождения лейкотриенов у больных с данной формой ХК по сравнению со здоровыми лицами, причем увеличение уровня лейкотриенов было достоверным (тест Mann-Whitney, p=0,000). Поскольку участие лейкотриенов в патогенезе аспириновой бронхиальной астмы было подтверждено ранее другими исследователями, в качестве контрольной группы было принято решение взять не только здоровых доноров, но и пациентов с данной патологией. В качестве величин сравнения мы обследовали 53 пациента БА с ХПРС, в патогенезе которых был наиболее вероятен механизм нарушения метаболизма арахидоновой кислоты, положительные результаты получены у 40 больных.
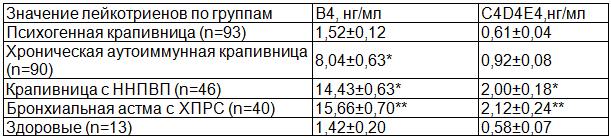
Значения изучаемых нами лейкотриенов у больных ХК с ННПВП и БА существенно не различались. Показатель уровня лейкотриена В4 у больных ХК с ННПВП колебался от 1,20 нг/мл до 21,10 нг/мл, аналогично распределялись значения лейкотриенов B4 в группе с БА: от 4,40 нг/мл до 21,40 нг/мл. Средний уровень лейкотриена В4 в группе больных ХК с ННПВП составил 14,43±0,63 нг/мл, в контрольных группах: у пациентов с БА – 15,66±0,70 нг/мл, у здоровых людей – 1,42±0,20 нг/мл (табл. 1, рис. 1).
Таблица 1. Лейкотриеновый статус у больных различными формами аллергических заболеваний
Примечания: здесь и далее * - p<0,05 достоверность различий между группой ХК и здоровыми; ** - p<0,05 достоверность различий между группой БА и здоровыми.
Показатель уровня суммарных лейкотриенов C4D4E4 колебался от 0,32 нг/мл до 4,80 нг/мл у больных ХК с ННПВП, аналогично распределялись значения лейкотриенов C4D4E4 и у пациентов с БА от 0,08 нг/мл до 4,80 нг/мл. Средний уровень лейкотриенов C4D4E4 в группе больных ХК с ННПВП составил 2,00±0,18 нг/мл, БА – 2,12±0,24 нг/мл, у здоровых людей – 0,58±0,07 нг/мл (табл.1, рис.1).
При сравнении значений лейкотриенов между группами отмечено достоверное различие данных показателей у больных ХК с ННПВП и здоровыми людьми (тест Mann – Whitney, р=0,0000 для уровня лейкотриенов В4 и C4D4E4 в сравниваемых группах), в то время как различия между больными изучаемой группы и больными БА с ХПРС выявлены не были (тест Mann – Whitney, р=0,1386 для лейкотриена В4 и р=0,9654 для лейкотренов C4D4E4).
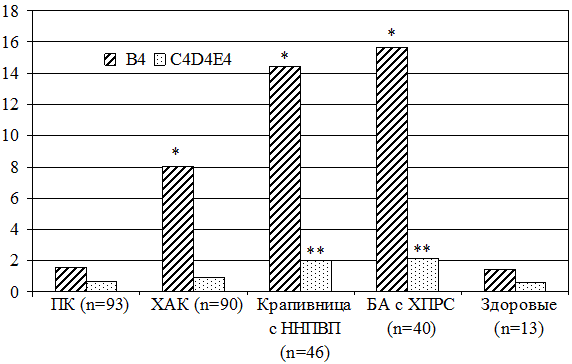
Рис. 1 Сравнительная оценка значений лейкотриенов у больных аллергическими заболеваниями.
Также мы сравнили значения данных показателей в выделенных клинических подгруппах ХК с ННПВП. Достоверных различий в уровне суммарных лейкотриенов С4Д4Е4 и В4 у больных крапивницей в виде монозаболевания и крапивницей в составе симптомокомплекса с астмой и полипозом выявлено не было (тест Mann-Whitney, p=0,603, р=0,965 соответственно).
Таким образом, участие лейкотриенового механизма в патогенензе ХК и БА доказано, что необходимо учитывать в подборе терапии у данной категории больных.
Также мы провели анализ уровня лейкотриенов у больных с психогенной крапивницей и ХАК, поскольку известно, что лейкотриены могут высвобождаться под действием различных стимулов. Но, как оказалось, между изученными нами вариантами крапивницы имелось существенное достоверное различие в показателях.
У больных с аутоиммунной и психогенной формами крапивницы значения лейкотриенов В4 и С4D4Е4 были несколько повышены по сравнению со здоровыми, но не имели решающего значения в развитии патологии в сравнении с ХК с ННПВП и БА.
Как следует из обзора литературы, применение провокационных тестов на практике возможно лишь у ограниченного контингента больных, в связи с высоким риском, связанным с проведением исследования и его низкой диагностической ценности. Поэтому мы предлагаем внедрить определение уровня лейкотриенов как наиболее безопасного и специфичного теста в диагностике данной формы ХК и БА.
В связи с существующей необходимостью применения методических подходов, позволяющих количественно оценивать чувствительность и специфичность тестов для диагностики заболевания нами был проведен ROC-анализ наиболее показательных факторов (уровень лейкотриенов В4 и C4D4E4) с целью определения порогового значения. Если исходить из требований баланса чувствительности и специфичности (min|Sensitivity-Specificity=0,000), то пороговым значением следует признать 2,35 нг/мл. В этом случае чувствительность и специфичность теста составит 95,7%. Таким образом, нами было принято решение, пороговым значением уровня лейкотриена В4 принять 2,35нг/мл. ROC-анализ с целью вычисления порогового значения был проведен и для суммарных лейкотриенов С4D4E4. Пороговое значение для данного параметра следует признать 0,85нг/мл. В этом случае чувствительность теста составит 82,6%, специфичность теста – 87,0%.
Выводы. Избыточная системная продукция цистеиновых лейкотриенов, вызванная аспирином и НПВП, определяет фенотип ХК и БА и является биохимическим маркером патологического воспалительного механизма. Аспирин и другие лекарственные препараты, аналогичного фармакологического профиля активируют биохимические нарушения метаболизма арахидоновой кислоты у больных ХК и БА.
Исходя из этого, критериями диагностики лейкотриенового механизма у больных ХК с ННПВП являются:
- анамнестическая связь с приемом НПВП;
- тяжелое клиническое течение;
- сочетание с полипозным риносинуситом и бронхиальной астмой;
- сочетание с отеком Квинке;
- уровень лейкотриена В4 с пороговым значением 2,35нг/мл;
- уровень лейкотриена C4D4E4 с пороговым значением - 0,85нг/мл.
Оптимальным методом терапии в лечении пациентов ХК с ННПВП и БА с ХПРС является назначение антилейкотриеновых препаратов, в частности монтелукаста, имеющего фармакологическую активность в отношении цистениловых лейкотриенов.
