Введение. В настоящее время бронхиальная астма (БА) остаётся одним из наиболее частых заболеваний органов дыхания. Современная концепция патогенеза БА констатирует, что в её основе лежит хронический иммуновоспалительный процесс в стенке бронха [1].
Для диагностики БА разработаны высокочувствительные клинические и функциональные тесты. Однако симптомы болезни не всегда отражают природу и степень выраженности воспаления, о чем свидетельствуют слабовыраженные взаимосвязи между значениями функциональных тестов и маркерами воспаления [2-4]. В этой связи последнее время распространение получили лабораторные методы оценки течения БА, включающие общий и специфический иммуноглобулин Е (IgE), эозинофильный катионный протеин (ECP), триптазу и др. [5-8]. Предложенный для лечения больных БА противовоспалительный препарат фенспирида гидрохлорид позволяет уменьшить выраженность бронхиальной дисфункции за счёт снижения выработки ключевых индукторов иммуноопосредованного воспаления в бронхиальном дереве [9,10].
Цель исследования – изучить взаимосвязи между маркёрами атопии в крови больных БА и клиническим течением различных вариантов заболевания (атопический и смешанный) на фоне комплексного лечения с использованием препарата фенспирида гидрохлорид.
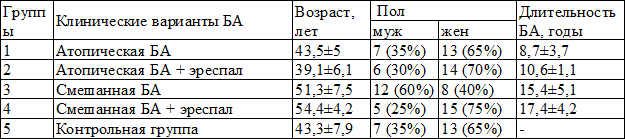
Материалы и методы. Под наблюдением находилось 80 больных БА, из них 48 женщин и 32 мужчины и 20 практически здоровых человек без бронхолёгочных заболеваний. Средний возраст больных составил 51,3±7 лет, практически здоровых людей – 43,3±7,9 лет. У всех больных была диагностирована персистирующая (постоянная) БА средней тяжести. Верификация клинического варианта и тяжести БА проводилась в соответствии с рекомендациями GINA (2011) [11: 35–37]. У всех больных оценивались приведенные ниже клинические и функциональные показатели.
Клинико-физикальное обследование включало сбор анамнеза и оценку объективных данных пациента. Клиническая оценка симптомов БА (кашель, мокрота, одышка) проводилась однократно по 3-х балльной шкале (0 – отсутствие симптома, 3 – максимальное проявление симптома). Также оценивали число приступов удушья и потребность в симпатомиметиках короткого действия.
Лабораторно-инструментальные исследования включали общий и биохимический анализ крови, электрокардиография (ЭКГ), рентгенографию органов грудной клетки.
Параметры функции внешнего дыхания (ФВД) у больных БА при поступлении в стационар и выписке оценивали на электронном спироанализаторе «ДИАМАНТ» (Россия) в соответствии с рекомендациями GINA (2011) [11: 29–32]: объем форсированного выдоха за первую секунду (ОФВ1), форсированную жизненную емкость легких (ФЖЕЛ), ОФВ1/ФЖЕЛ.
Оценку полученных результатов проводили при сопоставлении данных с должными величинами, вычисленными по формулам, предложенным консенсусом ERS и ATS (Американского торакального общества) [12].
Аллергологическое обследование включало сбор анамнеза, кожные скарификационные пробы с неинфекционными аллергенами (вне обострения заболевания). Так же использовались методы определение уровня эозинофилов в периферической крови, общего IgЕ и катионного белка эозинофилов. При сборе аллергологического анамнеза учитывались атопические заболевания в прошлом и настоящем, реакции на введение различных медикаментов, вакцин и сывороток, сезонность заболевания, влияние климата, погоды и физических факторов и семейный анамнез.
Определение уровня общего IgE проводили с использованием диагностических наборов «IgE общий» производства компании «Hoffmann La Roche Ltd» (Германия) в соответствии с инструкцией производителя методом электрохемилюминесценции на приборе «Cobas e 411» (Япония). Определение уровня катионного белка эозинофилов (ECP) в сыворотке крови проводили иммунохемилюминесцентным методом с применением реагентов для определения ECP, согласно инструкции производителя, на приборе «UniCAP 100» фирмы «Phadia» (Швеция). Уровень ECP в сыворотке крови позволял оценить выраженность эозинофильного воспаления.
Лечение в стационаре проводили согласно рекомендациям GINA (2011) [11: 82–85] β2-агонистами быстрого действия через небулайзер по одной дозе беродуала (1 мл) каждые 20 мин в течение одного часа в сочетании с ингаляцией кислорода. При отсутствии эффекта добавляли парентерально глюкокортикостероиды (преднизолон 1 мг/кг с интервалом 2 ч). При сохранении пиковой скорости выдоха (ПСВ) ниже 60% от должного или от наилучшего значения в течение 3 ч приступ расценивали как тяжёлый. К лечению добавляли метилксантины. Насыщающую дозу вводили из расчёта 5-6 мг/кг массы тела; поддерживающую дозу — в виде длительной инфузии по 0,5–0,6 мг/кг массы тела. Одновременно увеличивали дозу парентеральных глюкокортикостероидов: 250 мг гидрокортизона сукцината или 90-120 мг преднизолона каждые 6 ч. Эффективность лечения оценивали по приросту ОФВ1 на 15% и более. В составе комплексной терапии 40 пациентам назначен фенспирида гидрохлорид (препарат Эреспал, производство компании «Servier» (Франция)) в дозе 160 мг в сутки при двукратном приёме внутрь. Пациенты начинали получать препарат на первый день пребывания в стационаре. Средняя продолжительность терапии в условиях стационара составила 16 дней.
Клинические и инструментальные данные обрабатывали с помощью программной системы STATISTICA for Windows (версия 5.11). Для статистического анализа использовался расчёт средней величины (М) и её ошибки (m). Для оценки значимости различных показателей для согласованных групп использовался непараметрический критерий Вилкоксона, для несогласованных – Манна-Уитни. Для определения взаимосвязи изучаемых показателей проводился корреляционный анализ Пирсона и Спирмана. Критерием статистической достоверности получаемых выводов считали общепринятую в медико-биологических исследованиях величину p<0,05.
Результаты и их обсуждение. На первом этапе исследования были выделены следующие группы больных: 1-я группа (20 человек) включала больных атопической бронхиальной астмой, 2-я группа (20 человек) включала больных атопической бронхиальной астмой, к терапии которых добавлялся эреспал (фенспирид гидрохлорид), 3-я группа (20 человек) включала больных смешанной бронхиальной астмой, 4-я группа (20 человек) включала больных смешанной бронхиальной астмой, к терапии которых добавлялся эреспал (фенспирид гидрохлорид), 5-я группа (20 человек) – контрольная, без бронхолёгочных заболеваний.
Таблица 1. Клиническая характеристика больных БА в группах
У больных всех групп при поступлении и перед выпиской после курса лечения проводилось определение параметров ФВД (табл. 2), а также лабораторных показателей в сыворотке крови: количества эозинофилов, содержания общего IgE и катионного белка эозинофилов.
При анализе показателей ФВД установлено, что при поступлении во всех группах больных средние значения ОФВ1 и ПОС выд указывали на наличие бронхиальной обструкции. Более выраженная бронхиальная обструкция имела место в 3-ей и 4-ой группах больных: 3-я группа: ОФВ1 – 53,9 % (40,7-63,7), ПОС выд – 61,4 % (48,6-78,3); 4-я группа: ОФВ1 – 41,5 % (32,6-55,7), ПОС выд – 57,4 % (45,9-71,4). На фоне проводимой терапии отмечался регресс бронхиальной обструкции. При этом, достоверное повышение ОФВ1 на фоне проведённой терапии имело место в 4-й группе, к терапии которой был добавлен эреспал: 41,5 % (32,6-55,7) и 74,3 % (58,7-90,3) соответственно (р<0,05), по сравнению с 3-й группой: 53,9 % (40,7-63,7) и 71 % (55,6-92,5) соответственно (p<0,05).
Наиболее специфичным лабораторным маркером аллергических заболеваний является IgE к определенному аллергену. В реальной клинической практике чаще в сыворотке крови определяют уровень общего IgE, который хотя и является менее специфическим маркером атопии, но позволяет дифференцировать группу аллергических заболеваний от другой соматической патологии. По усредненным статистическим данным у 70% взрослых больных эндогенной бронхиальной астмой уровень общего IgE превышает референтные значения более чем на два стандартных отклонения. В нашем исследовании содержание общего IgE в группе больных атопической БА существенно превышало значения, характерные для смешанного варианта БА.
Таблица 2. Показатели ФВД у больных с различными клиническими вариантами БА (Ме (25‰-75‰))
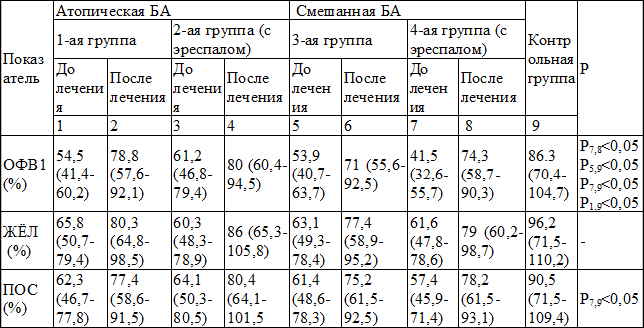
Примечания: ОФВ1 – объём форсированного выдоха за 1 секунду (%), ЖЁЛ – жизненная ёмкость лёгких (%), ПОС выд. – пиковая объёмная скорость выдоха (%)
Таблица 3. Содержание общего IgE в сыворотке крови в группах (Ме (25‰-75‰))
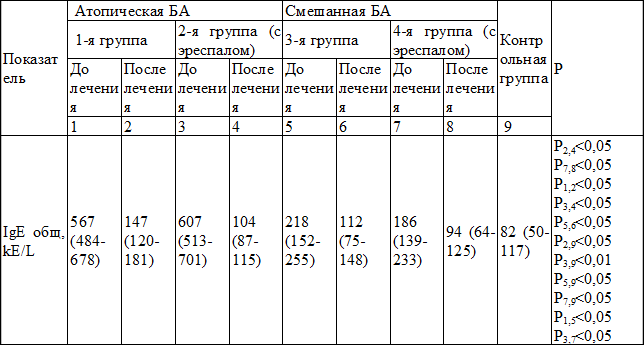
До лечения содержание общего IgE в группе больных атопической БА было следующим (в 1-й группе – 567 kЕ/L (484-78), во 2-й – 607 kЕ/L (513-701)), а в группе смешанной БА (в 3-й – 218 kЕ/L (152-255), в 4-й – 186 kЕ/L (139-233)). На фоне комплексной терапии содержание общего IgE в группе больных с атопической БА понизилось: в подгруппе с эреспалом до уровня 104 kЕ/L (87-115), подгруппе без эреспала – 147 kЕ/L (120-181)). Разница между группами была достоверна (р<0,05). В группе больных смешанной БА на фоне терапии содержание общего IgE так же понизилось: в подгруппе с эреспалом до уровня 94 kЕ/L (64-125), в подгруппе без эреспала – 112 kЕ/L (75-148).
Таким образом, на фоне проводимого лечения содержание в сыворотке крови общего IgE понизилось у всех больных БА, однако в подгруппах, принимающих эреспал, это снижение было более выражено.
Следующим этапом исследования стала оценка содержания ЕСР в сыворотке крови наблюдаемых пациентов. ЕСР является специфичным маркером активности эозинофилов. Он секретируется в кровь сенсибилизированными эозинофилами при аллергических и воспалительных реакциях. Его содержание в крови коррелирует с выраженностью аллергических реакций.
Таблица 4. Содержание ЕСР в периферической крови в группах (Ме (25‰-75‰))
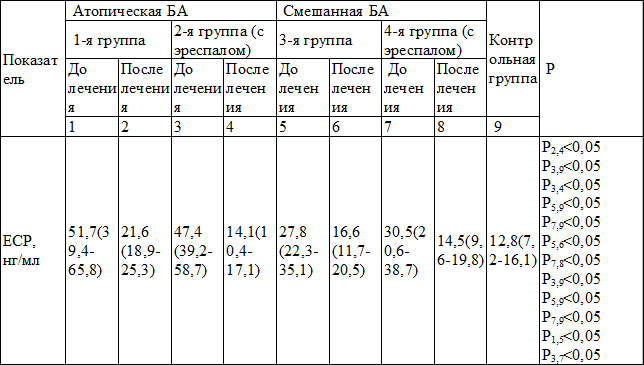
Согласно полученным данным максимальное содержание ECP до лечения отмечалось в группах больных с атопической БА: в 1-ой – 51,7 нг/мл (39,4-65,8), во 2-ой с эреспалом – 47,4 нг/мл (39,2-58,7). При сравнении этих показателей ECP больных с атопической БА с показателями ECP в группах больных со смешанной БА были выявлены достоверные различия (51,7 нг/мл (39,4-65,8) и 27,8 нг/мл (22,3-35,1) (р<0,05) соответственно, и в группах с эреспалом – 47,4 нг/мл (39,2-58,7) и 30,5 нг/мл (20,6-38,7)) (р<0,05) соответственно.
При оценке содержания ECP в исследуемых группах отмечалось снижение этого показателя на фоне проводимого лечения. В 1-й группе больных атопической БА отмечалось достоверное снижение содержания ECP на фоне лечения – 51,7 нг/мл (39,4-65,8) и 21,6 нг/мл (18,9-25,3) (р<0,05)) соответственно, во 2-й группе с эреспалом – 47,4 нг/мл (39,2-58,7) и 14,1 нг/мл (10,4-17,1) (р<0,05) соответственно. В 3-й группе больных смешанной БА также имело место достоверное снижение ECP на фоне проведенного курса терапии. До лечения содержание ЕСР у этой группы больных составляло 27,8 нг/мл (22,3-35,1), а после курса лечения – 16,6 нг/мл (11,7-20,5) (р<0,05) соответственно. В 4-й группе больных (с эреспалом) до лечения – 30,5 нг/мл (20,6-38,7) и после лечения – 14,5 нг/мл (9,6-19,8) (р<0,05).
После курса лечения более существенное снижение уровня ECP было достигнуто во 2-й группе у больных атопической БА с эреспалом по сравнению с 1-й группой, не применявшей эреспала. Различия между группами были достоверно значимы: (14,1 нг/мл (10,4-17,1) и 21,6 нг/мл (18,9-25,3)) при (р<0,05).
Следующим этапом работы была оценка содержания в группах больных эозинофилов в периферической крови, поскольку эти клетки являются стандартным лабораторным показателем, отражающим выраженность аллергического воспаления.
Таблица 5. Содержание эозинофилов в периферической крови наблюдаемых больных (Ме (25‰-75‰))
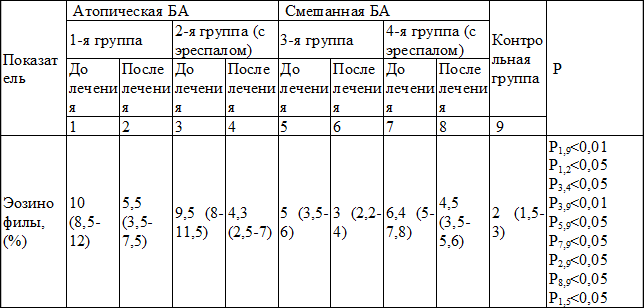
Содержание эозинофильной фракции лейкоцитов в крови больных атопической БА и смешанной БА до начала лечения имело существенное различие.
При атопическом варианте БА их уровень был следующим: в 1-й группе – 10% (8,5-12), во 2-й – 9,5% (8-11,5). При смешанном варианте БА содержание эозинофилов было в два раза меньше: в 3-й – 5% (3,5-6), в 4-й – 6,4% (5-7,8). Различия в группах атопической и смешанной БА по уровню эозинофилов до лечения были достоверны (р<0,05). После курса лечения у больных достоверные различия по уровню эозинофилов были установлены в обеих группах атопической БА: в 1-й 10 (8,5-12) и 5,5 (3,5-7,5) и во 2-й группе получавшей эреспал: 9,5% (8-11,5) и 4,3 (2,5-7), (р<0,05).
В группах больных смешанной БА также отмечалось снижение количества эозинофилов, однако оно не было достоверно значимо. Таким образом, результаты нашего исследования показали, что проводимая комплексная терапия была эффективной независимо от патогенетического варианта БА, что подтверждалось улучшением клинической симптоматики, нормализацией дыхательных проб, а также позитивной динамикой лабораторных показателей (снижением уровня общего IgE, ECP и количества эозинофилов в крови). Оценка содержания общего IgE, ECP и количества эозинофилов позволила точнее дифференцировать два патогенетических варианта БА. Для атопической БА в период обострения характерным явилось почти двукратное увеличение ECP и количества эозинофилов, а также почти трехкратное увеличение общего IgE по сравнению со смешанной формой БА. Выявленная закономерность между вариантом течения БА и лабораторными показателями атопии может иметь существенное значение при выборе тактики ведения таких больных. На фоне проводимой терапии отмечалось снижение изучаемых лабораторных показателей независимо от патогенетического варианта, но более значимое снижение удалось достичь у больных с атопическим вариантом БА, в комплексном лечении которых применялся препарат эреспал.
Таким образом, применение в комплексной терапии больных БА препарата фенспирида гидрохлорид позволяет более эффективно контролировать течение заболевания, особенно в группе больных с атопическим вариантом БА.
Лабораторные маркеры атопической БА – общий IgE и катионный белок эозинофилов, отражают тяжесть обострения заболевания и могут служить показателем эффективности проводимого лечения.
