Введение. Бронхиальная астма (БА) является одним из самых распространенных заболеваний аллергопатологии, снижающих качество жизни больных и представляющую значительную социально-экономическую проблему современной медицины [1]. В основе БА лежит хроническое воспаление дыхательных путей, обусловленное иммунными и неиммунными механизмами.
В развитии воспаления участвуют все иммунокомпетентные клетки (эозинофилы, макрофаги, нейтрофилы, тучные клетки, Т-лимфоциты и т.д.) [3, 5, 7, 13]. Цитокины (интерлейкины) характеризуют сложные межклеточные взаимоотношения иммунокомпетентных клеток и различный тип иммунного ответа с участием Т лимфоцитов хелперов 1 типа (Тh1) так и Т лимфоцитов хелперов 2 типа (Тh2), что приводит к формированию различных клинических вариантов БА. В настоящее время выделяют еще один тип иммунного реагирования с участием Т лимфоцитов хелперов 17 типа (Тh17) [2].
Интерлейкины (ИЛ) играют существенную роль в контроле всех стадий развития и поддержания аллергических реакций и воспаления, поэтому анализ их активности имеет очень большое значение для понимания молекулярных основ патогенеза БА [8, 9, 10,11, 14]. В респираторной медицине увеличилось число публикаций, подтверждающих гетерогенность БА в зависимости от этиологических факторов и ведущих патогенетических механизмов [7, 15, 20, 21].
Инфекционно-зависимая форма бронхиальной астмы (ИЗБА) является наименее изученным фенотипом патологии, она не отражена в современной классификации и представляет наибольшую трудность для врачей практического звена в плане диагностики и выбора метода терапии [6, 7, 12]. Вместе с тем, чисто аллергические формы БА практически не встречаются. Зачастую БА осложняется инфекционным фактором: острым респираторным заболеванием/острой вирусной инфекцией (ОРЗ/ОРВИ) и сопутствующей патологией, среди которых ведущая роль отводится заболеваниям верхних дыхательных путей [7, 12].
Единство анатомо-физиологического строения верхних и нижних дыхательных путей диктует единый подход к диагностике и терапии бронхиальной астмы (БА) и ринита. Более чем у 80% пациентов с БА диагностируют аллергический ринит (АР), кроме того доказано, что АР так же является фактором риска развития БА. Астма развивается у 45 % больных АР. Фенотип ринита определяется патогенетическим механизмом и коррелирует с фенотипом БА [1, 4, 18]. Особый интерес представляет сочетание астмы и полипоза носа (ПН). Наиболее изучены неаллергические механизмы патогенеза полипозного риносинусита (ПРС), в частности лейкотриеновый, приводящие к формированию аспиринового варианта БА [3, 14, 16]. Взаимосвязь ИЗБА и ПРС является мало изученным вопросом. Определение особенностей клинического течения данного фенотипа БА и ведущих патогенетических механизмов имеет актуальное современное значение.
Цель работы. Изучить уровень интерлейкинов ИЛ-4, ИЛ-10, ИЛ-18, ИЛ-8, ИЛ-17, интерферон-γ (INF-γ) у больных инфекционно-зависимой формой бронхиальной астмы (ИЗБА), осложненной полипозным риносинуситом (ПРС).
Материалы и методы. Проведено обследование 53 пациентов с ИЗБА, осложненной ПРС. Средняя длительность течения заболевания составила 9,51±0,56 лет. Мужчин – 19 (35,8%), женщин – 46 (64,1%). Возраст пациентов от 18 до 60 лет, средний возраст – 43,6±1,55. В качестве группы контроля для сравнительной оценки уровня изучаемых цитокинов обследованы здоровые доноры (40 человек). Диагноз бронхиальная астма установлен в соответствии с Международным консенсусом по диагностике и терапии БА (GINA, 2008-2012 г.) [17]. При поступлении пациентов в аллергологическое отделение проводилось комплексное клинико-лабораторное и аллерго-иммунологическое обследование.
Клиническое обследование включало оценку симптомов астмы, тяжести течения, объема проводимой противовоспалительной терапии. Клинические показатели оценивались в баллах. Исследование функции внешнего дыхания (ФВД) у больных БА проводилось на спирографе «MicroLab» с компьютерным программным обеспечением, определялись: объем форсированного выдоха в секунду (ОФВ1), пиковая скорость выдоха (ПСВ), суточный разброс ПСВ в %. По совокупности клинических и функциональных показателей для статистической обработки данных контроль БА определялся в баллах у каждого пациента: полный контроль - 1 балл, хороший контроль -2 балла, отсутствие контроля - 3 балла. Клинические критерии контроля БА применяли в соответствии с GINA, 2008 [17].
Все пациенты, включенные в исследование получали базисную противовоспалительную терапию ингаляционными глюкокортикостероидами (ИГКС) в соответствии с тяжестью течения БА. Постоянный прием пероральных глюкокортикостериодных (ГКС) препаратов являлся критерием исключения из наблюдения. Для уточнения имеющихся сопутствующих заболеваний проводились консультации различных специалистов.
В соответствии с целью исследования проведено изучение содержания цитокинов сыворотки крови: ИЛ-4, ИЛ-10, IFNg, ИЛ-18, ИЛ-8, ИЛ-17. Концентрацию ИЛ-4, ИЛ-10 определяли методом ИФА наборами фирмы ООО «Протеиновый контур» (г. Санкт-Петербург). Концентрацию IFN-g в сыворотке крови определяли методом ИФА и наборами фирмы «CYTIMMUNE» (CША). Уровень ИЛ-18, ИЛ-8 и ИЛ-17 методом ИФА наборами ЗАО «Вектор-Бест» (г. Новосибирск).
Критерием включения больных БА в группу исследования был установленный диагноз инфекционно-зависимая БА в сочетании с ПРС. Атопия к неинфекционным аллергенам являлась критерием исключения из исследования.
Статистическая обработка материала проводилась с помощью пакета прикладных программ «Statistica 6.0» на персональном компьютере. При сравнении двух выборочных средних при сравнении групп между собой использовали критерий Mann-Whitney (U).
Результаты и обсуждение. У всех пациентов с БА диагностирован ПРС. Непереносимость нестероидных противовоспалительных препаратов (ННПВП) без полипов выявлена у 21 (39,6%) пациента и полная аспириновая триада (БА, полипоз носа и НПВП) у 15 (28,3%) больных. 48 (90,6%) больных имели в анамнезе неоднократную полипэктомию. Частота полипэктомии у пациентов наблюдалась от 1 до 15 раз. В среднем частота полипэктомий у пациентов этой группы составила 10,06±0,42 (Ме – 10,00) с интерквартильным размахом Р25%; Р75% [9,00;12,00]. У 7 (13,2%) больных полипэктомия проводилась более 10 раз в течение последних 3 лет, что свидетельствовало о прогрессировании хронического воспалительного процесса и неэффективности проводимой терапии.
Интересным фактом являлось сочетание БА с острой у 5 (9,4%) и хронической крапивницей, отеком Квинке у 10 (18,9%) пациентов), что, возможно, отражает общность патогенетических механизмов патологии. У всех больных отмечена связь обострений БА с острыми респираторными заболеваниями (ОРЗ), острыми респираторными вирусными инфекциями (ОРВИ) или обострением сопутствующего синусита. Помимо ПРС, 71,7 % пациентов имели другие очаги хронической инфекции в респираторном тракте (хронический бронхит, тонзиллит, фарингит и т.д.) и у 22,6 % наблюдалось сочетание с заболеваниями желудочно-кишечного тракта.
Изучаемый вариант БА характеризовался тяжелым, неконтролируемым течением БА с частыми рецидивами. Тяжесть течения БА составила – 2,36±0,08 (Ме – 2,00) баллов. У пациентов в среднем наблюдалось 4,21±0,34 обострения БА в год, частые ОРЗ/ОРВИ – в среднем - 3,57±0,27 (Ме – 3,00) в год, что в конечном итоге приводило к применению антибактериальных препаратов (АБП) (в среднем до 3,19±0,22 курсов в год). Показатели ОФВ1 составили 69,30±0,90% от должных значений, суточный разброс ПСВ - более 17,21±0,67%. У 2/3 пациентов с нормальными значениями ОФВ1 наблюдалась гиперреактивность бронхов (ГРБ) на неспецифические раздражители, что на фоне противовоспалительной терапии свидетельствует о персистенции воспаления в дыхательных путях. По анализу клинико-функциональных параметров полный контроль БА отсутствовал у всех пациентов. В среднем составил -2,28±0,09 (Ме – 2,00) балла (полный контроль – 1 балл).
Все пациенты получали базисную противовоспалительную терапию, доля пациентов с высокими дозами ингаляционными ГКС составила 41,5%, низкие дозы получали всего – 3 (5,7%), средние – 28 (52,8%) пациентов.
Таким образом, ПРС вносит свой вклад в формирование особого клинического варианта ИЗБА, для которого характерно: тяжелое течение БА с частыми обострениями, неконтролируемым течением, низкими показателями ФВД и приемом высоких доз ГКС.
В соответствии с целью нашей работы мы провели изучение уровня цитокинов ИЛ-4, ИЛ-10, ИЛ-18, ИЛ-8, ИЛ-17, INF-γ в сыворотке крови для оценки патогенетических механизмов развития ИЗБА в сочетании с ПРС. Данные представлены в табл/ 1.
Таблица 1. Оценка уровня цитокинов у больных с инфекционно-зависимой формой бронхиальной астмы, осложненной полипозным риносинуситом
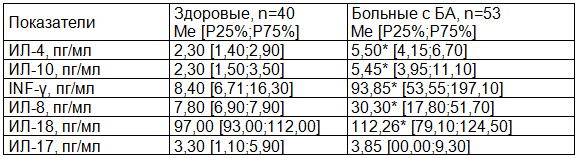
Примечание: * – статистически значимое различие по сравнению со здоровыми (тест Mann-Whitney, р < 0,05).
У больных ИЗБА с ПРС были выявлены значимые нарушения в системе цитокиновой иммунорегуляции. Как видно из табл. 1, практически все изученные параметры статистически различались с аналогичными показателями у здоровых людей (тест Mann-Whitney, р < 0,05). Интересным фактом является то, что наряду с цитокинами, отражающими Th1 иммунный ответ (IFNγ) были повышены и цитокины Th2 иммунного ответа (ИЛ-4, ИЛ-10) по сравнению с контрольными цифрами, что свидетельствует о сочетанном механизме патогенеза ИЗБА с ПРС. При проведении частотного анализа отмечено: повышение ИЛ-4 выше нормы у 81,3%, IFNγ у 87,5%, ИЛ-10 у 43,3% пациентов. Значения ИЛ-4 колебались от 1,10 до 16,00 пг/мл и в среднем составили: 5,62±0,86 (Ме – 5,50) пг/мл. Значения ИЛ-10 колебались от 2,80 до 132,10 пг/мл, в среднем – 15,76±7,93 (Ме – 5,45) пг/мл (тест Mann-Whitney, р = 0,000). Более выраженные изменения наблюдались в уровне IFN-γ. Так значения IFN-γ колебались от 0,00 до 365,8 пг/мл, в среднем составили 219,81±107,29 (Ме – 93,85) пг/мл. Выявленные изменения в значениях ИЛ-4,10 и IFN-γ в сравнении со значениями в контрольной группе были статистически значимыми (тест Mann-Whitney, р=0,000, р=0,000, р=0,000).
Известно, что ИЛ-4 является основным цитокином, участвующим в контроле и развитии аллергических реакций, повышении уровня общего и специфических иммуноглобулинов класса Е (IgЕ) к этиотропным аллергенам. IFNγ является активным противовоспалительным цитокином, контролирующим воспалительные процессы, в первую очередь, на вирусные патогены. Кроме того, IFNγ находится в антагонистических отношениях с ИЛ-4 и способствует переключению иммунного ответа с Тh2 на Th1, тем самым, уменьшая проявления атопии. ИЛ-10 является продуктом регулирующих Т лимфоцитов 1 типа (Т-reg1) и его повышение у наблюдаемых больных подтверждает его регулирующую роль. Таким образом, у пациентов этой группы мы наблюдали активацию цитокинов как Тh2, так и Th1 иммунного реагирования, т.е. развитие патогенетических механизмов по смешанному пути, что вероятно является особенностью данного варианта ИЗБА в сочетании с ПН.
Известно, что цитокины ИЛ-8, ИЛ-18отражают состояние противоинфекционной защиты организма и функциональную активность нейтрофилов и других фагоцитов. Достоверные изменения в сравнении с контрольной группой (тест Mann-Whitney, p < 0,05) получены по ИЛ-8 и ИЛ-18 (табл. 1). Частотный анализ по уровням изучаемых цитокинов показал, что у больных ИЗБА с ХПРС значения, превышающие нормальные величины, встречались: по ИЛ-8 в 88,20%, по ИЛ-18 в 47,1% случаях. Значения ИЛ-8 распределялись от 6,60 до 122,10 пг/мл. Среднее значение составило 40,12±8,07 (Ме – 30,30) пг/мл. Значения ИЛ-18 колебались от 59,70 до 261,50 пг/мл, в среднем составили – 112,25±11,81 (Ме – 102,40) пг/мл.
Высокие результаты исследования уровня ИЛ-8, ИЛ-18 говорят об активном воспалительном процессе у данных больных, что клинически может выражаться в утяжелении течения БА и пролонгировании хронического воспаления в дыхательных путях. Высокие значения изучаемых цитокинов могут служить критерием для назначения антибактериальной терапии и иммунокорректоров больным с данной патологией, тем более что терапия ГКС не приводит к полному контролю воспаления.
ИЛ-17 был повышен у 27 (50,9%) больных. Вместе с тем, в сравнении со здоровыми лицами не было выявлено статистически значимых различий (тест Mann-Whitney, р > 0,05). Значения ИЛ-17 в группе больных ИЗБА с ХПРС колебались от 0,00 до 40,80 пг/мл. Средний уровень ИЛ-17 в группе больных составил 8,25±3,09 (Ме – 3,85) пг/мл. ИЛ-17 является продуцентом Th17 лимфоцитов и определяет отдельный фенотип иммунного реагирования с участием нейтрофилов. Поскольку у больных с ИЗБА с ПРС выявлено одновременно два типа иммунного реагирования (Th1 и Th2), то скорее всего, Th17 тип иммунного реагирования не имеет решающего значения в патогенезе данного варианта БА.
Уровень изучаемых цитокинов отражает сочетание атопических механизмов и инфекционного процесса у больных ИЗБА с ПРС.
Таким образом, в результате проведенных исследований по изучению ведущего Th типа иммунного реагирования у больных с ИЗБА с ПРС выявлены следующие закономерности. Доказано, что у данной категории больных в патогенезе принимает участие как Th2, так и Th1 тип иммунного ответа. Выявленные изменения определяют особенности клинического течения данного варианта БА.
