Хроническая обструктивная болезнь легких (ХОБЛ) продолжает оставаться одной из важнейших причин нарушения здоровья и смертности [1, 2]. По прогнозам, распространенность ХОБЛ и ущерб от нее в ближайшие десятилетия будут увеличиваться, что обусловлено продолжающимся воздействием факторов риска ХОБЛ и изменениями возрастной структуры населения [2]. ХОБЛ рассматривается как заболевание не только респираторной системы, но и как патология, оказывающее влияние на организм в целом, что во многом определяет прогноз при этом заболевании. Не менее важной является и проблема сопутствующих по отношению к ХОБЛ заболеваний, в частности хирургической патологии, требующей вмешательств на брюшной полости. Вентральные грыжи продолжают занимать лидирующие позиции в спектре хирургических заболеваний. Одной из основных причин неблагоприятного течения послеоперационного периода при хирургическом лечении грыж передней брюшной стенки, особенно грыж больших размеров, является развитие или нарастание в раннем послеоперационном периоде дыхательной недостаточности [3, 4]. Возможно, это обусловлено тем, что после пластики грыжевого дефекта вследствие уменьшения объема брюшной полости повышается внутрибрюшное давление. В свою очередь это ведёт к уменьшению трансторакального давления, нарушению вентиляционо-перфузионного соотношения, снижению эффективности дыхания [3]. У больных ХОБЛ выключение дыхательной функции брюшной стенки может усугублять дыхательную недостаточность, при этом значительно снижается качество жизни [3, 5].
В клинике известны и применяются различные методы прогнозирования и профилактики возможных нарушений функционирования жизненно важных систем внутренних органов, в частности, дыхательной системы, которые могут наблюдаться в раннем послеоперационном периоде как проявления синдрома абдоминальном компрессии. Так, известен способ, при котором предварительно с помощью рентгеновской компьютерной томографии определяют объем грыжевого мешка и объем брюшной полости, рассчитывают их процентное соотношение. При значении этого показателя 18% и более прогнозируют риск развития нарушений функции дыхания в послеоперационном периоде. Недостатком указанного способа является существенная лучевая нагрузка на пациента. Также известен способ, при котором в процессе герниолапаротомии производят контроль сопротивления на высоте вдоха в дыхательном контуре наркозного аппарата. При этом, если оно превысит 50 мм вод. ст., то вентропластику прекращают ввиду повышенного риска дыхательных и сердечно-сосудистых расстройств [4, 5]. Недостатком указанного способа является то, что операции герниопластики зачастую проводятся под эпидуральной анестезией, соответственно вообще не требуют применения наркозной аппаратуры.
С учетом недостатков указанных выше способов актуальным становится прогнозирование респираторных нарушений в послеоперационном периоде у больных ХОБЛ и вентральными грыжами путем более простых и доступных методик в процессе проведения функциональных проб с моделированием уменьшения объема брюшной полости в предоперационном периоде с целью предотвращения возможных негативных последствий герниопластики путем выбора относительно безопасного варианта грыжесечения, разработки программ предоперационной подготовки больных и послеоперационного ведения.
Цель исследования: оценить значение функциональных проб с моделированием уменьшения объема брюшной полости у больных ХОБЛ и вентральными грыжами в предоперационном периоде с оценкой параметров функции внешнего дыхания, а также доли функционального мертвого пространства в альвеолярной вентиляции.
Материалы и методы. Обследованы 66 больных ХОБЛ 1 и 2 стадии с грыжами передней брюшной стенки в возрасте 42 – 64 лет (мужчин – 25, женщин – 41). Из них больных с пупочными грыжами – 20, грыжами белой линии живота – 18, послеоперационными срединными грыжами – 28. У всех больных было получено письменное информирование добровольное согласие на участие в исследовании.
Всем пациентам перед операцией проводилась спирометрия и капнометрия до и через 20 мин после вправления содержимого грыжевого мешка с обязательной фиксацией бандажом. Исследования повторялись на вторые сутки после герниопластики. Для оценки параметров функции внешнего дыхания (ФВД) применялся портативный спирометр «Vitalograph» (Ennis, Ireland). Анализировались следующие показатели: объем форсированного выдоха за 1 секунду (ОФВ1), форсированная жизненная емкость легких (ФЖЕЛ), индекс Тиффно.
Капнометрия проводилось с помощью капнометра КП-01-«ЕЛАМЕД» (ОАО «Елатомский приборный завод», Россия). Осуществляли регистрацию значений концентраций углекислого газа в выдыхаемом воздухе пациента с последующим определением доли функционального мертвого пространства в альвеолярной вентиляции (ДФМПАВ).
Пластика грыжевых ворот осуществлялась либо натяжным способом с использованием местных тканей, либо с помощью аллопротезирования, либо предпочтение отдавалось поэтапному варианту грыжесечения с адаптацией краев раны в зависимости от размера грыжевых ворот и топографического расположения грыжевого выпячивания.
Статистический анализ полученных данных осуществляли с использованием непараметрических методов модуля статистического анализа пакета прикладных программ STATGRAPHICS Plus 5.1. При анализе двух повторных измерений использовали критерий Уилкоксона, при анализе различий между выборками – критерий Манна-Уитни. Достоверность различий неусредняемых относительных величин оценивали по критерию χ2. В пределах исследуемых групп численные значения параметров представлены в виде медианы, в скобках указаны 25% и 75% перцентили. Различия считали достоверными при уровне значимости р<0,05.
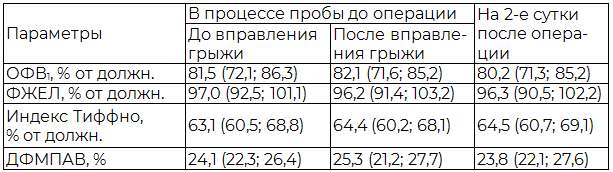
Результаты и их обсуждение. У всех больных в процессе проведения функциональной пробы с вправлением содержимого грыжевого мешка и его фиксацией в дооперационном периоде достоверного изменения оцениваемых параметров ФВД не отмечалось. Однако на 2-е сутки после операции у ряда больных наблюдалось изменение оцениваемых параметров спирометрии, при этом степень этого изменения или отсутствие такового коррелировали с размерами грыжевого дефекта. Так, у больных с размерами грыжевого дефекта до 8 см независимо от способа герниопластики не было выявлено достоверных изменений исследуемых показателей ФВД (табл. 1). У пациентов с размерами грыжевого дефекта более 8 см изменение параметров ФВД было статистически значимым. Так, ОФВ1 у этих больных уменьшился после операции в среднем на 29 %, ФЖЕЛ – на 8,5 %, индекс Тиффно – на 6 % (табл. 2).
Анализ результатов капнометрического обследования в отличие от спирометрии выявил более четкую взаимосвязь значения исследуемого параметра (ДФМПАВ) в процессе проведения пробы перед операцией и на 2-е сутки после операции грыжесечения. Также наблюдалась зависимость ДФМПАВ от размера грыжевых ворот (табл. 1, 2). У больных с размерами грыжевого дефекта до 8 см ДФМПАВ достоверно не менялась. Когорта пациентов с размерами грыжевого ворот более 8 см оказалась неоднородной. Так при у 20 больных (группа 1) ДФМПАВ в процессе проведения пробы существенно не изменилась, либо значения прироста показателя находились в пределах нормы (не более 35% дыхательного объема). У 18 пациентов (группа 2) имело место значительное увеличение исследуемого показателя выше нормы при проведении пробы. Каждая из вышеназванных групп была рандомизирована в две подгруппы: подгруппу А составили пациенты, оперируемые с учетом риска нарушения со стороны дыхательной системы, подгруппу Б – без учета риска. Подгруппы не отличались по полу, возрасту, размеру и типу грыж передней брюшной стенки. Учет риска или отсутствие такового заключался в выборе того или иного относительно безопасного и эффективного способа герниопластики (ушивание грыжевого дефекта, герниопластика с аллопротезированием или поэтапный вариант грыжесечения с адаптацией краев раны) при прочих равных условиях. На вторые сутки после операции у всех больных исследовали сатурацию кислорода с помощью пульсоксиметрии.
Таблица 1. Параметры ФВД и капнометрии до и после операции у больных с размерами грыжевого дефекта до 8 см (n=28)
По результатам проведенного обследования у больных в подгруппе 2А, у которых учитывался риск возможного ухудшения со стороны легких в раннем послеоперационном периоде, сатурация кислорода была достоверно выше, чем у пациентов в подгруппе 2Б. В подгруппах 1А и 1Б оцениваемые параметры достоверно не отличались (табл. 3).
Таблица 2. Параметры ФВД и капнометрии до и после операции у больных с размерами грыжевого дефекта более 8 см (n=38)
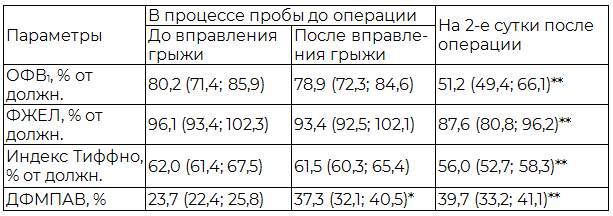
Примечания: * - достоверное различие параметров до и после вправления грыжи в процессе проведения пробы до операции при р<0,05; ** - достоверное различие параметров до и на 2-е сутки после операции при р<0,05.
Таблица 3. Различия параметров в исследуемых подгруппах с (1А, 2А) и без (1Б, 2Б) учета риска респираторных нарушений в раннем послеоперационном периоде на основании данных капнометрии
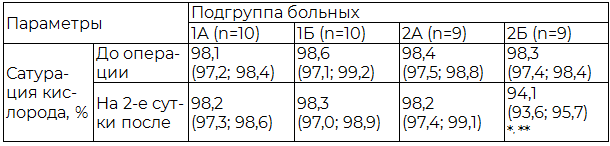
Примечания: * - достоверное различие исследуемых параметров до и на 2-е сутки после операции при уровне значимости р<0,05; ** - достоверное различие исследуемых параметров между подгруппами 2А и 2Б при уровне значимости р<0,05.
В соответствии с результатами исследования, описанные выше пробы с применением спирометрии и капнометрии неравнозначны. Отсутствие изменений параметров ФВД в процессе проведения пробы до операции может объясняться достаточной выраженностью субъективного компонента спирометрического исследования. Величина оцениваемых потоковых показателей напрямую зависит от воли самого обследуемого, и далеко не всегда можно контролировать правильность выполнения методики.
Выраженное снижение оцениваемых параметров ФВД в раннем послеоперационном периоде у больных с большими размерами грыжевого дефекта (более 8 см), соответственно большим объемом оперативного вмешательства и размерами операционной раны, можно объяснить возникновением более выраженных болевых ощущений у данной категории пациентов, отсутствием достаточного усилия брюшной стенки при выполнении маневра форсированного выдоха, что значительно влияет на результаты спирометрии.
Капнометрическая проба с определением ДФМПАВ оказалась более состоятельной в плане прогнозирования возможного нарушения функции легких у больных ХОБЛ в раннем послеоперационном периоде. Отсутствие изменений ДФМПАВ или ее увеличение (но не превышающее норму – 35%) по результатам проведенной пробы может свидетельствовать об относительно благоприятном прогнозе при проведении герниопластики в отношении функционирования респираторной системы. Если значение ДФМПАВ в процессе проведения пробы становится выше 35%, возможно существенное нарушение функции легких в раннем послеоперационном периоде, требующее в некоторых случаях активных мероприятий, включая кислородотерапию, вспомогательную вентиляцию легких с целью предотвращения дальнейшего ухудшения. Капнометрия не требует активного участия пациента с выполнением каких-либо специальных дыхательных маневров, соответственно более предпочтительна по сравнению со спирометрией.
У больных ХОБЛ и вентральными грыжами, которым планируется оперативное лечение, важно на дооперационном этапе прогнозировать возможные нарушения со стороны респираторной системы как проявления синдрома абдоминальной компрессии, так как это позволяет своевременно выбрать относительно безопасный вариант оперативного вмешательства, тактику ведения пациента, что может способствовать уменьшению частоты послеоперационных осложнений, снижению продолжительности госпитализации.
