Пневмонии остаются ведущей проблемой среди инфекционных болезней в связи с увеличением инфицирования и летальности, несмотря на применение современной химиотерапии и вакцинации [7,12].
В этиологии пневмоний большое значение имеют вирусно-бактериальные ассоциации, в связи, с чем исследователи относят пневмонии в группу острых респираторных инфекций [8,9]. В патогенезе воспаления существенное значение имеет микроциркуляторное русло [14] которое окружает элементы паренхимы и стромы, снабжая их питательными веществами и удаляя продукты метаболизма [6]. Легочные капилляры являются частью микроциркуляторного русла легких и представлены двумя видами: альвеолярными и плевральными. В данной работе исследованы альвеолярные капилляры, занимающие в норме около 75% поверхности альвеол [4].
Основное функциональное назначение альвеолярных капилляров – обеспечение газообмена [4], хотя при патологических процессах микроциркуляторное русло приобретает ведущее значение как место наиболее активной смены клеточных популяций [2]. Морфологические исследования при пневмониях показали, что в артериальном отделе сосуды микроциркуляторного русла спазмированы, в то время как в венулах наблюдается вазодилятация [3]. При этом изменению капилляров при пневмониях уделяют меньшее внимание, хотя известно, что к особенностям патогенеза пневмоний следует отнести выход лейкоцитов в очаг воспаления преимущественно через альвеолярные капилляры [10,11,14,17].
Несмотря на то, что межклеточные взаимодействия между эндотелиоцитами и лейкоцитами при миграции последних из сосудов в очаг пневмонии достаточно изучены [13,15], количественные изменения эндотелиоцитов альвеолярных капилляров в очагах пневмоний в сравнении с интактной легочной тканью в доступной литературе нам не встретились.
Цель исследования. Провести количественную сравнительную морфологическую оценку эндотелиоцитов и диаметра альвеолярных капилляров в очагах и вне очагов пневмоний.
Материалы и методы. Исследования выполнены в опытной и контрольной группах. Опытную группу составил материал 51 аутопсии очаговых пневмоний. При бактериологическом исследовании опытной группы была получена смешанная бактериальная флора. Возраст умерших пациентов составил от 22 до 98 лет (средний возраст 62,54±15,78). Для патоморфологического исследования фрагменты легочной ткани отбирали таким образом, чтобы в одном гистологическом препарате имелись зоны легочной ткани с пневмонией и непораженные (интактные) пневмонией участки.
Контрольную группу составил материал 30 аутопсий пациентов не страдавших пневмонией в возрасте от 53 до 86 лет (средний возраст 73,5±9). При этом в каждом случае для морфологической оценки стандартно забиралось по одному фрагменту верхней и нижней доли правого и левого легкого; таким образом, в контрольной группе исследовалось по 4 фрагмента легочной ткани из каждого случая.
Фрагменты легких, забранные для гистологического исследования, фиксировали в 10%-м водном нейтральном растворе формалина и подвергали парафиновой проводке. Окраску гистологических срезов толщиной 4-5 мкм осуществляли гематоксилином и эозином.
Морфометрическое исследование проводили на микроскопе Olympus CX-21 при увеличении х1000 (окуляр х10 и объектив х100). С учетом технических характеристик микроскопа при данном увеличении площадь поля зрения составляет 21969,11 мкм², в то время как площадь всего гистологического среза равна 1 см² (то есть 107 мкм²). В каждом микропрепарате легочной ткани опытной и контрольной групп исследования осуществляли в 10 полях зрения, подсчитывая абсолютное количество эндотелиоцитов. При этом в опытной группе подсчет проводили в очаге и вне очага пневмонии, а альвеолярные капилляры межальвеолярной перегородки помещали в центр поля зрения. Учитывали все эндотелиоциты поля зрения. Поля зрения каждого из 10 последующих исследований микропрепарата не перекрывались. Таким образом, проведено количество измерений эндотелиоцитов в опытной группе: 510 в очаге П (n=510) и 510 вне очага П (n=510). В контрольной группе проведено 1200 количественных измерений эндотелиоцитов (n=1200).
Оценка диаметра альвеолярных капилляров проводилась только в опытной группе и также осуществлялась в 10 полях зрения при аналогичных условиях. В опытной группе исследовано 510 альвеолярных капилляров в очаге пневмонии и 510 капилляров вне очага пневмонии. Измерения осуществляли с помощью светооптического микроскопа «Axiostar plus» (Carl Zeiss, Германия), совмещенном с видеокамерой «Progres C10 Plus» (Jenoptic Jena, Германия) при увеличении х1000 (окуляр х10 и объектив х100). Документирование результатов происходило при помощи компьютерной программы «Видио Тест 4.0 Морфология» - (Санкт-Петербург). Хранение результатов исследования и первичная обработка материала проводилась в базе данных Microsoft Excel 2000.
Статистическая обработка данных осуществлялась пакетом Microsoft Excel 2000. Формулы и методы статистического анализа использовали из руководства [1]. Оценка согласия распределения показателей с нормальным законом осуществлялась с помощью критерия Шапиро-Уилка. Поскольку выборки эндотелиоцитов и диаметра альвеолярных капилляров были распределены ненормально, то для описания центральной тенденции распределения данных использовали медиану, нижний и верхний квартиль. Учитывая, что выборки в опытной группе (очаг - вне очага пневмонии) являются зависимыми, то для сравнительного анализа эндотелиоцитов и диаметра капилляров данной группы использовался парный критерий Т-Вилкоксона, тогда как для сравнительного анализа эндотелиоцитов опытной и контрольной группы применялся U-критерий Манна-Уитни, так как опытная и контрольная группа являются независимыми выборками. Статистические гипотезы проверялись на уровне значимости p=0,05.
Результаты исследования и их обсуждение. Показатели центральной тенденции распределения эндотелиоцитов опытной и контрольной группы представлены в табл. 1.
Таблица 1. Результаты распределения эндотелиоцитов опытной и контрольной групп исследования
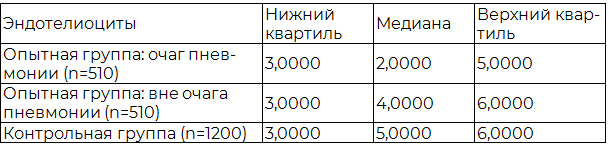
Анализируя полученные данные, можно отметить, что в очагах пневмоний количество эндотелиоцитов уменьшается, что выражается в более низких показателях медианы и верхнего квартиля по сравнению с зоной вне очагов опытной группы и контрольной группой исследования. В тоже время, в контрольной группе наблюдается картина схожая с интактной легочной тканью опытной группы исследования. Исходя из этого, можно предположить, что по мере удаления от очага пневмонии количество эндотелиоцитов становится больше. Для подтверждения этого был проведен сравнительный количественный анализ эндотелиоцитов очагов пневмоний и интактной легочной ткани опытной группы исследования по методу парного критерия Т–Вилкоксона, который отражает значимые различия между сравниваемыми выборками (p<0,05).
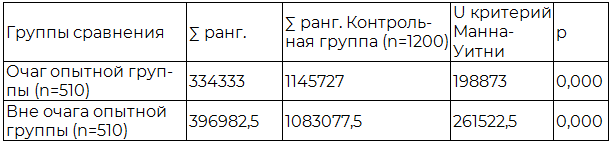
Сравнительный анализ эндотелиоцитов альвеолярных капилляров опытной и контрольной группы, проведенный с использованием U-критерия Манна-Уитни показан в табл. 2 и также отражает значимые различия между сравниваемыми выборками (p<0,05).
Значимые различия эндотелиоцитов между выборками опытной группы исследования, а также между выборками опытной и контрольной группы обусловлены уменьшением количества эндотелиоцитов в очаге и вне очага пневмонии опытной группы.
Таблица 2. Результаты сравнительного анализа эндотелиоцитов опытной и контрольной групп исследования
Это наиболее вероятно связано с обратимым и необратимым повреждением эндотелиоцитов, которое может развиться при лейкодиапедезе в очаге пневмонии [4,5,14], а также при действии медиаторов воспаления, как в очаге, так и в интактной легочной ткани опытной группы [15].
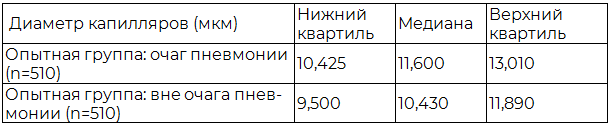
Показатели центральной тенденции распределения диаметра альвеолярных капилляров опытной группы представлены в таблице 3.
По результатам таблицы 3 можно отметить относительную вазоконстрикцию альвеолярных капилляров интактной легочной ткани по сравнению с очагом пневмонии, что может быть связано с сокращением миофибробластов межальвеолярных перегородок [12].
Таблица 3. Результаты распределения диаметра альвеолярных капилляров опытной группы исследования
Статистическим подтверждением вазоконстрикции явился сравнительный количественный анализ диаметра альвеолярных капилляров очагов пневмоний и интактной легочной ткани опытной группы исследования проведенный по методу парного критерия Т – Вилкоксона, который отражает значимые различия между сравниваемыми выборками (p<0,05).
Таким образом, сравнительный анализ диаметра альвеолярных капилляров при пневмониях показал, что воспаление приводит к относительной дилятации альвеолярных капилляров, наиболее выраженной в очаге и менее – вне очага пневмонии по сравнению с нормальными показателями (5-10 мкм, [4]), что согласуется с литературными данными о том, что альвеолярные капилляры реагируют на различные повреждения преимущественно вазодилятацией [16].
Заключение. Проведенное исследование показывает, что пневмонии приводят к повреждению эндотелиоцитов, что выражается в уменьшении их количества, которое выявляется при морфологическом исследовании. Альвеолярные капилляры очага пневмонии реагируют на острое воспаление преимущественно вазодилятацией, а капилляры периферии очага пневмонии - относительной вазоконстрикцией.
