Введение. Хроническая обструктивная болезнь легких (ХОБЛ) – одна из важных современных медико-социальных проблем. ХОБЛ является частой причиной инвалидности и в настоящее время занимает 4 место среди основных причин смертности в мире, а к 2020 году – переместится на 3 место. Основной причиной инвалидности у больных ХОБЛ является функциональная недостаточность легочной ткани вследствие морфологических изменений в ней. Морфологическими признаками ХОБЛ являются очаговый и диффузный пневмофиброз, развитие эмфиземы легких [5]. Главная задача в лечении ХОБЛ – предотвращение или замедление прогрессирования болезни. Объем лечебных мероприятий зависит от степени тяжести заболевания и определяется индивидуально для каждого пациента с ХОБЛ и зависит от тяжести симптомов, степени нарушений функции внешнего дыхания, частотой и тяжестью обострений, наличием осложнений, наличием и тяжестью сопутствующих заболеваний, общим состоянием здоровья. Лечение больных ХОБЛ в стабильный период носит ступенчатый характер: ступенчатое увеличение объема терапии в зависимости от тяжести заболевания [1]. В период обострений несомненным фактом является необходимость в расширении объема терапии. Обострения могут быть как неинфекционными, так и инфекционными. Последние обусловлены хронической бактериальной инфекцией дыхательных путей при ХОБЛ и обструкцией их слизью. Наличие большого количества вязкой слизи способствует размножению микроорганизмов и задерживает санацию бронхиального дерева, а инфекционное воспаление в свою очередь стимулирует образование слизи. Методом, визуализирующим состояние трахеобронхиального дерева (ТБД) при ХОБЛ, является фибробронхоскопия. Лабораторное исследование бронхоальвеолярного секрета (БАС) позволяет подтвердить его воспалительный характер. При бактериальном воспалении санирующие свойства БАС снижаются за счет нарастания его щелочности. Определение рН ТБД во время фибробронхоскопии может дать представления о направлениях терапии, особенно если количество БАС достаточно скудное и кашель у пациента малопродуктивный.
В клинической практике сочетание ХОБЛ и сахарного диабета (СД) II типа является достаточно частым и сопровождается более быстрым падением легочных объемов, чем только при ХОБЛ. Результаты исследования показывают, что у пациентов, страдающих сахарным диабетом, при микроскопическом изучении определяется периартериальный и перибронхиальный фиброз очагового и диффузного характера, межальвеолярный протеиноз, склероз сосудистых стенок. В просвете альвеол наблюдалась увеличенная концентрация альвеолярных макрофагов, утолщение базальных мембран, перикапиллярные узелки в интеральвеолярных перегородках [3].
Согласно результатам исследования, были выделены специфические и неспецифические морфологические признаки поражения легочной паренхимы. К неспецифическим морфологическим изменениям относятся: межральвеолярный и интерстициальный отеки, интерстициальный фиброз, склеротические изменения стенок артерий, скопление альвеолярных макрофагов. К специфическим морфологическим признакам относятся перикапиллярные узелки в интеральвеолярных перегородках, гранулематозные периваскулярные образования, утолщение мембран спавшихся капилляров.
Наиболее часто наблюдаемыми специфическими морфологическими признаками было изменение легочной паренхимы у больных СД (около 75 % случаев), которое проявлялось утолщением базальных мембран капилляров и мелкой сосудистой сети. Перикапиллярные узелки в интеральвеолярных перегородках встречались в 58,3 %, гранулематозные периваскулярные образования - в 50 %, спавшиеся капилляры – около 50 % случаев.
К специфическим рентгенологическим признакам сахарного диабета относят: округлые очаговые тени размером 2–5 мм, которые были обнаружены у 85,6 % пациентов, утолщение междольковых перегородок и стенок вен у 100 % больных, симптом «матового стекла» наблюдался у 57%. Специфические рентгенологические признаки обнаружены у пациентов при значительных проявлениях диабетической ретинопатии, преимущественно на второй и третьей стадиях и нефропатии на фоне тяжелого длительного течения сахарного диабета и характерны для обоих типов заболевания. Причиной указанныхизменений при СД рассматривают микроангиопатию с образованием перикапиллярных узелков в интраальвеолярных перегородках, гранулематозные периваскулярные образования, утолщение мембран спавшихся капилляров.
Рентгенологически это проявляется наличием округлых очаговых теней размером 2–5 мм, которые были обнаружены у 85,6 % пациентов, симптомом «матового стекла» - у 57 %. В легких диабетическая микроангиопатия имеет диффузный характер [3].
Клиническая картина сочетания ХОБЛ и СД чаще всего проявляется с рано сформировавшейся интенсивной одышкой вследствие нарушенной микроциркуляции в легочной паренхиме, мало– или непродуктивным кашлем, частые рецидивы ХОБЛ и затяжное течение.
При достаточно подробном изучении рентгенологической картине легких при ХОБЛ и СД эндоскопическая картина ТБД при их сочетании, которая может дать представление о причинах клинических особенностей ХОБЛ у больных СД, остается недостаточно описанной. Вот почему морфологические особенности бронхов при ХОБЛ в сочетании СД II типа нуждаются в исследовании для разработки путей замедления развития изменений в бронхах и легочной ткани, а также дыхательной недостаточности у больных и улучшении качества их жизни.
Цель исследования – изучить состояние трахеобронхиального дерева и легочной ткани у больных ХОБЛ, сочетанным с сахарным диабетом II типа.
Материал и методы исследования. В исследование были включены 85 больных с инфекционным обострением ХОБЛ кл. группы В (GOLD II), в т.ч. с ХОБЛ в сочетании с СД II типа в легкой форме в фазе компенсации – 43 человека (I группа), с ХОБЛ без СД – 42 пациента (II группа). Диагнозы ХОБЛ и СД II типа, клиническую группу, степень тяжести и объем их терапии устанавливали в соответствии с существующими рекомендациями [8]. Средний возраст обследованных пациентов составлял 52,4±3,2 лет. Срок заболевания ХОБЛ равнялся 5,8±0,9 лет, СД – 2,1±0,4 г. Диагноз ХОБЛ предшествовал диагностике СД у большинства пациентов (78 – 96 %). Среди обследованных мужчин было 79 (93 %), женщин – 6 (7 %). Все больные, включенные в исследование, были курильщиками. Индекс курения составил 24,3±1,8 пачка-лет. Для обследования паципентов примененяли клинические и лабораторные методов. Функцию внешнего дыхания изучали с помощью компьютерного спирографа Spirobank (MIR, Италия). Состояние трахеобронхиального дерева (ТБД) оценивали с помощью бронхоскопа OLYMPUS (Япония), пристеночное рН – с помощью методики селективной пристеночной рН-метрии с использованием аппаратно-программного комплекса компьютерной внутриполостной рН-метрии, разработанного Чернобровым В.М. и соавт. (1999) [4]. Измерение рН осуществляли в области карины трахеи, справа и слева в области шпоры верхнего долевого бронха, справа шпоры среднего долевого бронха, справа и слева в нижнем долевом бронхе, а также в симметричных участках на уровне сегментарных и субсегментарных бронхов. Рентгенологическое обследование включало рентгенографию органов грудной клетки в прямой и боковой проекции (при показаниях выполнялась компьютерная томография), результаты сопоставлялись с таковыми у больных с бронхолегочными заболеваниями, опубликованными в литературе.
Для выработки референтной нормы показателей были обследованы 34 практически здоровых добровольца такого же пола и возраста. Для определения достоверности различий показателей в группах использовали непараметричесий статистический t-критерий Вилкоксона, где различия считались значимыми при р<0,05.
Результаты и их обсуждение. В периоде обострения на повышенную температуру тела до 37,5 – 38,2оС жаловались 18 пациентов (41,9 %) I группы и у 13 больных (30,9 %) IІ группы. Все больные (100 %) в обеих обследованцых группах отмечали потливость, общую слабость, головную боль. У всех пациентов с ХОБЛ (100 %) и ХОБЛ, сочетанным с СД II типа (100 %), наблюдалась одышка смешанного характера при незначительной физической нагрузке – ходьба по ровной поверхности, надсадный кашель, беспокоивший их в течение суток, чаще в утренние часы после вставания с постели. У 29 больных (67,40%) I группы и у 36 пациентов (85,7%) II группы отмечался продуктивный кашель с выделением значительного количества – до 30-50 мл вязкой мокроты желтого, желто-зеленого или серого цвета. У 9 больных (20,9%) I группы и у 3 (7,1%) – II группы отмечался кашель со скудной мокротой серо-зеленого или серого цвета; 5 пациентов (11,6%) I группы и 3 (7,1%) – ІІ группы мокроту не выделяли, и их беспокоил надсадный сухой кашель. При исследовании клинического течения ХОБЛ у лиц с СД в других исследованиях также отмечались более часто непродуктивный или малопродуктивный кашель [2]. У 37 больных (86,0%) I группы и у 39 лиц (92,9%) ІІ группы наблюдались дистанционные свистящие хрипы, чувство постоянной тяжести в грудной клетке, сдавления грудной клетки и выслушивались свистящие, а также крупно- и среднепузырчатые хрипы. У 6 пациентов (14%) I группы и у 3 (7,1%) аускультировалось ослабленное везикулярное дыхание.
При спирометрическом исследовании у пациентов I группы уровень объема форсированного выдоха за 1-ю сек. (ОФВ1) составлял (58,3±3,7)%, жизненная емкость легких (ЖЕЛ) – (63,4±2,9)%, ОФВ1/ФЖЕЛ (форсированная жизненная емкость легких) – 64,4±2,1% после приема бронхолитика.
У больных II группы ОФВ1 равнялся (60,1±4,2)%, ЖЕЛ – (72,9±3,2)%, ОФВ1/ФЖЕЛ=68,9±3,2%. При ЖЕЛ и соотношение ОФВ1/ФЖЕЛ у лиц II группы были достоверно меньше аналогичных в I группе в 1,15 раза и 1,07 раза соответственно (р <0,05).
Из 35 бронхоскопически обследованных пациентов I группы у 15 (42,8%) пациентов был выявлен гнойный эндобронхит, у 14 (40,0%) диагностировался диффузный катарально-гнойный эндобронхит, у 2 (5,7%) – ограниченный катарально-гнойный эндобронхит, а у 4 (11,4%) – атрофический эндобронхит. У всех обследованных больных отмечалась деформация сегментарных бронхов с сохранением их проходимости, у 1 больного (2,9%) – дискинезия мембранозной части трахеи (коллапс до 50% просвета). У этого больного приступы кашля регистрировались чаще в дневные часы после физической или голосовой нагрузки, смеха, кашля.
У больных II группы ограниченный катарально-гнойный эндобронхит был выявлен у 13 (30,9%) из 40 обследованных с помощью бронхоскопии или в 1,3 раза чаще, чем в I группе. Диффузный катарально-гнойный эндобронхит был диагностирован у 18 пациентов (42,%), гнойный – в 10 случаях (23,8%), атрофический эндобронхит отмечался у 2 больных (4,8%). Деформация устьев сегментарных бронхов с сохраненной проходимостью была отмечена у 21 больного с ХОБЛ (52,5%). Эндоскопическая характеристика ТБД больных I группы характеризует негативное влияние сопутствующего СД II типа на течение ХОБЛ у пациентов, что отмечено и в других исследованиях при сочетании данных заболеваний [2].
При рН-метрии в основных участках ТБД было выявлено, что у здоровых лиц величины пристеночного рН на симметричных участках ТБД существенно не различались между собой, что показано в таблице 1.
Таблица 1. Состояние рН ТБД обследованных больных ХОБЛ (М±m)
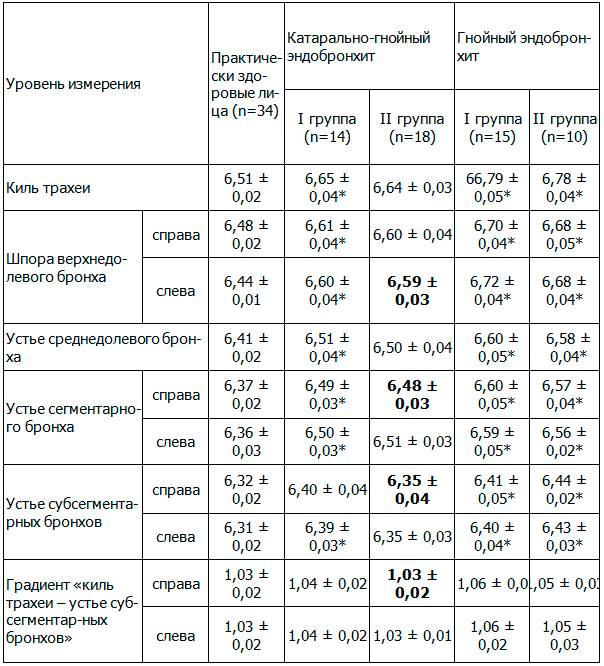
Примечания:
- – *р<0,05 при сравнении с практически здоровыми лицами,
- – р<0,05 (выделено жирным шрифтом) при сравнении показателей между пациентами с разной степенью тяжести эндобронхита.
У больных обоих групп с гнойным эндобронхитом отмечались более высокие значения показателей рН – (6,79±0,05) у.е. При этом максимальные показатели, т.е. более щелочная среда, были зафиксированы в проксимальных отделах ТБД. Градиент рН между участками «киль трахеи-устье субсегментарных бронхов» при гнойном эндобронхите равнялся (1,06±0,04), а разница рН между этими отделами ТБД достигала (5,9±0,03)%, что объяснялось наличием щелочного секрета в проксимальных участках ТБД за счет наличия выраженного бактериального воспаления, что сопровождалось увеличением осмолярности бронхоальвеолярного секрета, возможно, за счет уменьшения золевого компонента секрета бокаловидных клеток и увеличения гелевой его части. При этом с увеличением степени тяжести эндобронхита и гнойности бронхоальвеолярного секрета щелочность в симметричныхь участках ТБД возрастала. Аналогичные данные при диффузном катарально-гнойном эндобронхите при ХОБЛ были получены у больных тяжелой персистирующей бронхиальной астмой с такими же проявлениями эндобронхита [1].
При гнойном эндобронхите градиент рН на участке «киль трахеи-устье субсегментарных бронхов» был выше такового. Следует отметить, что достоверной разницы рН и его градиента между исследуемыми группами не отмечалось: у пациентов II группы различие носило характер тенденции в сторону увеличения щелочности.
При рентгенологическом исследовании больных I группы выявлялись эмфизема легких и полисегментарный пневмофиброз в 34 случаях (79,1%), ограниченный пневмофиброз с эмфиземой легких – у 9 больных (20,9%), в т.ч. у 21 пациента (48,8%) в прикорневой зоне выявлялся симптом «матового стекла». В нашем исследовании он встречался несколько реже, чем при рентгенологических исследованиях больных с СД II типа без ХОБЛ [3], что возможно, объясняется наличием ХОБЛ, которая обусловила более выраженные изменения морфологии ТБД у лиц с сочетанием ХОБЛ и СД. У пациентов II группы эмфизема легких и ограниченный пневмофиброз встречались в 14 случаях (33,3%), эмфизема легких и полисегментарный пневмофиброз диагностировались у 22 больного (52,4%), у 6 лиц (14,3%) – имели место уплотнение и тяжистость корней легких, деформация легочного рисунка. Указанные изменения способны вызывать более быстрое падение легочной функции у пациентов с сочетанием ХОБЛ и СД II типа, чем только при ХОБЛ [6].
У пациентов I группы выявлена средней силы корреляционная зависимость между ОФВ1 и градиентом рН на участке «киль трахеи-устье субсегментарных бронхов» при гнойном эндобронхите (r=+0,514, p<0,05). У больных II группы такая корреляция была слабой (r=+0,302, p<0,05). У больных с диффузным катарально-гнойным эндобронхитом корреляционные завивсимости ни с одним из параметров рН и показателями спирометрии не прослеживались.
Таким образом, у больных ХОБЛ, сочетанной с СД II типа, отмечались более выраженные клинические проявления основного заболевания в виде одышки и надсадного кашля, который реже, чем во II группе, был продуктивным с гнойной мокротой. У этих же пациентов несколько чаще был отмечен атрофический эндобронхит. Указанные изменения у пациентов I группы сочетались с более часто встречающимся диффузным катарально-гнойным эндобронхитом и деформацией бронхов, полисегментарным пневмофиброзом и эмфиземой легких, уплотнением корней легких и повышением пристеночного рН бронхов с увеличением градиента рН на уровне «киль трахеи-устья субсегментарных бронхов», смещением рН в ТБД в щелочную сторону, что потенциально снижает санирующие свойства трахеобронхиального секрета и утяжеляет течение ХОБЛ.
Выводы:
- Клиническое течение ХОБЛ у пациентов с СД II типа характеризовалось более частым, чем только при ХОБЛ, наличием малопродуктивного или непродуктивного кашля, одышки и ослабленного везикулярного дыхания при аускультации.
- При рентгенологическом исследовании у пациентов с сочетанием ХОБЛ и СД II типа эмфизема легких и полисегментарный пневмофиброз встречались в 1,5 раза чаще, чем у пациентов с ХОБЛ без СД.
- Диффузный катарально-гнойный и гнойный эндобронхит у лиц с ХОБЛ и СД отмечался чаще и сопутствовал более тяжелому клиническому течению ХОБЛ.
- У больных с ХОБЛ и ХОБЛ, сочетанным с СД II типа, отмечено смещение рН ТБД в щелочную сторону, которое соотносилось со степенью тяжести эндобронхита.
- Градиент рН на участке «киль трахеи-устье субсегментарных бронхов» прямо коррелировал с ОФВ1 у больных с гнойным бронхитом, при этом сила корреляционной зависимости была больше у пациентов с сочетанием ХОБЛ и СД II типа.
