Введение. Хроническая обструктивная болезнь легких является одним из самых распространенных заболеваний органов дыхания, при котором, с учетом возраста старта болезни, имеют место коморбидные состояния [9]. Сочетание хронической обструктивной болезни легких (ХОБЛ) и сахарного диабета (CД) II типа в связи с высокой распространенностью обоих заболеваний является достаточно частым и встречается до 16 % случаев. Данные заболевания рассматривают патогенетически связанными и негативно влияющими друг на друга [12]. Системная гипоксия при ХОБЛ, запуская механизмы стимуляции процессов перекисного окисления липидов, способствует развитию оксидативного стресса, который усугубляет процессы ферментативного аутоокислительного гликозилирования, что при сочетании с СД ІІ типа приводит к развитию осложнений, таких как микро- и макроангиопатии [10]. Однако, микроциркуляторные нарушения при указанной коморбидности связаны не только с состоянием стенки микрососудов, но и с особенностями клеток крови, которые по ним движутся [2]. При снижении эритроцитов способности к деформации развивается сладж-феномен [13]. При ХОБЛ было выявлено повышение агрегационной способности тромбоцитов (АСТр), которое, негативно влияя на микроциркуляцию [11], могут способствовать усугублению микроангиопатий при СД ІІ типа. Однако, морфология и функция основных клеток крови, определяющих микрогемодинамику, и состояние последней при коморбидности ХОБЛ и СД ІІ типа требует дальнейшего изучения для поиска путей повышения эффективности лечения и профилактики развития осложнений.
Цель работы – изучить состояние микрогемодинамики у больных ХОБЛ, сочетанной с СД ІІ типа.
Материал и методы исследования. Исследование проведено у 75 пациентов с инфекционным обострением ХОБЛ клинической группы В (GOLD II) в среднем возрасте (53,5±2,9), в т.ч. у 69 мужчин (92%) и 6 женщин (8%). Среди обследованных было 37 больных с ХОБЛ, сочетанной с СД ІІ типа, – основная группа и 38 пациентов с ХОБЛ без СД II типа – группа сравнения. У всех пациентов, наряду с общеклиническими методами, изучали состояние микроциркуляции методом биомикроскопии бульбарной конъюнктивы с помощью щелевой лампы ЩЛ-2М (ЗОМЗ, РФ) в соответствии с опубликованными рекомендациями [1, 4] с вычислением конъюнктивальных индексов – КИ1 (сосудистые изменения), КИ2 (внутрисосудистые изменения) и КИ3 (периваскулярные изменения). Общий конъюнктивальный индекс КИобщ рассчитывали как сумму трех индексов (КИ1 + КИ2 + КИ3). Внутрисосудистую агрегацию форменных элементов крови наблюдали при наличии сладж-феномена по N.Н. Knisely (1965) [13]. Спонтанную и АДФ- индуцированную АCТp изучали с использованием стандартного раствора АДФ (аденозин-5-дифосфат динатриевая соль, «Ренам») в концентрации 2,5 и 5 мкм/л на лазерном агрегометре НПФ БИОЛА 230 LA.
Определяли СПсп - показатель степени спонтанной агрегации по кривой светопропускания, СПадф - показатель АДФ-индуцированной агрегации по кривой светопропускания, СРАсп – средний радиус агрегации по кривой светопропускания, СРАадф – показатель среднего радиуса АДФ-индуцированной агрегации по кривой светопропускания, СРМНсп – максимальный наклон кривой среднего радиуса спонтанной агрегации, СРМНадф – максимальный наклон кривой среднего радиуса АДФ-индуцированной агрегации, СРt – время максимальной агрегации по кривой среднего радиуса, СРДА – степень дезагрегации.
Морфофункциональное состояние эритроцитов оценивалось по среднему корпускулярному объему эритроцитов (MCV) – на анализаторе К-1000 («Sysmex», Япония) и сорбционной способности их мембран (ССМЭ) по методике А.А. Тогайбаева и соавт. (1988) [8]. Исследования указанных данных проводили в первые 1-2 дня поступления в стационар и перед выпиской. Для выработки референтной нормы были обследованы 32 практически здоровых добровольца такого же пола и возраста. Для определения достоверности различий показателей в группах использовали непараметрический статистический t-критерий Вилкоксона, где различия считались значимыми при р<0,05.
Результаты и их обсуждение. Исходный показатель MCV у больных основной группы составлял (82,9±1,2) fL, что соответствовало контрольным значениям, но было выше, чем в группе сравнения, на 4,4%. К выписке МCV несколько уменьшался, равнялся (80,4±3,2)fL, но контрольных значений не достигал.
У больных основной группы величина ССМЭ составляла (53,8± 3,2)% или была в 1,8 раза (р<0,001) выше контрольных значений и в 1,2 раза (р< 0,05) превышала показатель лиц группы сравнения. После лечения обострения ХОБЛ, сочетанной с СД II типа, ССМЭ достоверно снизилась до (39,3± 2,7)%, но осталась выше нормы в 1,3 раза (р<0,01) .
Величина MCV у больных группы сравнения составляла (79,4±2,8) fL, что было на 6,9% (р<0,05) ниже аналогичного показателя здоровых лиц -(85,3±3,1) fL, существено не изменялась на фоне лечения, но контрольных значений не достигла и составила (79,9±2,3) fL. Исходная ССМЭ у пациентов группы сравнения равнялась (43,1± 2,7)%, была в 1,5 раза выше (р<0,001) показателя здоровых лиц, а перед выпиской - снизилась до верхней границы нормы (29,6±2,1)%. Изменения размера эритроцитов и повышенная способность их мембран к сорбции токсических веществ потенциально снижают способность красных кровяных клеток к деформации при движении по микроциркуляторнму руслу, что было отмечено и в других исследованиях [10]. Формирование сладжа эритроцитов в микрососудах («монетные столбики») является фактором риска гиперагрегации в микрососудах, снижения текучести и замедления движения крови [6]. Все это снижает уровень метаболизма в клетках микрососудов и создает условия для нарушения функции эндотелия сосудов, ухудшения его вазодилятирующей функции, очевидно, за счет нарушения выработки оксида азота эндотелиальной NO-синтазой, на что, несомненно, влияет и наличие СД II типа у этих больных. Можно предположить, что указанные нарушения метаболизма клеток крови являются предпосылкой возникновения дисфункции эндотелия у больных ХОБЛ, сочетанной с СД II типа.
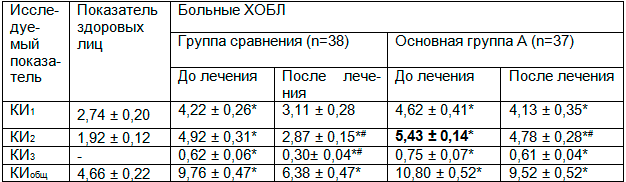
У больных основной группы при биомикроскпии бульбарной конъюнктивы в начале наблюдения значения КИ1 достоверно превышали аналогичный показатель здоровых лиц в 1,7 раза, и на 10 % – КИ1 больных группы сравнения. Наиболее выраженными были изменения КИ2, который в 2,8 раза (р<0,05) был больше, чем надлежащие значения, и также на 10 % превышал таковой у исследованных группы сравнения. КИ3 у пациентов основной группы на 12% превышал КИ3 в группе сравнения. Изменения всех конъюнктивальных индексов отражались на повышении КИобщ, который в 1,1 раза был выше такового у больных группы сравнения (табл. 1).
Таблица 1. Состояние микроциркуляторных показателей у исследованных больных (M ± m )
Примечание:
- * –р<0,05 при сравнении с показателями здоровых лиц;
- # – р<0,05 при сравнении показателей до и после лечения;
- р<0,05 (выделено жирным шрифтом) при сравнении показателей между группами.
Между МCV и КИ2 до лечения у больных основной группы существовала позитивная корреляционная зависимость средней силы (r = + 0,517, р<0,05), которая слабела после лечения (r = + 0, 363,р<0,05) и которой не было ни до, ни после лечения у пациентов из группы сравнения.
Перед выпиской у больных основной группы КИ1 несколько снизился, остался выше референтных значений в 1,5 раза (р<0,05). Жесткость сосудистой стенки, которую отражает данный показатель, является независимым неблагоприятным фактором развития сердечно-сосудистых осложнений при ХОБЛ [5] и характеризует неблагоприятный прогноз сочетанного течения ХОБЛ и СД ІІ типа по сравнению с ХОБЛ без указанной коморбидности. КИ2 уменьшился на 10 % от исходного уровня, но продолжил превышатьуровень здоровых лиц в 2,6 раза (р<0,001) и в 1,6 раза (р<0,01) – показатель в группе сравнения. КИ3 после лечения остался вдвое выше, чем в группе сравнения. При этом КИобщ стал выше референтной нормы в 2 раза (р<0,001).
Между показателем КИ2 и КИ3 и уровнем HbA1c в группе сравнения ни до, ни после лечения корреляционной связи выявлено не было, а в основной группе такие зависимости до лечения были слабыми положительными (r=+0,328, p<0,05) и (r=+0,336, p<0,05), что указывало на негативную роль повышения HbA1с в развитии микроциркуляторных внутри- и внесосудистых изменений. После курса лечения эти связи несколько ослабели: соответственно (r=+0,318, p<0,05) и (r=+0,323, p<0,05).
Таким образом, все КИ исследованных групп были повышенными, при этом наиболее значимо – за счет внутрисосудистого и паравазального компонентов. У пациентов основной группы показатели КИ1, КИ2, КИ3 и КИобщ были достоверно выше не только, чем у здоровых лиц, но и показателей больных группы сравнения и свидетельствовали о более выраженных нарушениях всех звеньев микроциркуляторного русла у больных ХОБЛ, сочетанной с СД II типа. При этом наиболее негативные изменения происходили во внутрисосудистом участке микроциркуляторного звена. На фоне базисного лечения у больных обеих групп отмечалось улучшение показателей микрогемоциркуляции. Однако, у больных основной группы динамика выявленных позитивных изменений была более медленной, чем в группе сравнения (у больных ХОБЛ без СД ІІ типа), что было сопряжено с менее выраженными позитивными изменениями всех КИ. Очевидно, медленный характер улучшения показателей на фоне лечения был связан с негативными морфологическими изменениями в микроциркуляторном русле больных ХОБЛ, сочетанной с СД II типа. Изменение микрокровотока у пациентов с ХОБЛ, отмеченное при присоединении АГ, оценено важным фактором, провоцирующим прогрессирование дыхательной недостаточности и сердечно-сосудистых осложнений [11]. Характер корреляционных зависимостей между показателями HbA1c и КИ подтверждали негативное воздействие гликозилированного гемоглобина на состояние внутрисосудистых изменений. Базисное лечение недостаточно эффективно способствовало их коррекции, что требует подбора рационального лечебного дополнения.
Исследованным пациентам было проведено изучение состояния агрегационной способности тромбоцитов (см. табл. 2).
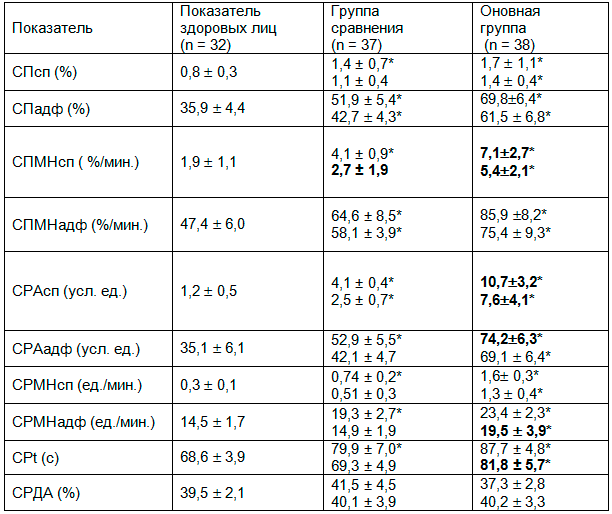
Таблица 2. Состояние агрегационной способности тромбоцитов у исследованных пациентов на фоне базисного лечения(M ± m)
Примечание:
- * -р< 0,05 при сравнении с контрольной группой;
- - р< 0,05(выделено жирным шрифтом) при сравнении между группами.
Следует отметить, что все показатели агрегационной способности тромбоцитов у больных основной группы и группы сравнения, кроме СРДА, в начале наблюдения были повышенными. Показатель СПсп у больных у больных основной группы был выше, чем в норме, в 2,1 раза (р<0,001), и чем таковой в группе сравнения – в 1,2 раза (р<0,05). Величина СПадф у больных в основной группе была выше, чем показатель здоровых, в 1,9 раза (р<0,001) и чем аналогичный в группе сравнения – в 1,3 раза (p<0,01). В основной группе СПМНсп превышал аналогичный у здоровых лиц в 3,7 раза (р<0,001), а таковой в группе сравнения – в 1,7 раза (p<0,01). СПМНадф у больных основной группы был достоверно больше, чем в норме, в 1,8 раза, и, чем в группе сравнения, - в 1,3 раза (p<0,001). СРАсп в основной группе в 8,9 раза превысил таковой у здоровых лиц и был выше, чем в группе сравнения, в 2,6 раза (p<0,001). Показатели СРАадф у больных основной группы были увеличенными в 2,1 раза в сравнении с референтными значениями и группы сравнения – в 1,4 раза (p<0,05). СРМНсп у больных в основной группе в 5,3 раза превысили значения у здоровых лиц, а выше, чем в группе сравнения, – в 2,2 раза (p<0,001).
Значения СРМНадф в основной группе в 1,6 раза были выше, чем референтная норма, и чем аналогичные в группе сравнения, – в 1,2 раза. Время максимальной агрегации СРt у больных основной группе А выявилось удлиненным относительно нормы – в 1,3 раза и в 1,1 раза больше, чем у больных группы сравнения. При этом СРДА в обоих исследованных контингентах больных существенно не отличался от нормы, что на фоне удлиненного времени максимальной агрегации подтверждало гиперагрегационнное состояние тромоцитов, которое было более выражено у больных основной группы.
После курса терапии обострения у больных основной группы значения СПсп осталась выше контрольных значений в 1,3 раза. СПадф также снизился, но менее интенсивно – в 1,13 раза от исходной величины, однако остался выше, чем в группе сравнения, в 1,4 раза (p0<0,05).
СПМНсп после лечения у пациентов основной группы снизился менее интенсивно – в 1,3 раза от начального, и остался достоверно выше, чем в норме, в 2,8 раза, превышая аналогичный в группе сравнения – в 2,0 раза (p<0,05). У больных основной группы СПМНадф также снизился незначительно после курса базисных средств терапии обострения – в 1,13 раза, и остался достоверно выше, чем в норме, в 1,6 раза (p<0,001) и выше, чем в группе сравнения в 1,3 раза (p<0,05).
СРАсп в основной группе к выписке снизился в 1,4 раза от исходного, достоверно превышая в 6,3 раза референтную норму и в 3,0 раза - аналогичный в группе сравнения. СРАадф пациентов основной группы после лечения остался выше аналогичного в норме вдвое и в 1,6 раза (p<0,01) – такового в группе сравнения. СРМНсп продолжил превышать условную норму в 4,3 раза (p<0,001), а в группе сравнения – в 2,5 раза (p<0,001). Величина СРМНадф у больных основной группы осталась выше референтной величины и аналогичной в группе сравнения, в 1,3 раза (p<0,05).
Время максимальной агрегации у больных основной группы СРt после курса терапии несколько снизилось - в 1,1 раза от исходного и осталось достоверно выше, чем в норме, в 1,2 раза, а показатель СРДА претерпел незначительные колебания в сторону увеличения. В то же время у больных группы сравнения к выписке большинство показателей агрегационной способности тромбоцитов достигли верхних границ референтной нормы.
Полученные данные свидетельствуют о стимуляции гиперагрегации тромбоцитов медиаторами воспалительного процесса при ХОБЛ [3, 7]. При наличии гиперагрегационной готовности в микрососудах повышается возможность тромбообразования. Микротромбы вызывают редукцию сосудистого русла, что приводит к нарушениям газообмена и повышению легочно-артериального сосудистого сопротивления, и, как следствие, – вторичной легочной гипертензии, ускорению развития осложнений в виде пневмофиброза. Сочетание гиперагрегационного состояния в микрососудах с поражением их при СД у больных ХОБЛ является существенным фактором риска прогрессирования и развития осложнений обоих заболеваний. Большинство показателей АСТр у больных основной группы остались существенно выше референтной нормы, отражая гиперагрегационную готовность к тромбообразованию в микроциркуляторном русле, что служит основанием для воздействия на механизмы, которые способствуют появлению гиперагрегации.
Выводы:
1) У больных с обострением ХОБЛ, сочетанной с СД ІІ типа, отмечается повышение сорбционной способности мембран эритроцитов, что потенциально делает их менее способными к деформации.
2) Обострение ХОБЛ, сочетанной с СД ІІ типа, способствует значительному повышению спонтанной и АДФ-индуцированной агрегационной способности тромбоцитов
3) Изменения морфологи и функции эритроцитов и тромбоцитов способствует микроциркуляторным нарушениям, наиболее значимым во внутри- и перивазальном отделах.
4) Базисные средства лечения обострения ХОБЛ и СД ІІ типа, не устраняют выявленных изменений, что повышает вероятность развития осложнений обоих заболеваний.
