Остеоартроз (ОА) – заболевание, поражающее значительную часть населения, как в нашей стране, так и зарубежом. Заболеваемость составляет 8,2 на 100000 населения, распространенность – 20% населения земного шара [8]. Данная нозология вносит наибольший вклад в общии показатели заболеваемости болезнями костно-мышечной системы. В период с 2000 по 2010 г. общее число больных ОА в РФ увеличилось более чем в 2 раза, число первично зарегистрированных больных ОА – на 10,3% [2]. Заболевание начинается преимущественно в трудоспособном возрасте. Преобладающий возраст лиц, страдающих ОА – 40-60 лет [8]. При этом заболевание ложится тяжелым бременем не только на самого больного, но и на его семью, на государство в целом. Экономический ущерб, связанный с заболеваемостью ОА, в ряде стран составляет от 1 до 2,5% валового национального продукта [10]. Значимыми составляющими решения проблемы ОА являются совершенствование ранней диагностики заболевания, разработка новых патогенетически обоснованных методов лечения, в основе которых лежат исследования, направленные на изучение глубинных механизмов развития ОА. В отечественной и зарубежной литературе встречаются единичные работы, рассматривающие изменения, происходящие в ферментных системах организма при ОА [1,3,4]. Представленный материал является фрагментом наших исследований по изучению активности энзимов пуринового метаболизма на фоне данного заболевания у работающих лиц г. Волгограда.
Материал и методы. Наблюдали 52 больных первичным ОА: 16 (30,8%) мужчин и 36 (69,2%) женщин. Среди них было 30 (57,7%) служащих и 22 (42,3%) представителя рабочих специальностей. Средний возраст (М±m) включенных в исследование лиц составил 46,8±2,5 лет, средняя продолжительность заболевания – 10,8±4,6 лет. Все испытуемые проходили комплексное клинико-инструментальное и общепринятое лабораторное обследование. Диагноз ОА установлен в соответствии с диагностическими критериями R. Altman et al. [6]. Локализованный ОА выявлен в 12 (23,1%) случаях (гонартроз - у 5, коксартроз – у 3, олигоартроз – у 4 больных), генерализованный ОА – в 40 (76,9%) случаях, узелковая форма – у 37 (71%), безузелковая форма – у 15 (29%), I рентгенологическая стадия (по J. Kellgren и J. Lawrence) – у 8 (15,4%), II стадия – у 36 (69,2%), III стадия – у 8 (15,4%), функциональный класс II (ФК II) – у 35 (67,3%), ФК III – у 17 (32,7%) пациентов. В 36 (69,2%) случаях наблюдались клинические и верифицированные при ультразвуковом исследовании явления выраженного синовита. Всем включенным в исследование пациентам была назначена стандартная схема лечения остеоартроза, в которую входили: алфлутоп (по 1 мл в день в/м ежедневно в течение 20 дней), диклофенак-ретард (100 мг в день), мидокалм (по 50-100 мг 3 раза в день), трентал (по 100 мг 2 раза в день), физиотерапевтические процедуры и занятия лечебной физкультурой. При явлениях выраженного синовита в течение первых трех дней лечения вместо перорального приема диклофенак вводили внутримышечно по 75 мг 2 раза в день.
Контрольную группу составили 30 практически здоровых лиц, сопоставимых по поло-возрастному составу с группой больных ОА (р>0,05).
Активность аденозиндезаминазы (АДА), АМФ-дезаминазы (АМФДА), адениндезаминазы (АД), гуаниндезаминазы (ГДА), ксантиндегидрогеназы (КДГ), ксантиноксидазы (КО), 5'-нуклеотидазы (5'-НТ) в сыворотке крови определяли по оригинальным методикам и выражали в нмоль/мин/мл [9,13,15,16,17,18]. Изоферменты АДА, КДГ разделяли при электрофорезе в агарозном геле, выражали в процентах [6,14,17]. Содержание мочевой кислоты (МК) определяли по общепринятой методике и выражали в ммоль/л [5].
Статистическая обработка данных проводилась с использованием программного пакета «Statistica 6.0». Вычислялись выборочные характеристики распределения: средняя М, среднее квадратическое отклонение σ. В случае нормального распределения признака и соблюдении условия равенства дисперсий в сравниваемых группах применяли параметрические критерии: двухвыборочный t-критерий Стьюдента, парный t-критерий Стьюдента, параметрический вариант однофакторного дисперсионного анализа. При невыполнении условий применимости параметрических критериев применялись U-критерий Манна-Уитни, критерий Вилкоксона, критерий Крускала-Уоллиса.
Результаты. При анализе энзимных показателей здоровых лиц в зависимости от пола и возраста различий выявлено не было (р>0.05).
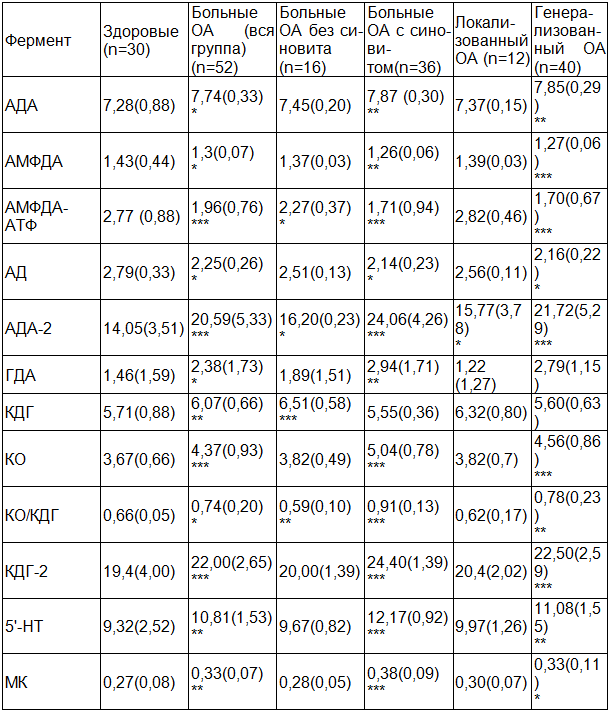
При поступлении на лечение больных ОА (группа в целом), по сравнению со здоровыми, отмечали существенные изменения в активности ферментов адениловой и гуаниловой ветвей пуринового метаболизма (ПМ), ферментов, катализирующих его заключительные этапы, а также увеличение митохондриальных фракций изоферментов АДА и КДГ, повышение содержания мочевой кислоты (табл. 1).
Через 2 недели лечения на фоне улучшения клинического состояния больных отмечалась некоторая положительная динамика энзимных показателей, но эти изменения были достоверными только для показателей активности АМФДА-АТФ (р<0.01). По окончании курса стационарного лечения, в стадии начинающейся клинической ремиссии, по сравнению с начальным этапом лечения, отмечалось существенное снижение активности АДА (р<0.001), ГДА (р<0.001), КО (р<0.001), 5¢-НТ (р<0.001), уменьшение суммарной активности КО и КДГ (р<0.01), изоэнзимов АДА-2 (р<0.001), КДГ-2 (р<0.001), увеличение активности АМФДА (р<0.001), АМФДА-АТФ (р<0.001), АД (р<0.001). Динамика МК и активности КДГ была незначительной (р>0.05).
При сравнении изученных показателей после курса лечения с показателями здоровых лиц оказалось, что показатели активности АДА, АМФДА, АМФДА-АТФ, АД, ГДА, 5¢-НТ, МК, изоэнзимов КДГ-2, коэффициенты КО/КДГ практически нормализовались, но показатели активности КО (р<0.05), КДГ (р<0.01), суммарной активности КО и КДГ (р<0.01), изоэнзимов АДА-2 (р<0.05) имели существенные отклонения от уровня здоровых лиц.
Учитывая клиническое разнообразие больных ОА, нами был проведен анализ взаимосвязей энзимных показателей с различными клиническими формами заболевания.
При поступлении на лечение больных ОА с синовитом, по сравнению со здоровыми изменения в ферментном профиле сыворотки крови носили тот же характер, что и при рассмотрении группы больных в целом, однако, были более выражены. Также данная группа пациентов имела наиболее высокое среди всех пациентов содержание МК (табл.1).
Таблица 1. Энзимные показатели при остеоартрозе, М(σ)
Примечания6 различия с группой здоровых лиц: * - р<0.05; ** - р<0.01; *** - р<0.001.
Через 2 недели лечения больных ОА с синовитом выявлены достоверные позитивные изменения показателей активности КДГ (р<0.05), 5¢-НТ (р<0.01), коэффициентов КО/КДГ (р<0.01), изоферментов АДА-2 (р<0.01). По окончании курса лечения, по сравнению с поступлением, отмечалось снижение активности АДА (р<0.01), ГДА (р<0.001), КО (р<0.001), повышение активности АМФДА (р<0.01), АМФДА-АТФ (р<0.001), АД (р<0.001), КДГ (р<0.001), уменьшение коэффициентов КО/КДГ (р<0.001), изоэнзимов КДГ-2 (р<0.001), активности 5¢-НТ (р<0.001), уменьшение концентрации МК (р<0.05). За исключением активности КДГ, ГДА (р>0.05), все другие показатели при выписке имели достоверные отклонения от границ нормы (P<0.05).
При обследовании перед началом лечения больных ОА без синовита, по сравнению со здоровыми, выявлены изменения меньшего числа энзимных показателей, чем при наличии клинически выраженного синовита: основные отклонения обнаружены в активности ферментов ксантиноксидазной системы, незначительные со стороны энзимов обмена адениловых нуклеотидов (АДА, АМФДА-АТФ) (табл.1).
По сравнению с больными с синовитом, у больных без синовита была ниже активность АДА (р<0.001), ГДА (р<0.05), КО (р<0.001), выше активность АМФДА (р<0.05), АМФДА-АТФ (р<0.05), АД (р<0.001), КДГ (р<0.001), меньше коэффициент КО/КДГ (р<0.001), изоферменты АДА-2 (р<0.001), КДГ-2 (р<0.001), ниже активность 5¢-НТ (р<0.001) и содержание МК (р<0.001).
Через 2 недели лечения в группе пациентов с ОА без синовита наблюдалось снижение активности АДА (р<0.05), повышение активности АМФДА (р<0.05), АМФДА-АТФ (р<0.001). Со стороны остальных энзимных показателей достоверной динамики не произошло. По окончании курса лечения, в стадии начинающейся клинической ремиссии, отмечено снижение активности АДА (р<0.001), 5¢-НТ (р<0.001), КДГ (р<0.05), суммарной активности КО и КДГ (р<0.01), повышение активности АМФДА (р<0.001), АМФДА-АТФ (р<0.001), уменьшение изоэнзимов АДА-2 (р<0.05), КДГ-2 (р<0.001). При выписке показатели активности АДА, АМФДА, АМФДА-АТФ, 5¢-НТ, КО, суммарной активности КО и КДГ, изоэнзимов АДА, КДГ, МК существенно не отличались от показателей здоровых лиц (р>0.05), и только оставались пониженным коэффициент КО/КДГ (р<0.01), повышенной - активность КДГ (р<0.05).
Анализируя энзимные показатели в зависимости от количества вовлеченных в патологический процесс суставов наиболее выраженные изменения в энзимном профиле сыворотки крови выявлены при генерализованном ОА.
При поступлении на лечение у больных с генерализованным ОА, по сравнению со здоровыми, отмечалось повышение активности АДА (р<0.01), 5¢-НТ (р<0.01), КО (р<0.001), суммарной активности КО и КДГ (р<0.001), увеличение коэффициентов КО/КДГ (р<0.01), изоэнзимов АДА-2 (р<0.001), КДГ-2 (р<0.001), снижение активности АМФДА (р<0.001), АМФДА-АТФ (р<0.001), АД (р<0.05) и увеличение содержания МК (р<0.05) (табл.1).
У больных с локализованным ОА при поступлении на лечение, по сравнению со здоровыми, достоверные различия обнаружены только по показателям активности изоэнзимов АДА-2 (р<0.05). Отмечалась также выраженная тенденция к повышению активности КДГ (р>0.05) (табл.1).
Учитывая, что больные с узелковой формой поражения проксимальных и дистальных суставов кистей рук, как правило, входили в группу больных генерализованным ОА, энзимный профиль их сыворотки крови перед началом терапии был аналогичен профилю данной группы.
У больных с безузелковой формой ОА, по сравнению со здоровыми лицами, выше активность КО (р<0.05), КДГ (р<0.01), 5¢-НТ (р<0.05), суммарная активность КО и КДГ (р<0.01), больше изоферменты АДА-2 (р<0.001), КДГ-2 (р<0.05).
При сравнении энзимных показателей больных в зависимости от наличия у них узелковых изменений суставов выявили, что при узелковой форме выше активность КО (р<0.01), больше коэффициент КО/КДГ (р<0.001), но ниже активность АМФДА (р<0.05), АМФДА-АТФ (р<0.05), АД (р<0.001), КДГ (р<0.01), больше изоэнзимы АДА-2 (р<0.01).
В отличие от здоровых, у больных ОА с I стадией поражения суставов выше активность КДГ (р<0.05), 5¢-НТ (р<0.01), суммарная активность КО и КДГ (р<0.05), больше изоферменты АДА-2 (р<0.01), содержание МК (р<0.05); у больных со II стадией выше активность АДА (р<0.01), ГДА (р<0.05), КО (р<0.001), суммарная активность КО и КДГ (р<0.001), больше коэффициент КО/КДГ (р<0.01), ниже активность АМФДА (р<0.001), АМФДА-АТФ (р<0.001), АД (р<0.05), больше изоферменты АДА-2 (р<0.001), КДГ-2 (р<0.01), и содержание МК (р<0.05); у больных с III стадией - больше суммарная активность КО и КДГ (р<0.05), изоферменты АДА-2 (р<0.001).
Достоверные различия энзимных показателей при различных стадиях ОА получены только для включенных в исследование ферментов обмена адениловых нуклеотидов: между I и II стадиями - АДА, АМФДА, АМФДА-АТФ (р<0.001), АД (р<0.001), АДА-2 (р<0.01) и между I и III стадиями - АДА (р<0.05), АМФДА-АТФ (р<0.05), АД (р<0.001), АДА-1 (р<0.05), содержание МК (р<0.01).
Степень нарушения двигательной активности пациента, обусловленная поражением суставов, находит отражение в таком показателе, как «функциональный класс». При ОА в формирование ФК наряду с анатомо-морфологическими изменениями большой вклад вносит вторичный синовит, чем объясняется сходство энзимных профилей сыворотки крови групп больных ОА с наличием синовита и ФК III.
Согласно полученным нами данным, у больных с ФК II, по сравнению со здоровыми лицами, выше активность КО (р<0.05), КДГ (р<0.05), суммарная активность КО и КДГ (р<0.05), активность 5¢-НТ (р<0.05), ниже активность АМФДА (р<0.05), АМФДА-АТФ (р<0.001), больше изоферменты АДА-2 (р<0.001), КДГ-2 (р<0.05); у больных с ФК III ниже активность АМФДА (р<0.001), АМФДА-АТФ (р<0.001), АД (р<0.05), выше активность АДА (р<0.001), ГДА (р<0.001), 5¢-НТ (р<0.01), КО (р<0.01), суммарная активность КО и КДГ (р<0.01), больше коэффициент КО/КДГ (р<0.01), изоферменты АДА-2 (р<0.001), КДГ-2 (р<0.001), содержание МК (р<0.05). Проведенный анализ энзимных показателей показал, что у больных с ФК II, по сравнению с ФК III, меньше изоферменты АДА-2 (р<0.001), КДГ-2 (р<0.001), ниже активность АДА (р<0.001), ГДА (р<0.01), КО (р<0.001), суммарная активность КО и КДГ (р<0.05), меньше коэффициент КО/КДГ (р<0.001), выше активность АМФДА (р<0.05), АМФДА-АТФ (р<0.01), АД (р<0.001), КДГ (р<0.01), ниже содержание МК (р<0.01).
При анализе связи между длительностью заболевания и активностью энзимов выявили, что активность КО, КДГ и 5'-НТ у больных с длительностью заболевания свыше 15 лет ниже, чем при стаже болезни менее 5 лет (р<0.01), что, вероятно, объясняется истощением адаптационных ресурсов, белково-синтетических возможностей организма на фоне длительного заболевания.
Заключение. Таким образом, проведенные исследования подтверждают вовлечение в патогенез первичного ОА энзимных систем ПМ: адениловой и гуаниловой ветви, ферментов, катализирующих его заключительные этапы. Обнаружены различия энзимных показателей, зависящие от клинических форм и давности заболевания.
Анализируя имеющиеся гипотезы об участии КО в поражении суставов и собственные данные, механизм поддержания хронического воспаления с участием системы «гипоксантин-КО-ксантин» можно представить следующим образом. При движениях в воспаленном суставе создается классическая модель ишемии-реперфузии ткани, что приводит к повышению активности КО, генерации ею супероксидных радикалов (РС), усилению процессов перекисного окисления липидов и повреждению клеток синовии. Повышенная проницаемость мембран способствует выходу из клеток протеолитических ферментов, которые активируют КО и увеличивают продукцию СР. Образующиеся пероксиды липидов стимулируют синтез простагландинов, медиаторов воспаления, активируют калликреиновую систему, происходит высвобождение гистамина из тучных клеток, что поддерживает воспаление. Кроме того, в период ишемии ткани значительно снижается окислительное фосфорилирование, уменьшаются синтез АТФ, соотношение НАДН/НАД, что дополнительно блокирует окислительные процессы, снижается внутриклеточный уровень АТФ и АМФ за счет их деградации. Это ведет к повышению активности 5'-НТ, увеличению содержания аденозина и его метаболитов – гипоксантина и ксантина, являющихся субстратами для КО. В результате создаются все условия для активации КО и усиленной генерации кислородных радикалов.
