Введение. Ревматоидный артрит (РА) хроническое системное заболевание соединительной ткани с поражением суставов по типу симметричного эрозивно-деструктивного полиартрита и многочисленными внесуставными проявлениями. Распространенность РА составляет около 0,7%. Ежегодная заболеваемость - приблизительно 0,02% населения. По данным разных авторов поражение почек при РА встречается с разной частотой от 35 до 73 % [1,2].
Формирование нефропатий носит многофакторный характер, и предполагают развитие поражение почек различного генеза, таких как АА-амилоидоз, гломерулонефрит, лекарственная нефропатия [3]. Лекарственные поражение почек в настоящее время широко распространены и их вклад в структуру ревматоидной нефропатии неоднозначен т.к. лекарственная терапия РА со временем меняется. Например, ранее применяемые пенициламин и соли золота, которые часто осложнялись мембранозным гломерулонефритом, сейчас практически не применяются. Безусловно, наибольший интерес в развитии лекарственной нефропатии представляют нестероидные противовоспалительные препараты (НПВП), от применения которых вряд ли удастся отказаться в ближайшее время. Как показали недавние исследования даже применение селективных ингибиторов циклооксигеназы 2 типа (ЦОГ2) не решает проблемы - последний фермент постоянно синтезируется в различных отделах нефрона, а его метаболиты играют существенную роль в функционировании как клубочка так и канальцевого аппарата [4,5].
Течение ревматоидной нефропатии носит прогрессирующий характер с развитием нефросклероза и уменьшением количества функционирующих нефронов. Развитие множественных системных проявлений предопределяет тяжесть и неблагоприятный прогноз заболевания.
Наличие любой стадии хронической болезни почек (ХБП) является независимым фактором риска кардиоваскулярных осложнений, которые являются основной причиной преждевременной летальности при РА [6, 7]. Таким образом, выявление поражения почек на ранних этапах позволило бы своевременно проводить коррекцию терапии, тем самым влиять на прогноз. Одним из способов ранней диагностики почечной дисфункции при РА является оценка состояния тубулоинтерстиция.
Для диагностики поражения канальцевого аппарата почки используется такой метод как определение ферментурии. Изучение активности ферментов в моче, имеющих различную локализацию в нефроцитах, позволяет определить не только наличие, но и степень поражения канальцевого эпителия. Начальные поражения почечной ткани сопровождаются повышением в моче активности ферментов щеточной каемки (щелочная фосфатаза, гамма-глутамилтранспептидаза и т.д.) при прогрессировании повреждения повышается активность цитозольных ферментов (лактатдегидрогеназа, аминотрансферазы). Данные ферменты не фильтрируются клубочками, поэтому повышение их уровня носит исключительно почечную природу. Основные трудности при определении активности ферментов мочи связаны с тем, что в ней присутствуют разные ингибиторы ферментов, затрудняющие непосредственное определение их активности. В связи с этим необходимо использовать предварительную очистку мочи [8, 9].
В имеющейся литературе исследования, касающиеся данной проблемы, немногочисленны и их данные порой противоречивы, что позволяет говорить об актуальности исследования.
Целью настоящего исследования была оценка наличия и выраженности канальцевого поражения у больных РА, а так же определение возможности использования этих маркеров в качестве ранних признаков повреждения почек.
Материалы и методы. В исследование были включены 60 пациентов с верифицированным диагнозом РА, согластно критериям американской ревматологической ассоциации (АРА, 1987) [10], проходившие лечение в ревматологическом отделении ГБУЗ Ярославской области «Областная клиническая больница». Критериями исключения были сопутствующие заболевания почек, артериальная гипертензия II-III степени, сахарный диабет (СД), а также другие состояния, сопровождающиеся развитием вторичных нефропатий.
Проводилось стандартное общеклиническое обследование, принятое в нефрологической практике, включавшее сбор анамнеза, физикальное обследование, клинический анализ крови, мочи, определялась суточная протеинурия (ПУ). По показаниям были проведены ультразвуковое исследование почек, дуплексное исследование почечных сосудов. Функция почек оценивалась по показателям удельного веса (УВ) мочи по пробе Зимницкого (конценрационная функция признавалось сохранной при достижении показателя относительной плотности мочи свыше 1018), скорости клубочковой фильтрации (формула MDRD), уровню мочевины и креатинина крови. Иммунологическое исследование включало определение С-реактивного белка (СРБ), ревматоидного фактора (РФ), циркулирующих иммунных комплексов (ЦИК).
Стадия заболевания определялась по Steinbrocker. Для определения активности использовался индекс DAS 28. Оценивались течение основного заболевания и сопутствующая патология. Пациенты заполняли специально разработанную анкету, содержащую вопросы которые позволили получить подробную информацию о лекарственной терапии за последний месяц лечения и на момент госпитализации.
Для выявления состояния тубулоинтерстициальной ткани проводилось исследование ферментурии. Определялась активность цитоплазматического фермента аланинаминотрансферазаы (АЛТ) и фермента щеточной каемки тубулоэпителия - щелочной фосфотазы (ЩФ) в утренней порции мочи, собранной с 6 до 9 часов, кинетическим методом. Для удаления низкомолекулярных ингибиторов исследуемых ферментов из мочи, образцы подвергались активному диализу с помощью магнитной мешалки против 0,9 % NaCl из расчета 1 мл мочи на 200 мл физиологического раствора. Для диализа использовались диализные мешки (Cellu Sep H1, USA) с диаметром пор 50 кДа. Длительность диализа составляла не менее 2 часов. Активность ферментов выражали в нмоль/с.л. которая была отнесена к 1 ммоль креатинина мочи (мМ.кр). Оценка мочевой экскреции альбумина определялась полуколичественным способом с помощью диагностических полосок Micral Test фирмы Roche.
Контрольную группу составили 15 практически здоровых людей, репрезентативных по возрасту.
Статистический анализ полученных данных проводился с помощью программы STATISTICA версия 6.0. Анализ соответствия вида распределения признака закону нормального распределения проводился с использованием критериев Колмогорова-Смирнова и Шапиро-Уилка. Для описания нормально распределенных количественных признаков было использовано среднее значение признака и среднеквадратичное отклонение. Для описания признаков, распределение которых отличалось от нормального указаны медиана, нижний и верхний квартили. Сравнение нескольких независимых групп по количественному признаку отличному от нормального распределения проводилось непараметрическим методом Краскела-Уоллиса, а при установлении различий между группами - дальнейшее попарное сравнение с использованием теста Манна-Уитни.
Корреляционный анализ проводился с помощью метода Спирмена. Сравнения относительных частот в двух группах проведено при анализе различий между двумя пропорциями. Различия и взаимосвязи между признаками считали достоверными при p < 0,05.
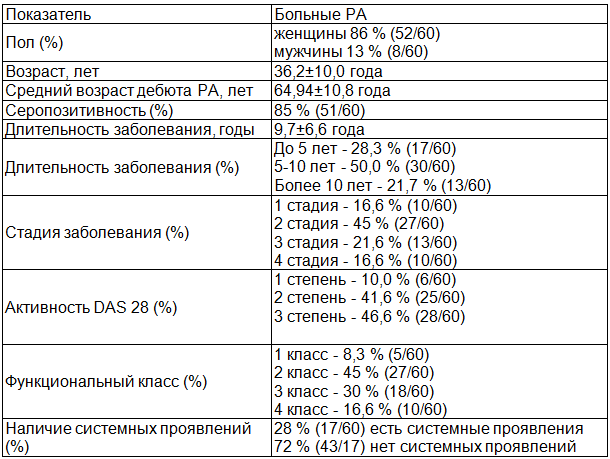
Результаты. Характеристика пациентов основной группы представлена в табл. 1.
Средний возраст пациентов 49,4±10,8 года. Подавляющее большинство составили женщины 86 % (52/60). Большинство пациентов получали терапию метотрексатом (МТ): 93 % (56/60) человек. Остальные 6,6 % (4/60) человека на момент госпитализации не получали базисную терапию. Глюкокортикостероиды (ГКС) принимали 40 % (24/60) человека. В постоянном приеме нестероидных противовоспалительных препаратах (НПВП) нуждались 86 % (52/60) пациента. Из них неселективные НПВП принимали 68 % (41/60) человек, селективные - 18,3 % (11/60) человек. Не получали НПВП - 13,3 % (8/60) человек.
В качестве системных проявлений были зарегистрированы: ревматоидные узелки, сетчатое леведо, сенсомоторная полинейропатия, анемия, генерализованная амиотрофия.
Таблица 1. Характеристика больных ревматоидным артритом
При сравнении содержания ферментов мочи у пациентов РА было выявлено, что ЩФ/Кр, АЛТ/Кр статистически значимо отличаются от их уровней у лиц контрольной группы, репрезентативных по полу и возрасту (табл. 2).
При исследовании микроальбуминурии (МАУ) последняя была выявлена у 61,5 % (37/60) пациентов в группе РА против 6,6 % (1/15) в контрольной группе (р=0,001). Структура МАУ имела следующий вид: 100 мг/л - 16,6 % (10/60), 50 мг/л - 33,3 % (20/60), 20 мг/л - 11,6 % (7/60). Что может свидетельствовать о наличии клубочкового и канальцевого повреждения.
Таблица 2. Альбуминурия и ферментурия у пациентов с РА и лиц контрольной группы

При анализе выраженности повреждения почек в зависимости от длительности основного заболевания (табл. 3) выявлено что, у пациентов страдающий РА менее 5 лет имеется повышение АЛТ/Кр и ЩФ/Кр по сравнению контрольной группой (р < 0,05). В дальнейшем при увеличении длительности основного заболевания отмечается тенденция к увеличению экскреции маркеров канальцевого поражения. Необходимо отметить, что наибольшая степень выраженности ферментурии выявлена при длительности РА более 15 лет.
При изучении уровня микроальбуминурии в зависимости от длительности РА наблюдается вышеописанная тенденция. Частота выявления МАУ была наибольшей в группе больных с длительностью более 15 лет.
Таблица 3. Показатели ферментурии в зависимости от длительности РА
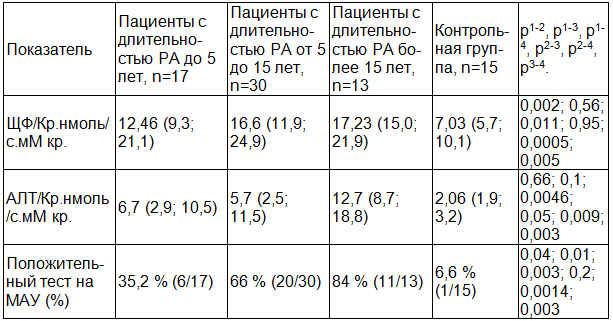
Примечание: здесь и далее р1-2 - при сравнении показателя 1-й и 2-й групп, р1-3 1-й и 3-й групп, р1-4 1-й и 4-й групп, р2-3 2-й и 3-й групп, р2-4 2-й и 4-й групп, р3-4 3-й и 4-й групп.
При изучении традиционного маркера канальцевой дисфункции - удельного веса мочи было выявлено что, количество пациентов, у которых максимальный удельный вес по пробе Зимницкого не достигал 1018, составило 30 % (18/60), а уровень показателей ЩФ/Кр и АЛТ/Кр был статистически выше в этой группе пациентов (табл. 4).
Таблица 4. Показатели ферментурии в зависимости от относительной плотности мочи по пробе Зимницкого

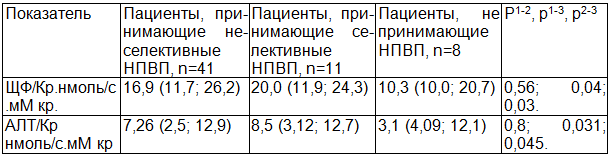
В работе было оценено влияние селективного ЦОГ 2 и неселектиных НПВС на уровень маркеров канальцевого поражения. При изучении влияния лекарственной терапии на функцию почек было показано, что уровень ферментурии у пациентов, принимающих неселективные НПВП, статистически не отличался от такового у пациентов, принимающих селективные ингибиторы ЦОГ 2 (р для АЛТ/Кр 0,56, р для ЩФ/Кр 0,8), (см табл. 5). Необходимо отметить, что показатели ЩФ/Кр и АЛТ/Кр были наименьшими в группе пациентов, не принимавших НПВП за последний месяц и на момент госпитализации. Они статистически отличались от пациентов, принимавших как селективные, так и неселективные ингибиторы циклооксигеназы (табл. 5).
Не было выявлено влияния базисной терапии (прием метотрексата) на уровень ферментурии (АЛТ/Кр принимавших МТ - 3,8 (2,0; 9,3) и не принимавших МТ 4,7 (2,7; 9,0), р=0,4; ЩФ/Кр принимавших МТ 10,7 (6,7; 19,0) и не принимавших МТ 12,9 (5,8; 20,9), р=0,8). Прием глюкокортикостероидов так же не влиял на уровень маркеров канальцевого повреждения (АЛТ/Кр принимавших ГКС 3,0 (1,9; 11,8) и не принимавших ГКС 2,7 (1,6; 8,0), р=0,58; ЩФ/Кр принимавших ГКС 16,2 (5,0; 26,9) и не принимавших ГКС 13,6 (9,0; 27,2), р=0,1) на уровень ферментурии. Таким образом, можно предполагать весомый вклад приема именно нестероидных противовоспалительных препаратов в развитии канальцевой дисфункции.
Таблица 5. Показатели ферментурии в зависимости от приема и селективности НПВП
При проведении анализа взаимосвязи канальцевой дисфункции от наличия системных проявлений была выявлена взаимосвязь соотношения АЛТ/Кр с наличием системных проявлений. Показатель АЛТ/Кр у пациентов с системными проявлениями составил 4,58 (1,98; 7,26), для пациентов без системных проявлений 10,45 (5,9; 9,4), р=0,0045. Для показателя ЩФ/кр такой взаимосвязи выявлено не было.
При изучении особенностей почечного повреждения при РА с разными степенями активности основного заболевания не выявлено значимых различий, не отмечено существенных взаимосвязей между уровнем СРБ, ЦИК, РФ и маркерами почечного повреждения.
Было выявлено влияние степени активности заболевания на микроальбуминурией. МАУ выявлена у 16 % (1/6) пациентов с первой степенью, 68 % (17/25) со второй и 67 % (19/28) с третьей степенями активности (р1-2=0,027, р1-3=0,28, р2-3=0,9).
При проведении корреляционного анализа было выявлено наличие взаимосвязи маркера клубочкового повреждения с активностью заболевания (МАУ и DAS 28 rs=0,4, р=0,02). Показатели ферментурии коррелировали с относительной плотностью мочи (ЩФ/кр и УВ rs=-0,3, р=0,02; АЛТ/Кр и УВ rs=0,33, р=0,01), длительностью заболевания (ЩФ/кр и длительность РА rs=0,25, р=0,01; АЛТ/Кр и длительность РА rs=0,22, р=0,05).
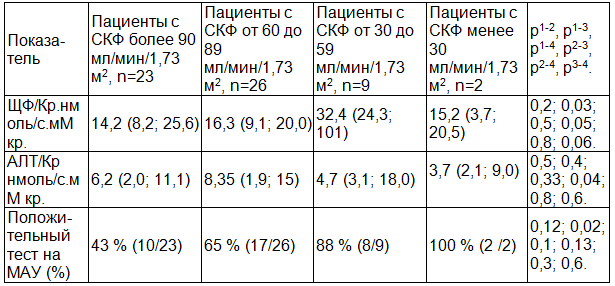
Скорость клубочковой фильтрации (СКФ) у обследованных пациентов составила 89,6 (83,7; 98,5) мл/мин/1,73 м2 (по формуле MDRD). СКФ более 90 мл/мин/1,73 м2 выявлена у 38 % (23/60) пациентов, в диапазоне от 60 до 89 мл/мин/1,73 м2 - у 43 % (26/60) пациентов, в диапазоне 30 до 59 мл/мин/1,73 м2 - у 16 % (9/60) пациентов, менее 30 мл/мин/1,73 м2 – 3 % (2/60) пациентов. При анализе табл. 6 видна тенденция к нарастанию экскреции ЩФ/Кр при уменьшении фильтрационной функции. Аналогично ведут себя показатели МАУ. Для АЛТ/Кр такой взаимосвязи проследить не удалось.
Таблица 6. Показатели ферментурии в зависимости от скорости клубочковой фильтрации (по формуле MDRD)
Обсуждение. При анализе полученных данных было выявлено, что у пациентов с РА имеется повышение маркеров тубулоинтерстициального повреждения по сравнению с группой контроля. Было выявлено, что наряду с нарастанием клубочковым поражением в зависимости от длительности течения РА имеет место нарастание маркеров интерстициальной дисфункции. Была выявлена взаимосвязь тубулоинтерстициального поражения и длительности основного заболевания, относительной плотностью мочи, наличием системных проявлений, а также приемом НПВП. Хочется отметить тот факт, что влияние селективности принимаемого НПВП не вносило решающего вклада в канальцевую дисфункцию, тогда как факт приема НПВП влиял на уровень ферментурии. В отличие от микроальбуминурии, которая отчетливо зависела от показателей активности РА, для маркеров интерстициального повреждения такой закономерности выявлено не было. Было показано, что при уменьшении почечной функции параллельно шло увеличение маркеров, как клубочкового, так и канальцевого повреждения.
Таким образом, у больных РА имеет место тубулоинтерстициальная дисфункция, реализующаяся уже на ранних стадиях заболевания и прогрессирующая с течением времени. Учитывая это, определение ферментурии может быть использовано в качестве раннего маркера повреждения почек при РА.
