Введение. Ревматоидный артрит (РА) хроническое системное заболевание соединительной ткани с поражением суставов по типу симметричного эрозивно-деструктивного полиартрита и многочисленными внесуставными проявлениями. Распространенность РА составляет около 0,7%. Ежегодная заболеваемость - приблизительно 0,02% населения. По данным разных авторов поражение почек при РА встречается с различной частотой от 35 до 73% [1,2]. Течение ревматоидной нефропатии носит прогрессирующий характер с развитием нефросклероза и снижением количества функционирующих нефронов, формированием хронической почечной недостаточности.
Развитие системных проявлений предопределяет тяжесть и неблагоприятный прогноз заболевания. Наличие любой стадии хронической болезни почек (ХБП) является независимым фактором риска кардиоваскулярных осложнений [3,4], предопределяющие преждевременную летальность при РА [5,6].
Развитие нефропатий при РА имеет многофакторный характер, что рождает многообразие их клинических и морфологических вариантов при незначительных и неспецифических изменениях в анализах мочи. РА предполагает развитие лекарственной нефропатии, АА-амилоидоза, гломерулонефрита [7].
Последние, как правило, имеют длительное малосимптомное течение, и проявляются в виде незначительных и неспецифических изменений в анализах мочи и зачастую не имеют должной и своевременной интерпретации. Мочевой синдром это клинико-лабораторное понятие, которое включает в себя протеинурию, гематурию (эритроцитурию), лейкоцитурию. Он является важнейшим и наиболее постоянным признаком поражений почек. Наличие мочевого синдрома в рамках современного представления о ХБП служит маркером почечного повреждения и одним из ее критериев. Таким образом, выявление повреждения почек на ранних этапах позволило бы своевременно проводить коррекцию терапии, тем самым влиять на прогноз.
В имеющейся литературе, исследования, касающиеся данной проблемы, немногочисленны и их данные часто противоречивы, что позволяет говорить об актуальности исследования.
Цель исследования - изучить распространенность мочевого синдрома (МС) и его структуру в когорте пациентов с ревматоидным артритом.
Материалы и методы. Проведен анализ встречаемости мочевого синдрома 248 больных РА, проходивших лечение в ревматологическом отделении ГБУЗ Ярославской области «Областная клиническая больница» в 2010 году. В исследование были включены все потупившие больные РА. Оценивались течение основного заболевания и сопутствующая патология. Диагноз достоверного РА ставили на основании критериев американской ревматологической ассоциации (АРА) [8]. Исследовали клинический анализ крови, мочи (по показаниям проводилась проба мочи по Нечипоренко, суточная протеинурия), ультразвуковое исследование почек. Функция почек оценивалась по показателям скорости клубочковой фильтрации (СКФ), которые рассчитывали по формуле MDRD, уровню мочевины и креатинина крови. Иммунологическое исследование включало определение С-реактивного белка (СРБ), ревматоидного фактора (РФ), циркулирующих иммунных комплексов (ЦИК). Стадия заболевания определялась по Steinbrocker. Для оценки активности использовался индекс DAS 28: 0 (ремиссия) - DAS 28 меньше 2,6; 1 (низкая) - DAS 28 от 2,6 до 3,2; 2 (средняя) - DAS 28 от 3,2 до 5,1; 3 (высокая) - DAS 28 больше 5,1.
Анализировали течение основного заболевания и сопутствующую патологию. Больные РА были разделены на две группы. Первую составили больные РА без клинически значимой сопутствующей патологии (n=124). Вторую - пациенты с РА имевшие: сердечно-сосудистые заболевания (артериальная гипертензия, ишемическая болезнь сердца, атеросклероз периферических сосудов), n=106, различные заболевания почек (хронический пиелонефрит, мочекаменная болезнь, аномалии развития почек), n=12, и сахарный диабет, n=6. Всего 124 пациента. Группу контроля составили 102 человека репрезентативных по возрасту и не имеющих заболеваний, потенциально влияющих на функциональное состояние почек. Критерием диагностики МС были: протеинурия более 0,3 г/л, эритроцитурия ≥2-х эритроцитов в поле зрения, лейкоцитурия ≥2 в поле зрения у мужчин, и ≥5 в поле зрения у женщин.
Статистический анализ полученных данных проводился с помощью программы STATISTICA версия 6.0. Анализ соответствия вида распределения признака закону нормального распределения проводился с использованием критериев Колмогорова-Смирнова и Шапиро-Уилка. Для описания нормально распределенных количественных признаков было использовано среднее значение признака и среднее квадратичное отклонение. Для описания признаков, распределение которых отличалось от нормального указаны медиана, нижний и верхний квартили. Для сравнения 2-х групп использовался непараметрический метод Манна-Уитни.
Сравнение 2-х групп по качественному признаку проводилось с использованием критерия Χ2 по методу Пирсона с поправкой Йетса, точного критерия Фишера. Ассоциации качественных признаков проверялись с помощью метода Χ2 по методу Пирсона. Различия и взаимосвязи между признаками считали достоверными при p<0,05.
Результаты. Характеристика пациентов основной группы представлена в табл. 1. Средний возраст пациентов 39,2±10,8 года. Подавляющее большинство составили женщины 85% (210/248).
Большинство пациентов получали терапию метотрексатом (МТ): 91% (225/248) человек. Остальные 9% (23/248) человека на момент госпитализации не получали базисную терапию. Глюкокортикостероиды (ГКС) принимали 38% (94/248) человека. В постоянном приеме нестероидных противовоспалительных препаратах (НПВП) нуждались 90% (223/248) пациента. Из них неселективные НПВП принимали 66% (147/223) человек, селективные - 34% (76/223) человек. Не получали НПВП - 10% (25/248) человек.
В качестве системных проявлений были зарегистрированы: ревматоидные узелки, сетчатое леведо, сенсомоторная полинейропатия, анемия, генерализованная амиотрофия.
Таблица 1. Характеристика больных ревматоидным артритом
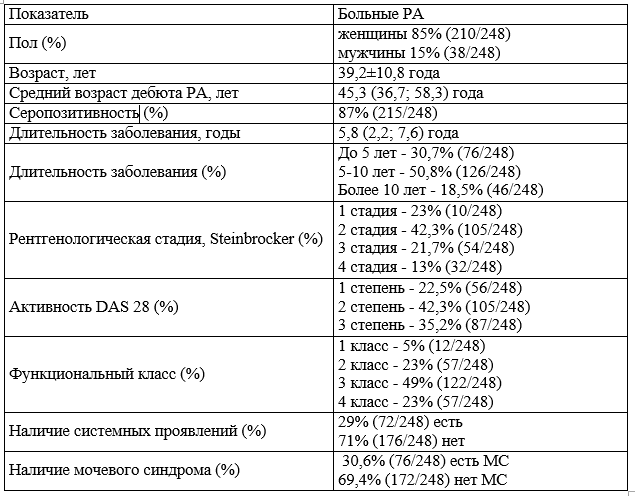
Структура МС в первой группе больных РА имела следующий вид: протеинурия (П) - 0,8% (1/124), эритроцитурия (Э) - 16% (20/124), лейкоцитурия (Л) - 2,1% (3/124), одновременное появление протеинурии и эритроцитурии (П+Э) - 0,8% (1/124), протениурии и лейкоцитурии (П+Л) - 0% (0/124), лейкоцитурии и эритроцитурии (Л+Э) - 9% (11/124), протеинурии, эритроцитурии и лейкоцитурии (П+Э+Л) - 0,8% (1/124) (рис. 1).
МС во второй группе был представлен следующим образом: П - 2,5% (3/124), Э - 20% (25/124), Л - 3,3% (4/124), П+Э - 0% (0/124), П+Л - 1,6% (2/124), Л+Э - 2,5% (3/124), П+Э+Л - 1,6% (2/124) (рис. 2).
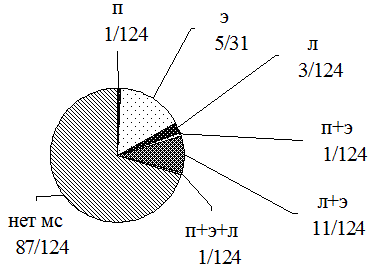
Рис. 1. Структура мочевого синдрома в 1-й группе
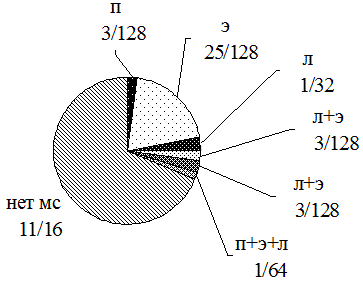
Рис. 2. Структура мочевого синдрома во 2-й группе
Патология общего анализа мочи в группе контроля была представлена П - 0% (0/106), Э - 2,8% (3/106), Л - 1,9% (2/106), П+Э - 0% (0/106) П+Л - 0% (0/106), Л+Э - 0,9% (1/106), П+Э+Л - 0% (0/106) (рис. 3).
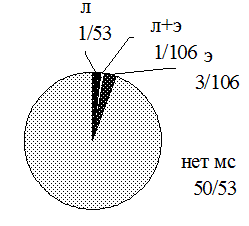
Рис. 3. Структура мочевого синдрома в группе контроля
Таким образом, мочевой сидром в группе больных с ревматоидным артритом без сопутствующей патологии был определен у 29,8% (37/124), в группе ревматоидного артрита с сопутствующей патологией у 31,4% (39/124) и группе контроля у 5,6% (6/106).
При сравнении полученных относительных частот было показано, что встречаемость мочевого синдрома не имела статистического различия в первой и во второй группах больных РА, (р=0,6), но достоверно отличалась в сравнении с группой контроля (р=0,001).
При сравнении критерием Χ2 по методу Пирсона достоверного различия в структуре первой и второй групп выявлено не было р=0,5.
Таким образом, можно предполагать, что именно наличие РА является фактором, провоцирующим появление мочевого синдрома. Влияния сопутствующей патологии на частоту встречаемости и структуру мочевого синдрома у больных с РА выявлено не было.
Хочется отметить, что в структуре мочевого синдрома превалировала эритроцитурия, как самостоятельно, так и в сочетании с другими показателями.
Для выявления факторов ассоциированных с МС был проведен анализ группы больных с РА без сопутствующей патологии.
При сравнении групп пациентов имеющих МС и без МС было отмечено, что группы достоверно отличались по основным иммунологическим показателям (уровням РФ, ЦИК, СРБ) (табл. 2).
Таблица 2. Иммунологические показатели у больных РА в группе больных без сопутствующей патологии

При изучении встречаемости повышения иммунологических показателей выявлено, что превышение верхней границы референсных значений для ЦИК в группе больных с МС статистически выше, чем в группе без МС 72% (26/36) и 43% (38/88) соответственно, р=0,003. Повышение уровня РФ в группе с МС было достоверно выше, чем в группе без него 95,8% (34/36) и 63% (55/88), р=0,0003. Повышение уровня СРБ в группе с МС составило 90% (32/36) против 64% (56/88) в группе без него, р=0,005. Таким образом, видна отчетливая связь между наличием мочевого синдрома и иммунологическими показателями, отражающими активность основного заболевания.
При изучении влияния активности заболевания на мочевой синдром показано, что встречаемость третьей степени активности в группе больных с МС была достоверно выше, чем в группе без МС (табл. 3).
Таблица 3. Активность РА у больных в группе больных без сопутствующей патологии

При изучении частоты развития системных проявлений сравниваемых групп отмечено, что в группе больных РА имеющих МС системные проявления регистрировались в 42% (15/36) против 23% (20/88) в группе без МС, р=0,03. Не отмечено статистического различия между средними величинами таких показателей как возраст больных 48,8±14, 47,0±11 соответственно, (р=0,55), длительность болезни 4,5 (2,1; 10,5) и 7,2 (2,3; 15,0) соответственно, р=0,2 и дебютом заболевания 46,1 (31,0; 51,2) и 38,5 (27,7; 48,6) соответственно, р=0,25.
При построении таблиц сопряженности и анализе с помощью критерия Χ2 по методу Пирсона выявлено, что МС не ассоциировался со стадией заболевания (р=0,11), ранним дебютом заболевания (до 35 лет), (р=0,12), приемом метотрексата (р=0,3), нестероидных противовоспалительных средств (НПВС) (р=0,23), глюкокортикоидов (р=0,6), селективностью НПВС (р=0,19).
Анализ функционального состояния почек у больных с РА выявил следующее: СКФ более 90 мл/мин/1,73м2 зарегистрирована у 52% (131/248) пациентов, СКФ в диапазоне от 60 до 89 мл/мин/1,73м2 была у 38,4% (95/248) (что соответствует 2 ст. ХБП), у 8,8% (22/248) - менее 60 мл/мин/1,73м2 (что соответствует 3 ст. ХБП).
При этом частота встречаемости нарушений СКФ была ассоциирована с наличием сопутствующей патологии, влияющей на функциональное состояние почек (p<0,001). В то же время, частота встречаемости различной СКФ существенно не зависела от рентгенологической стадии и функционального класса. При сравнении относительных частот было выявлено, что среди больных с сопутствующей патологией снижение СКФ менее 60 мл/мин/1,73м2 регистрировалось статистически чаще, чем среди пациентов без заболеваний сердечно-сосудистой системы и почек 13% (16/124) и 4,8% (6/124) соответственно, p<0,02.
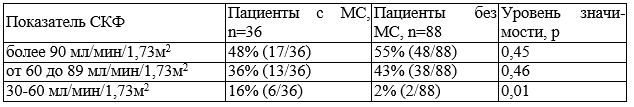
Для выявления взаимосвязи мочевого синдрома и снижения СКФ была проанализирована группа больных РА не имеющих сопутствующих заболеваний (n=124). Показано, что в группе с наличием МС встречаемость СКФ менее 60 мл/мин/1,73м2 статистически превышает такой показатель в группе без МС (табл. 4).
Таблица 4. СКФ у больных РА в зависимости от наличия мочевого синдрома
Обсуждение. При анализе полученных данных было показано, что распространенность мочевого синдрома среди больных РА достаточно велика и составляет около трети всех пациентов (30,6%). При этом наличие сопутствующей патологии достоверно не влияла на частоту его встречаемости, что вероятно, позволяет говорить о РА, как о причине появления МС. Увеличение частоты встречаемости МС почти в два раза при наличии системных проявлений РА, свидетельствует в пользу данного утверждения. Таким образом, наличие МС при РА может служить ранним маркером повреждения почек и служить "отправной точкой" для дальнейшего обследования.
