Остеоартроз (ОА) – это гетерогенная группа заболеваний различной этиологии, которые имеют сходные биологические, морфологические и клинические аспекты. Причины остеоартроза многообразны, при этом выделяют различные факторы, имеющие значение в патогенезе и прогрессировании заболевания [2,3,5,11]. В настоящее время некоторые исследователи рассматривают ОА, как системную метаболическую болезнь, являющуюся частью метаболического синдрома [4,8]. Метаболический синдром представляет собой комплекс многих сцепленных на биохимическом и физиологическом уровне факторов, которые обуславливают суммарный риск многих заболеваний, прежде всего таких, как сахарный диабет 2 типа, ишемическая болезнь сердца (ИБС), атеросклероз, ОА [1].
Чрезвычайно трудно найти единственную первопричину в патогенезе метаболического синдрома, поскольку все его причины тесно взаимосвязаны и взаимообусловлены. Одну из ключевых ролей в прогрессировании метаболического синдрома и развитии клинических его проявлений играют окисленные липопротеины низкой плотности (оЛПНП).
Перекисная модификация липопротеинов низкой плотности сопровождается существенным повышением их иммуногенности, в результате чего начинают образоваться антитела к окисленным липопротеинам низкой плотности (анти-оЛПНП).
Образовавшиеся антитела являются дополнительным фактором повреждения в патогенезе многих заболеваний. Есть данные, что анти-оЛПНП могут использоваться в качестве теста, отражающего окислительные процессы, происходящие in vivo. В последние годы появились работы о влиянии оЛПНП на патогенез атеросклероза, ишемической болезни сердца, системной красной волчанки [1,3,8].
Показано, что оЛПНП могут активировать Т-клетки, что приводит к выработке цитокинов. Последние могут контролировать активность макрофагов, секрецию металлопротеиназ, модулировать пролиферацию гладкомышечных клеток, образование окиси азота, апоптоз и индуцируют активацию эндотелия. Высокие концентрации уровня оЛПНП и анти-оЛПНП были выявлены и при ОА. Эксперименты на культуре суставных хондроцитов крыс [10] показали, что оЛПНП вовлекаются в патогенез ОА и вызывают гибель хондроцитов. Также имеются данные о том, что оЛПНП могут откладываться в синовиальном выпоте и в cиновиальной оболочке и губительно действовать на метаболизм хондроцитов [2, 6, 9].
Цель исследования: изучить клинико-патогенетическое значение уровня окисленных липопротеинов низкой плотности сыворотки крови и антител к ним у больных с остеоартрозом.
Материалы и методы. Под нашим наблюдением находились 175 человек, из которых 130 больных ОА и 45 практически здоровых лиц, составивших группу сравнения. Больные ОА были в возрасте от 34 до 77 лет, из которых 78 женщина (60%) и 52 мужчин (40%). Средний возраст женщин с ОА составил 49,26±3,89 лет, мужчин - 51,31±4,03 лет и был сопоставим с группой здоровых лиц (t=0,54, p>0,05; t=0,29, p>0,05 соответственно). Контрольная группа состояла из 25 женщин и 20 мужчин в возрасте от 26 до 58 лет, не имеющих жалоб на боли в суставах в течение всей жизни, и без клинических проявлений ОА.
Окисленные липопротеины низкой плотности и антитела к окисленным липопротеинам низкой плотности определялись иммуноферментным методом (Biomedica Gruppe, Oxidised LDL, cat № 20042 и Biomedica Gruppe, OLAB-IgG, cat № 20032 соответственно) до и после лечения.
Результаты исследования и обсуждение: Средний уровень оЛПНП в сыворотке крови здоровых людей составил 114,3±4,2 нг/мл, анти-оЛПНП - 324±14 мЕд/мл везде (M±m). Уровень нормальных показателей оЛПНП и анти-оЛПНП, определяемый как М±2σ, и составил от 60 до 168 нг/мл – для оЛПНП, и от 244 до 404 мЕд/мл – для анти-оЛПНП. Частота выявления оЛПНП в сыворотке крови у здоровых лиц составила 4,4% (2 человека), анти-оЛПНП - 2,2% (1 человек).
Повышенный уровень оЛПНП в сыворотке крови больных ОА был обнаружен у 78 (60%), анти-оЛПНП – у 38 пациентов (29%), что было статистически значимо чаще, чем у здоровых лиц (р<0,001). Средний уровень оЛПНП у больных ОА составил 252,2±3,4, анти-оЛПНП - 484,5±12,5 мЕд/мл, что статистически значимо превышало показатели здоровых лиц (р=0,0014 и р<0,001 соответственно).
Были изучены исходные уровни оЛПНП и анти-оЛПНП в сыворотке крови у больных ОА в зависимости от возраста и пола. Было обнаружено повышение уровня оЛПНП и анти-оЛПНП в сыворотке крови у больных ОА старше 50 лет, эти различия были статистически значимы (р<0,01).
Средний уровень оЛПНП в сыворотке крови у мужчин составил 257,6±3,7 нг/мл, у женщин - 251,6±3,8 нг/мл. Средний уровень анти-оЛПНП в сыворотке крови у мужчин составил 472,8±13,7 мЕд/мл, у женщин - 489,8±13,8 мЕд/мл (t=0,83, р>0,05). Таким образом, уровень оЛПНП и анти-оЛПНП в сыворотке крови больных ОА не зависит от пола пациентов. Как видно из табл. 1, наиболее высокий исходный уровень оЛПНП и анти-оЛПНП в сыворотке крови обнаружен у больных старших возрастных групп (от 50 до 77 лет).
Вероятнее всего, повышение оЛПНП и анти-оЛПНП в сыворотке крови при ОА происходит за счет усиления окислительных реакций. Согласно свободно-радикальной теории Хармана [6], прогрессирование ОА происходит за счет повреждения свободными радикалами, гидроперекисями и оЛПНП биополимеров, входящих в состав клеточных мембран околосуставных тканей и хряща. С возрастом в организме нарастает интенсивность окислительного повреждения биомолекул и тканей, развивается окислительный стресс. Показателями окислительного стресса считают повышение в крови продуктов перекисного окисления липидов и оЛПНП.
В нашем исследовании повышение уровня оЛПНП и анти-оЛПНП происходило при более длительном течении ОА. Это подтверждает данные о том, что с возрастом ослабевают антиоксидантные системы и увеличивается уровень окислительных реакций.
В популяционных исследованиях было показано [3,8], что увеличение распространенности ОА и его прогрессирование также усиливаются с возрастом. Это можно объяснить разными причинами. Вероятно, хондроциты человека в процессе старения теряют способность к пополнению и восстановлению матрикса суставного хряща. С другой стороны, с возрастом суставной матрикс становится более чувствительным к микротравмам, снижаются его способности к регенерации и восстановлению. В экспериментах на культуре суставных хондроцитов крыс было показано, что оЛПНП и анти-оЛПНП вовлекаются в патогенез ОА и вызывают гибель суставных хондроцитов [7,8,10]. Поэтому, мы изучили уровень оЛПНП и анти-оЛПНП в сыворотке крови у больных ОА в зависимости от клинической картины заболевания. Данные представлены в табл. 2. Из таблицы видно, что уровень оЛПНП у больных ОА был достоверно выше чем у здоровых лиц во всех группах, кроме ОА с рентгенологической стадией I (р>0,05). Был рассчитан уровень нормальных показателей оЛПНП в сыворотке крови, который составил от 60 до 168 нг/мл. Показатели, превышающие указанный уровень, следует считать повышенными. Высокий уровень анти-оЛПНП в сыворотке
Таблица 1. Уровень окисленных липопротеинов низкой плотности и антител к ним в сыворотке крови больных ОА в зависимости от возраста и пола
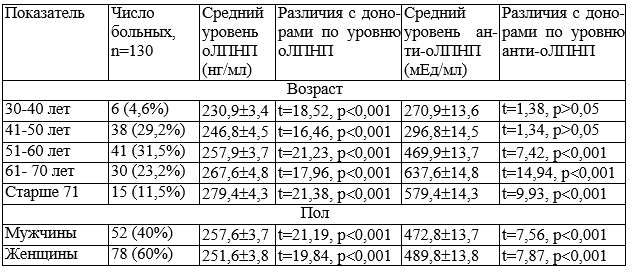
Таблица 2. Зависимость уровня оЛПНП и анти-оЛППН от клинических проявлений ОА
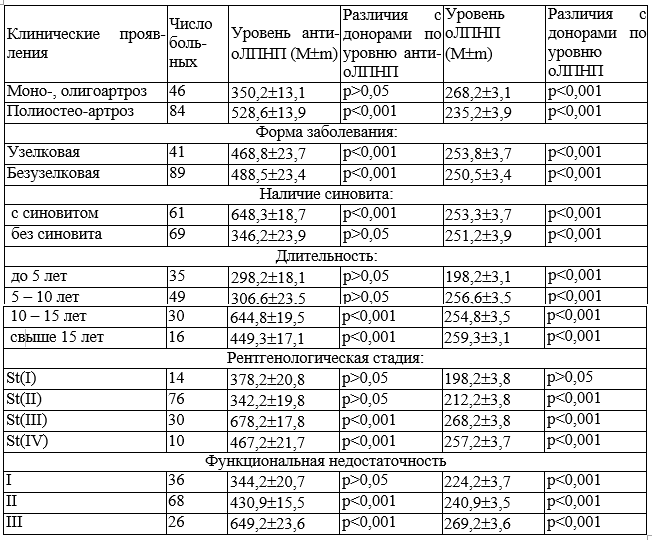
крови статистически значимо чаще ассоциировался с полиостеоартрозом с вторичным синовитом, с продолжительностью заболевания более 10 лет, рентгенологической стадией III и IV, с III классом функциональной недостаточности суставов. Кроме того, в нашем исследовании концентрация оЛПНП положительно коррелировала с уровнем С-реактивного белка, индексом WOMAC, альгофункциональным индексом Лекена для гонартроза и коксартроза.
Выводы. Повышенный уровень оЛПНП был обнаружен у 60%, анти-оЛПНП у 29% больных с ОА. Для больных, имеющих высокий уровень оЛПНП, характерен следующий симптомокомплекс: моно и олигоартроз, с длительностью заболевания более 5 лет, III и IV рентгенологической стадией заболевания, III классом функциональной недостаточности суставов. Для больных, имеющих высокий уровень анти-оЛПНП, характерен полиостеоартроз с быстропрогрессирующим течением, наличием вторичного синовита, большей длительностью заболевания, более 10 лет, III рентгенологической стадией заболевания, II-III классом функциональной недостаточности суставов. Таким образом, можно предположить, что оЛППН и анти-оЛПНП могут играть определенную роль в патогенезе ОА.
