Введение. Понятие артрит объединяет ряд воспалительных, метаболистических и дегенеративных заболеваний, связанных с поражением одного или более суставов. Согласно статистики, каждый шестой гражданин США болен артритом, что составляет 43 млн. человек. По предварительным прогнозам ученных к 2020 году количество больных артритом по всему миру увеличится на 35-40% [8]. К сожалению, при современной антиартритной терапии не всегда возможно полностью устранить симптомы (воспалительние, купировать боль и лихорадку) и замедлить процесс поражение структуры суставов. Основной группой фармакологического выбора при данной патологии являются нестероидные противовоспалительные средства (НПВС). В мире НПВС ежедневно принимают около 30 млн человек, ежегодно — более 300 млн, причем, около 60% пациентов используют безрецептурные лекарственные формы [5]. Однако, применение НПВС имеет свои ограничения связанные с возникновением ряда побочных эффектов: у 25% пациентов при кратковременном приеме препаратов, и у 55% людей пожилого возраста, у которых особенно высок риск побочных эффектов на фоне длительного приема НПВС. В связи с этим в последние годы особое внимание привлечено к проблеме создания и изучения безопасных антиартритных препаратов, в частности на основе природного сырья. Учитывая последнее, созданны 19 комбинированных соединений производных N-фенилантраниловой кислоты (N-ФАК) (мефенамовая кислота с противовоспалительным действием), и солей глюкозамина (ГА), как хондропротектора (входящего в состав суставного хряща), с доказанными свойствами уменьшать побочного действие НПВС [2, 4, 7].
На модели карагенинового воспаления было изучено противовоспалительное действие 19 комбинированных веществ: 1 группа – 6 веществ D-(+)-глюкозиламониевых солей замещенных 5-нитро-N-фенилантраниловых кислот; 2 группа – 7 веществ D-(+)-глюкозиламониевых солей 3-оксамоил замещенных N-фенилантраниловых кислот; 3 группа – 6 веществ D-(+)-глюкозиламиды замещенные N-фенилантраниловых кислот [4, 5]. Установлено, что наибольшей противовоспалительной активностью, на уровне натрия диклофенака, обладает 1 группа (фармакологические препараты под шифром 1-БИСГ, 2-БИСГ и 7-БИСГ). В ходе дальнейших исследований по изучению антиартритной активности был выделен фармакологический лидер под шифром 1-БИСГ, который изучен на модели артрита у крыс [2, 4, 5].
Материалы и методы. На 40 белых крысах обоего пола массой 180-200 г была смоделирован модель коллаген-индуцированного артрита (КИА). Животные были распределены на 4 опытных группы по 10 животных:
I группа - интактный контроль;
II группа - контрольная патология КИА (КП);
III группа, получавшие вещество-лидер под шифром 1-БИСГ в дозе 11 мг/кг (соответствует эквимолекулярной дозе по отношению к натрию диклофенаку 8 мг/кг).
IV группа, получавшие референтный препарат – натрия диклофенак в дозе равной ЕД50 8,0 мг/кг (Вольтарен, "Novartis Pharma S.A.S.", табл. 25 мг) [6].
Аутоиммунный артрит у крыс II, III и IV группы воспроизводили путем подкожного введения в основание хвоста эмульгированной смеси 0,2 % раствора бычьего коллагена II типа ("Sigma-Aldrich", США) в 0,1 М уксусной кислоте и полного адъюванта Фрейнда ("Sigma-Aldrich", США) в соотношении 1:1 в дозе 2 мг/кг по коллагену [2, 4]. Для потенцирования артрита через неделю аутоиммунного процесса повторно вводили иммунизирующую смесь в той же дозе. Третьей группе крыс начиная с 14 дня (пик патологии) и в течение последующих дней (до 28 дня) внутрижелудочно вводили в виде водных суспензий 1 раз в сутки фармакологический препарат 1-БИСГ, а IV группе, в таком же терапевтическим режиме – референтный препарат.
В ходе эксперимента на 28 день КИА измеряли объем задней правой лапы крыс при помощи цифрового плетизмометра IITC Life Science (США), высчитывая процент противовоспалительной активности [7].
На 28-е сутки эксперимента животных подвергали декапитации под эфирным наркозом с целью проведения морфологических (структуры сустава), клинических и биохимических исследований показателей крови (определяли маркеры воспаления: содержание С-реактивного белка с помощью иммунохимических наборов "Иму-ЛА-Тест" производства "PLIVA-Lachema Diagnostika" (Чехия), сиаловых кислот (СК) (по методу Гесса), количество лейкоцитов и скорость оседания эритроцитов (СОЭ) с помощью стандартных методик) [3].
Статистическую обработку полученных результатов проводили методами вариационной статистики с использованием t-критерия Стьюдента с помощью компьютерной программы MS Excel 2007 [5].
Результаты исследования и их обсуждение. При моделировании КИА у животных наблюдалось развитие полиартрита, проявлением которого были гиперемии, отек конечностей с увеличением их объема и болезненностью при нажатии. На 10-14 день эксперимента наблюдалось максимальное проявление признаков полиартрита, со снижением подвижности животных, потребления пиши и воды.
Таблица 1. Изменение показателей (↑, ↓, в %) противовоспалительной активности и маркеров воспалении под влиянием вещества БИСГ-1 и референт-препарата

Примечания: показатели интактного контроля взяты за 100 %; * - разница показателей по отношению к ИК опыта; ** - разница показателей по отношению к КП опыта.
На 28 день КИА на фоне применения натрия диклофенака отмечалась противовоспалительная активность на уровне 54%, а вещество 1-БИСГ – на 42,1 % (табл. 1). Уровень С-реактивного белка у группы крыс КП повысился в 5,5 раза (на 16,54 мг/л) по отношению к интактным животным, а уровень СК в 1,3 раза (на 1,11 Ммоль/л). Содержание лейкоцитов увеличилось на 83,5%, что превысило в 1,8 раза, а СОЭ – на 106 %, что в 2 раза превысило показатель интактных животных. Эти показатели свидетельствуют о развитии патологического процесса соединительной ткани иммуно-воспалительного характера, приводящий к деструкции ткани на фоне воспалительных реакций [1, 3].
При применения 1-БИСГ (28 день опыта) отмечалась нормализация содержания СК до уровня интактных животных, а также этот показатель статистически достоверно понижался в 1,3 раза относительно нелеченных животных (на 31,2%). Под влиянием вещества 1-БИСГ происходило понижение содержания С-реактивного белка в 2,8 раза (на 13,08 мг/л), по отношению к контрольной патологии. Следует отметить, что БИСГ-1 по степени нормализующего эффекта на уровень С-реактивного белка и СК несколько превышает препарат сравнения натрия диклофенак, который понижал данные показателя в 2,4 и 1,3 раза (до уровня 8,6 мг/л и 3,5 Ммоль/л), соответственно, по отношения к группе контрольной патологии. Аналогичное нормализующее действие при КИА на показатели лейкоцитов и СОЭ наблюдалось под действием БИСГ-1 на 28 сутки: данные показатели группы не имели достоверных различий относительно интактных животных и достоверно отличались в 2,0 (9,29·109/л) и 1,9 раз (4,63 мм/час) от показателей лейкоцитов и СОЭ животных группы контрольной патологии (18,61·109/л и 8,94 мм/час). Следовательно, вышеизложенная закономерность иллюстрирует весомый антиартритный потенциал вещества-лидера 1-БИСГ, что подтверждено его нормализующим влиянием на маркерные показатели воспалительной реакции (лейкоциты и СОЭ): положительное действие на уровень СОЭ был более выражен у 1-БИСГ, а референт препарат востановил до нормы показатели лейкоцитов. Полученные данные клинико-биохимического исследований крови крыс леченных веществами 1-БИСГ и натрия диклофенак были подтверждены результатами микроскопического исследования с элементами морфометрического изучения суставных тканей. В ходе исследования коленных суставов крыс, проведенного на 28 сутки патологии у II группы, наблюдалось развитие пролиферативных и воспалительных процессов в капсуле и полости сустава, появлением гиперпластических, деструктивных и дистрофических явлений (рис 1-а, б, в). Был поражен как сам хрящ, так и периартикулярные ткани: синовиальные оболочки, связки и мышцы. В ходе морфологического изучения суставов в III группе крыс (леченных веществом 1-БИСГ) не было обнаружено хрящевой деструкцией, что свидетельствует о предотвращении развития деструктивно-дистрофических процессов в хрящевой ткани. По сравнению с интактным контролем суставной хрящ сужен, но имеет нормальное строение. Плотность расположения хондроцитов выше плотности хондроцитов у нелеченных крыс на 20 %. Синовиальные оболочки имеют нормальное строение в 70 % животных. Гиперплазия исследуемых тканей отмечена у одного животного, продуктивный синовит – в 30 % случаев. Причем, в синовиальных оболочках отмечена смешанная клеточная инфильтрация: среди гистиоцитов и фибробластов можно найти и лейкоцитарные клетки. Сосуды синовия иногда расширены (рис 1-г).
Введение референт препарата (IV группа), как и в случае III группы, практически полностью предотвращает развитие деструктивно-дистрофических процессов в хрящевой ткани: суставной хрящ имел ровную поверхность, хондроциты располагались равномерно. Плотность расположения клеточных элементов выше показателей крыс, чем у КП на 20%, толщина хряща также увеличилась, хотя и не так существенно, по сравнению с КП. Синовиальная оболочка по клеточному составу представлена синовиоцитами и фибробластами, признаков воспаления нет. В 33% случаев синовий формирует узкий боковой паннус, который плотно прилипает к хрящу (рис 1 д, е).
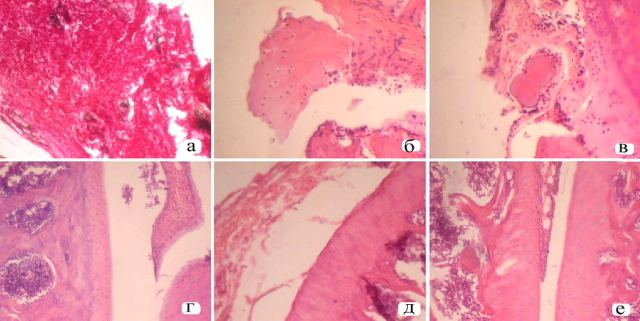
Рис. 1. а - морфоструктура коленного сустава крыс с КИА на 28 сутки исследования. Гиперплазированная плотная синовиальная оболочка; б - бесструктурные, набухшие, разрушенные участки суставного хряща; в - бесструктурные, набухшие, разрушенные участки суставного хряща, окрас изменен, видны редкие лейкоциты; г - морфоструктура коленного сустава под влиянием 1 - БИСГ на 28 сутки эксперимента. Нормальное строение суставного хряща и синовиальной оболочки; д - морфоструктура коленного сустава крыс с КИА под влиянием натрия диклофенака состоянию на 28 сутки эксперимента. Изменены синовиальная оболочка и суставной хрящ. е - Узкий паннус, что наползает на боковую поверхность хряща. Сб. 200.
Заключение. Таким образом, синергизм комбинации природного аминосахара глюкозамину с производными N-фенилантраниловых кислот реализуется в выраженном антиартритном действии.
- По степени влияния на маркерные показатели воспаления (лейкоциты, СОЭ, СК, С-реактивный белок) комбинированного лидера 1-БИСГ приближены к натрию диклофенаку (на 12 % меньше по действию натрия диклофенака);
- При коллаген-индуцированном артрите вещество 1-БИСГ положительно влияет на морфометрические маркеры воспаления (нормализует строения суставного хряща);
- Вещество 1-БИСГ является перспективным корректором воспалительно-деструктивных заболеваний суставов и после доклинического изучения может стать альтернативной в создании безопасных и эффективных антиартритных препаратов.
