Актуальность. Гипермобильность суставов (ГМС) – состояние, при котором амплитуда активных и/или пассивных движений в суставах превышает условную среднестатистическую норму [1]. Синдром гипермобильности суставов (СГМС) – это наличие жалоб со стороны опорно-двигательного аппарата у пациентов с гипермобильными суставами [2]. СГМС выделен в международной классификации болезней 10 пересмотра, в рубрике «Системные поражения соединительной ткани», шифр М 35.7 – «Гипермобильный синдром разболтанности, излишней подвижности. Семейная слабость связок».
Актуальность проблемы синдрома гипермобильности суставов определяется не только его распространенностью, трудностями, возникающими при диагностике, но и высоким риском развития раннего остеоартроза [3].
Распространенность СГМС по литературным данным варьирует от 10% до 57% в зависимости от возраста, пола, расовой принадлежности обследуемых [2,4]. Семейные исследования часто показывают сосуществование в одной родословной (при обследовании и по анамнестическим данным) лиц с гипермобильностью суставов, синдромом гипермобильности суставов, а также негипермобильных носителей [5]. Многими учеными рассматривается важный вопрос роли ГМС и СГМС в развитии преждевременного остеоартроза (ОА), в частности является ли он предрасполагающим фактором его возникновения или нет [3,6,7]?
Методы диагностики ОА в настоящее время специфичны, но не обладают достаточной чувствительностью, чтобы выявить ранние признаки болезни [8]. До сих пор «золотым стандартом» оценки стадий ОА является рентгенография суставов. Однако низкая чувствительность этого метода не позволяет обнаружить ранние поражения сустава. Другие средства визуализации, использующиеся для диагностики ОА (магнитно-резонансная томография, артроскопия, ультразвуковое исследование) демонстрируют лишь структурные изменения, но не отражают активность заболевания и часто не коррелируют с ее симптомами [9].
За последнее время одним из основных направлений исследований остеоартроза является изучение биохимических маркеров для раннего выявления, прогнозирования и эффективности лечения этого заболевания [9,10].
В настоящее время внимание ученых все больше привлекают биомаркеры деградации коллагена II типа: CTX-II, TIINE, C2C, Helix II и др. [9]. Некоторые из маркеров отличались тканевой специфичностью и чувствительностью при ОА. Среди них лидирующие позиции занимает C-концевой телопептид, образующийся при деградации коллагена 2 типа (CTX-II). Он широко используется для оценки деградации хряща при ОА [10,11]. Определение концентрации CTX-II в моче имеет прогностическую и диагностическую ценность для остеоартроза [11]. Биохимический маркер CTX-II, определяемый в когорте ECHODIAH показал наибольшую ассоциацию с тяжестью остеоартроза среди десяти других исследуемых биомаркеров метаболизма кости, хряща и синовиальной оболочки [9]. M. Jung и соавт. определили, что значение CTX-II 266 нг/ммоль креатинина обладало специфичностью 87,5% и чувствительностью 75,5% для предсказания рентгенологической прогрессии остеоартроза [12]. M. Reijman и коллеги в крупномасштабном проспективном популяционном исследовании 1235 мужчин и женщин обнаружили, что повышенная экскреция CTX-II была связана с 8,4-кратным увеличением риска рентгенологического прогрессирования ОА тазобедренного сустава и доказали использование только одного этого биохимического маркера для идентификации пациентов с высоким риском быстрого прогрессирования деструкции суставов [13].
Концентрация мочевого CTX-II может быть ассоциирована с болевым синдромом при ОА [14]. В перекрестном когортном исследовании ECHODIAH 376 пациентов с ОА тазобедренных суставов CTX-II был связан с болью, оцененной при помощи ВАШ [10]. Этот факт подтверждается другим исследованием, в котором пациенты с ранним остеоартрозом коленных суставов и болевым синдромом продемонстрировали более высокий уровень мочевого CTX-II, чем те, у которых боль не присутствовала [15]. В исследовании Zhai и соавт. мочевой CTX-II был выше у молодых людей с болью в коленных суставах (р= 0,04) по сравнению с лицами без боли, однако в этом исследовании не указано, были они гипермобильными или нет [16].
Единственное семейное исследование, посвященное выявлению ассоциаций между биомаркерами ОА у лиц с ГМС и оценке риска развития у них остеоартроза рук и коленных суставов, провели H-C. Chen и коллеги. В когорте GIAFD (n=365) оценивалось шесть сывороточных биомаркеров (PIIANP, CPII, C2C, СОМР, НА, высокочувствительный СРБ). Из всех этих биомаркеров изменения коснулись только СОМР, уровень которого был существенно ниже в гипермобильной группе [7]. Определение концентрации биохимического маркера CTX-II в моче у лиц с синдромом гипермобильности суставов не проводилась.
Цель: определить диагностическое значение концентрации С - концевых телопептидов, образующихся при деградации коллагена II типа в моче у лиц с синдромом гипермобильности суставов и отягощенной наследственностью по остеоартрозу для оптимизации ранней диагностики остеоартроза.
Материалы и методы. Для определения диагностического значения концентрации С-концевых телопептидов, образующихся при деградации коллагена II типа в моче у пациентов с синдромом гипермобильности суставов методом «поперечного среза» за период с 2011 по 2013 г. в исследование включено 58 пациентов (43 женщины и 15 мужчин) с диагнозом синдром гипермобильности суставов. Группу контроля составили 30 пациентов (22 женщины и 8 мужчин, средний возраст 23,5 лет (19;27)) с гипермобильностью суставов.
Критерии включения: 1) пациенты с артралгиями на фоне синдрома гипермобильности суставов в возрасте 18-30 лет; 2) отягощенная наследственность по остеоартрозу; 3) отсутствие рентгенологических и ультразвуковых признаков поражения суставов. Критерии исключения: 1) хронические заболевания почек (для адекватности исследования уровня продуктов деградации коллагена II типа в моче); 2) регулярное еженедельное употребление алкоголя, наркотиков; 3) онкологические заболевания.
Исследование пациентов включало опрос жалоб, общий осмотр, оценку индекса массы тела (ИМТ), фенотипических признаков дисплазии соединительной ткани, клиническое обследование суставов и периартикулярных тканей, оценку степени ГМС при помощи теста Бейтона и определение девяти клинических тестов «синдрома Паганини»: 1. активная ульнарная девиация II-V пальцев кисти за счет отклонения в пястно – фаланговых и межфаланговых суставах; 2. активное переразгибание II-V пальцев кистей; 3. переразгибание запястно-пястного сустава большого пальца кисти; 4. выступание ногтевой фаланги за ульнарный край ладони при фиксации большого пальца поперек ладони; 5. пассивное приведение большого пальца к тыльной стороне кисти руки; 6. активное сгибание в дистальных межфаланговых суставах II-V пальцев кистей рук, которое может напоминать «шею лебедя»; 7. поперечное растяжение пальцев в противоположном направлении в пястно – фаланговых суставах в виде шпагата, этот тест проверяется попарно в II-III, III-IV пальцах кисти; 8. пассивное поочередное укладывание III, IV, V пальцев кистей друг на друга, «палец – улитка»; 9. поворот руки на 360 градусов в плечевом и локтевом суставе [6]. Пациентам проводилось рентгенологическое исследование пораженных суставов в двух проекциях и ультразвуковое исследование суставов. Интенсивность мышечно-суставной боли определялась при помощи альгофункциональных индексов: WOMAC, визуально – аналоговой шкалы боли (ВАШ). Воспалительные заболевания суставов были исключены на предварительных этапах амбулаторного обследования. Для количественного определения в моче С-концевых телопептидов, образующихся при деградации коллагена II типа (CTX-II) использовался набор реагентов для проведения иммуноферментного теста. Специфическая последовательность коллагена II типа в моче определялась методом ИФА с использованием коммерческих наборов Urine CartiLaps ELISA (Nordik Bioscience Diaghostics Cat № AC – 10F1) на базе центральной научно-исследовательской лаборатории Омской государственной медицинской академии. Вычисление результатов CartiLaps производилось с поправкой на концентрацию креатинина. Определение креатинина проводилось биохимическим методом (энзиматическим колориметрическим) с помощью набора Lachema на базе кафедры клинической лабораторной диагностики Омской государственной медицинской академии.
При создании первичной базы данных использовалась программа MS Excel 2010. Статистическая обработка данных выполнена с использованием пакетов прикладных программ Statistica 10. Статистическая значимость различий значений признаков в двух группах определялась с использованием непараметрического критерия Манна-Уитни. При сравнении категориальных переменных оценка значимости различия проводилась с использованием критерия хи-квадрат Пирсона. Для выявления взаимосвязей между переменными был использован коэффициент ранговой корреляции Спирмена. Проверка гипотезы о распределение данных по нормальному закону производилась с помощью критерия согласия Шапиро-Уилка. Статистическая значимость была зафиксирована на уровне 0,05.
Результаты и обсуждение. В основной группе пациентов с синдромом гипермобильности суставов (n=58) было 43 женщины (74,1%) и 15 мужчин (25,9%); средний возраст 23 года (21;26). Контрольную группу пациентов с гипермобильностью суставов (n=30) составили 22 женщины (73,3%) и 8 мужчин (26,7%); средний возраст 23,5 лет (19;27). Группы были сопоставимы по полу, возрасту, ИМТ. В группе пациентов с СГМС частыми жалобами были артралгия «механического» характера (χ²=88,0; p=0,000) и чувство нестабильности в суставах (χ²=5,1; p=0,022) по сравнению с пациентами с ГМС.
Гипермобильные суставы более склонны к подвывихам и вывихам, что может быть предиктором возникновения остеоартроза. В нашем исследовании в группе пациентов с гипермобильным синдромом чаще наблюдался рецидивирующий подвывих плечевых суставов 12,07% (χ²=3,9; p=0,047). Рецидивирующие растяжения связок голеностопных суставов также чаще отмечались у этих пациентов 27,59% (χ²=10,1; p=0,001).
Показатели альгофункциональных индексов у пациентов с СГМС были следующими: боль по визуально-аналоговой шкале (ВАШ) 4 см. (3;5), суммарный индекс WOMAС 190 мм. (120;280), индекс боли по WOMAС 190 мм. (120;280). В группе пациентов с ГМС альгофункциональные индексы не определялись, поскольку они не предъявляли жалоб на мышечно – суставную боль.
По результатам ультразвукового исследования суставов синовит коленных суставов определялся у 24,14% пациентов с СГМС (χ²=8,6; p=0,003).
В основной группе пациентов достоверно чаще по сравнению с контрольной группой пациентов выполнялись следующие тесты «синдрома Паганини»: активного переразгибания II-V пальцев кистей рук, активной обратимой ульнарной девиации II-V пальцев кисти – 70,7% (χ²=55,6; p=0,000), фиксации большого пальца поперек ладони с выступанием ногтевой фаланги за ее ульнарный край – 65,5%, (χ²=21,5; p=0,000), переразгибания запястно-пястного сустава большого пальца кисти – 51,7% (χ²=23,5; p=0,000), пассивного приведения большого пальца к тыльной стороне кисти – 46,5% (χ²=19,5; p=0,000).
Наличие симптома «щелкающего» бедра также достоверно выше у пациентов с СГМС (χ²=19,51; p=0,000).
Критерием χ² для сравнения двух групп по качественному признаку выявлено, что признаки дисплазии соединительной ткани характерны с высокой значимостью для группы пациентов с синдромом гипермобильности суставов. Наиболее часто отмечены следующие признаки ДСТ: ПМК (χ²=4,2; р=0,040), тонкая, гиперрастяжимая кожа (χ²=4,7; р=0,029) и (χ²=7,1; р=0,007) соответственно, варикозное расширение вен нижних конечностей (χ²=6,6; р=0,009), миопия (χ²=16,8; р=0,000), готическое небо (χ²=4,5; р=0,032), сколиоз грудного отдела позвоночника (χ²=14,2; р=0,000), hallux valgus (χ²=8,6; р=0,003), долихостеномелия (χ²=7,8; р=0,005), арахнодактилия (χ²=10,5; р=0,000), атрофические стрии кожи груди, спины, бицепсов без анамнестических данных о приеме глюкокортикостероидов, резком увеличении массы тела или беременности (χ²=8,9; р=0,002). Наличие большего количества признаков дисплазии соединительной ткани в группе пациентов с СГМС можно объяснить их наличием в семьях пациентов, так называемом, феноменом семейного накопления, что свидетельствует о генетической природе наблюдаемого явления.
Уровень CTX-II в основной группе пациентов с синдромом гипермобильности суставов (n=59) составил 455,9 нг/ммоль (332,9; 616,4), что значительно превышает показатели, рассчитанные в контрольной группе пациентов с гипермобильностью суставов 140,35 нг/ммоль (106,4; 187,0) (U=1,0 p=0,000). У пациентов с ГМС уровень CTX-II в моче не превысил показателей, рассчитанных в группе практически здоровых лиц ≤150 нг/ммоль по данным литературы [10]. Это свидетельствует об отсутствии деструктивных процессов в хрящевой ткани, и является, вероятнее всего, благоприятным фактором в отношении малой вероятности развития ОА у пациентов этой группы (рис. 1).
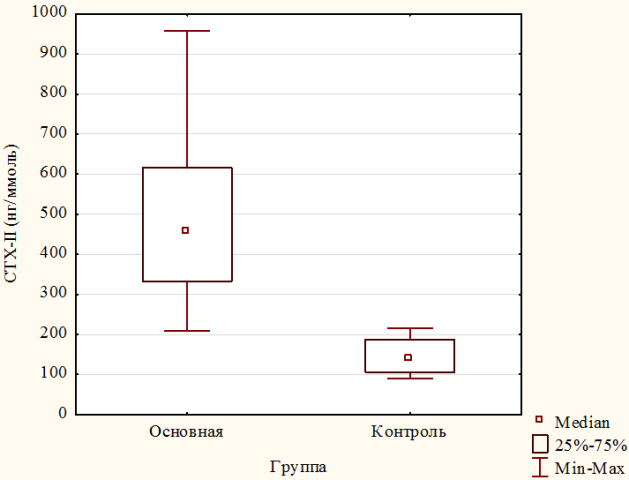
Рис. 1. Концентрация CTX-II в моче в основной группе пациентов с синдромом гипермобильности суставов (n=58) и в контрольной группе пациентов с гипермобильностью суставов (n=30).
Доказано, что значение CTX-II≥266 нг/ммоль обладает диагностической специфичностью 87,5% и чувствительностью 75,5% для прогноза прогрессирования остеоартроза [12].
В нашем исследовании уровень CTX-II≥266 нг/ммоль отмечен в общей сложности у 49 из 58 (84,5%) пациентов с СГМС, из них у 37 (85,06%) из 43 женщин и у 12 (80,0%) из 15 мужчин. Не отмечалось различий по полу у пациентов с уровнем CTX-II≥266 нг/ммоль (χ²=0,3, p=0,577).
Таким образом, можно предположить у этих пациентов возможность прогрессирования остеоартроза, однако для подтверждения нужны дальнейшие долгосрочные проспективные исследования.
При проведении корреляционного анализа по Спирмену в группе пациентов с СГМС выявлена прямая сильная связь между концентрацией CTX-II и болью, оцененной при помощи визуально – аналоговой шкалы (rs= 0,77, p=0,000) (рис. 2), прямая связь средней силы между концентрацией CTX-II и суммарным индексом (rs= 0,48, p=0,000) и индексом боли по WOMAC (rs= 0,49, p=0,000). Не выявлено корреляционных связей между концентрацией CTX-II, возрастом пациентов и степенью выраженности гипермобильности суставов по Бейтон.
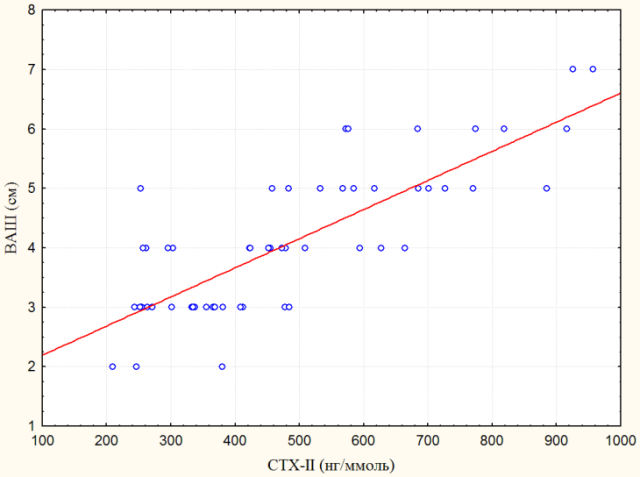
Рис. 2. Взаимосвязь концентраций CTX-II c интенсивностью суставного болевого синдрома, оцененного по визуально – аналоговой шкале в группе пациентов с синдромом гипермобильности суставов.
В нашем исследовании не отмечено корреляционных связей между CTX-II и ИМТ пациентов с СГМС, что согласуется с исследованием P Garnero et al. [10].
Выводы
1. Повышенный уровень мочевого биомаркера продуктов деградации коллагена II типа (CTX-II) может быть одним из диагностических биохимических маркеров ранней (дорентгенологической) стадии остеоартроза у пациентов с синдромом гипермобильности суставов и отягощенной наследственностью по остеоартрозу.
2. Диагностическое значение уровня продуктов деградации коллагена II типа в моче (CTX-II) у лиц с синдромом гипермобильности суставов, наличием артралгий механического характера, отягощенной наследственностью по остеоартрозу и отсутствием рентгенологических признаков поражения суставов составило 455,9 нг/ммоль (332,9; 616,4).
3. Выявлена прямая сильная корреляционная связь концентрации мочевого биомаркера CTX-II и болью, оцененной при помощи визуально – аналоговой шкалы, прямая связь средней силы концентрации CTX-II и суммарного индекса и индекса боли по WOMAC.
