Актуальность. Остеоартроз (ОА), это группа наиболее распространенных заболеваний опорно-двигательной системы человека, мультифакториальной природы, которым в настоящее время страдает до 8-10% населения планеты [1,8]. По данным Минздравсоцразвития РФ с 2000 по 2009 год число больных остеоартрозом увеличилось более чем в 2 раза, причем темпы увеличения распространенности заболевания будут нарастать [3,4]. Основным звеном в патогенезе первичного остеоартроза крупных суставов являются дегенеративные процессы, происходящие в суставном хряще [5]. Основой межклеточного матрикса суставного хряща является коллаген II-го типа. Первично-образующиеся полипептидные цепи проколлагена подвергаются частичной перестройке, на данном этапе нарушение ремоделлирования молекул является критическим для поддержания суставным хрящом своей цитоархитектоники и прочностных качеств [6]. Причины развития первичного остеоартроза различны, однако в настоящее время их делят на: генетические (пол, этническая принадлежность, различные врожденные аномалии развития костной ткани), негенетические - возраст, индекс массы тела, постменопауза, а также факторы действия внешней среды - профессиональная деятельность, характер физической активности в течении жизни, различные травмы [2]. Таким образом, оказывается очень важной роль рибосомных генов в патогенезе первичного остеоартроза, т.к. они регулируют уровень белкового синтеза [7] и участвуют в построении цепей коллагена [8].
Основными негенетическими, или средовым, факторам риска развития первичного остеоартроза относятся: индекс массы тела (ИМТ), коэффициент физической активности (КФА) [8]. Возможность коррекции данных показателей и их возможное модифицирующее влияние на выраженность клинических проявлений первичного остеоартроза, при определенном «фоновом» значении функциональной активности рибосомных генов (ФАРГ) обусловили актуальность данного исследования.
Цель исследования. Изучение возможного модифицирующего действия факторов риска на выраженность клинических проявлений первичного остеоартроза при «фоновом» значении функциональной активности рибосомных генов.
Материалы и методы. Для изучения возможного модифицирующего действия факторов риска заболевания при «фоновом» значении ФАРГ, было проведено исследование на возможное взаимное действие общеизвестных факторов риска остеоартроза с функциональной активностью рибосомных генов. Оценивалась функциональная активность рибосомных генов по 10 акроцентрическим хромосомам группы D и G, так и отдельно по каждой группе акроцентиков. При проведении исследования были сформированы контрольная и исследуемая группы. В исследуемую группу вошло 115 пациентов с первичным остеоартрозом крупных суставов, а контрольную группу составили 50 пациентов, без заболеваний опорно-двигательной системы. Данные группы являлись репрезентативными по полу и возрасту.
Сбор анамнестических данных о наличии факторов риска заболевания, а также особенностях клинического течения ОА производился на основании разработанных нами анкет. Анкета включала пять специализированных блоков, содержащих подробное описание клинического течения заболевания и комплекса провоцирующих факторов.
Затем проводилось цитогенетическое исследование с целью установлений уровня функциональной активности рибосомных генов. Материалом для цитогенетического исследования послужили препараты лимфоцитов периферической крови. Получение образцов крови производилось из периферической вены в стерильные культуральные флаконы объемом 20 мл., в которые предварительно помещался приготовленный раствор гепарина (0,1 мл на 1 мл крови) для исключения фактов агглютинации эритроцитов при транспортировке образцов в лабораторию.
Образцы крови культивировались в стерильных культуральных флаконах с многокомпонентной питательной средой, в термостате при температуре 37ºС, с экспозицией в течение 72 часов. Многокомпонентная питательная среда состояла из: среды 199 (6,0 мл) и сыворотки крупного рогатого скота (1,5 мл). В качестве стимулятора активности пролиферации лимфоцитов использовался фитогемагглютинин.
Около 2-х часов до окончания культивирования, к культурам лимфоцитов добавлялся раствор колхицина в конечной концентрации 0,5 мкг/мл, для получения увеличенного количества метафазных пластинок хромосом.
Фиксацию производилась спустя 72 часа от времени старта культивирования. После центрифугирования и удаления жидкости, не содержащей клеточный осадок, полученные клеточные взвеси инкубировали с предварительно подогретым до 37ºС раствором хлорида калия, в концетрации 0,75 М, в течение 20 минут при 37ºС, для гипотонизации и разрушения клеточных мембран культуры лимфоцитов. После завершений процесса гипотонизации проводилось повторное центрифугирование, для удаления остатков клеточных мембран путем отбора жидкости, расположенной над клеточным осадком. Полученные клетки фиксировали с применением фиксатора Карнуа (состоит из ледяной уксусной кислоты и метанола) в соотношении 3:1, экспозиция составляла около трех часов. За время фиксации производилась трехкратная смена фиксатора. При получении полного обесцвечивания суспензии клеток, производилось раскапывание на предварительно подготовленные обезжиренные предметные стекла, смоченные дистиллированной водой, с целью лучшей адгезии полученной суспензии клеток.
Препараты высушивались на воздухе, при комнатной температуре и шифровались, при возникшей необходимости докрашивались рутинным раствором красителя Гимза на фосфатном буфере, для исключения факта «ложного» роста сопутствующей микрофлоры [9,10].
Забор материала, приготовление культур лимфоцитов периферической крови и изготовление препаратов метафазных хромосом проводили одинаков в каждом случае наблюдения. После окончания приготовления, препараты, выдерживались течение 7-14 дней, при комнатной температуре с окраской нитратом серебра.
Производилось выявления участков рибосомных генов обладающих наибольшей транскрипционной активностью [11].
Затем наносилось 50 мкл бидистиллированной воды, 50% раствор нитрата серебра - 100 мкл и 2% раствор желатина - 150 мкл, на предварительно высушенные препараты метафазных хромосом.
Производилось тщательное перемешивание, затем препараты экспонировались в термостате 8-9 мин при температуре 56,7ºС. После завершения окраски и полного высыхания красителя, производился смыв раствор серебра с предметных стекол под проточной водой и высушивание при комнатной температуре. Затем препараты помещались раствор хлорида цезия, с температурой 56,7ºС и временем экспозиции - 10 мин. Обезвоживание препаратов производилось в 70% и 96% этиловом спирте.
Препараты высушивались на воздухе, при комнатной температуре и окрашивались раствором Гимзы (250 мкл раствора Гимзы растворялось в 5 мл буферного раствора) [9,10].
Число активных рибосомных генов определялось с использованием светового микроскопа фирмы "Биолам".
Для оценки активности рибосомных генов использовались следующие критерии: общее число окрашенных ядрышкообразующих районов (ЯОР) в метафазной пластинке, а также интенсивность окраски индивидуальных ЯОР.
Число окрашенных ЯОР подсчитывалось в каждой анализируемой метафазной пластинке. Если данная акроцентрическая хромосома содержала в коротком плече зерна серебра, то такой ЯОР оценивался как активный, если он был не окрашен, то расценивался как неактивный.
Для исключения возможной неправильной или неполной окраски ЯОР азотнокислым серебром, при выполнении анализа отбирались пластинки с полной (завершенной) окраской, для этого использовались морфологические критерии [2]. На полностью окрашенных хромосомах, в ЯОР имеется однородное окрашенное пятно, а проксимальная часть короткого плеча и длинные плечи хромосом остаются неизменными.
В каждом конкретном случае активности по 10 ЯОР рассчитывался без кариотипирования хромосом в 30-40 клетках и складывался из показателей ФАРГ хромосом группы D и хромосом группы G, затем расчитывалось среднее арифметическое значение показателя.
Результаты исследования. Для определения возможного взаимного действия ФАРГ и ИМТ, значения последнего приняли таким образом: ИМТ <28 имеется избыточная масса тела, а при ИМТ>28 вес находится в переделах нормы. При отсутствии у пациента избыточного веса (ИМТ<28), наблюдались статистически достоверные различия по ФАРГ 10 (t=5,92, p=0,0001) и по хромосомам группы D (t=5,69, p=0,0001), статистически достоверных различий по хромосомам группы G не выявлено. (t=0,80, p=0,42). Полученные данные представлены в табл. 1.
Таблица 1. Уровень ФАРГ у пациентов с отсутствием лишнего веса (ИМТ<28)

При наличии у пациентов избыточной массы тела (ИМТ>28) имелись статистически достоверные различия исследуемой и контрольной групп по ФАРГ 10 (t=4,95, p=0,0001) и ФАРГ D (t=5,69, p=0,0001) статистически достоверных различий по ФАРГ G получено не было (t=1,55, p=0,12), полученные данные представлены в табл. 2.
Таблица 2. Уровень ФАРГ у пациентов с избыточной массой тела (ИМТ>28)

Для выявления совместного действия уровня ФАРГ и одного из двух вариантов признака «ИМТ» был проведен корреляционный анализ, с применением метода корреляции по Спирмену. Полученные данные представлены в корреляционных матрицах, при ИМТ <28 и при ИМТ >28.
В результате корреляционного анализа с различными факторами, в первую очередь выявлена положительная зависимость (r= 0,8) c уровнем ИМТ, также выявлена положительная корреляционная связь с длительностью заболевания (r=0,53). Отрицательные корреляционные связи обнаружены между ФАРГ 10 и уровнем КФА (r=-0,53) и объективной тяжестью заболевания (r=-0,45). Все перечисленные корреляционные направленности имеют высокую и среднюю выраженность.
Данные о наличии корреляционных связей при уровне ИМТ>28. В группе пациентов с высоким ИМТ также наблюдались корреляционные связи ФАРГ 10: отрицательная сильная корреляционная связь с длительностью заболевания (r=-0,58), средняя положительная корреляция с возрастом манифеста заболевания (r=0,27) и две корреляционные связи отрицательной направленности с тяжестью заболевания (r=-0,51) и субъективной выраженностью болевого синдрома.
Вторым ведущим фактором риска развития первичного ОА является уровень физической активности в течении жизни пациента. Для удобства оценки данного показателя, нами был использован интегральный показатель - коэффициент физической активности (КФА). Таким образом, контрольная и исследуемая выборки разделились на группы, включающие: пациентов ведущих почти сидячий или малоподвижный образ жизни, и активных или чрезмерно активных пациентов.
Данные о ФАРГ у пациентов, ведущих низко активный образ жизни представлены в табл. 3.
Таблица 3. Уровень ФАРГ у пациентов, ведущих низко активный образ жизни
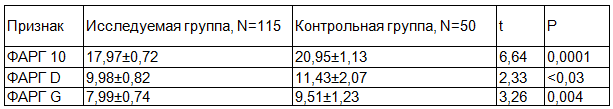
Как видно из полученных данных наблюдались статистически достоверные различия по всем видам ФАРГ: ФАРГ 10 (t=6,64, p=0,0001), ФАРГ D (t=2,33, p=0,3) ФАРГ G (t=3,26, p=0,004).
Данные о наличии статистически достоверных различий ФАРГ при высоком уровне физической активности представлены в табл. 4.
Таблица 4. Уровень ФАРГ у пациентов с высоким уровнем физической активности

Как видно из полученных данных наблюдались статистически достоверные различия по видам ФАРГ: ФАРГ 10 (t=6,92, p=0,0001), ФАРГ D (t=7,27, p=0,0001), однако статистически достоверных различий по ФАРГ G обнаружено не было.
Для выявления различного вида и направленности зависимостей для данного признака так же был произведен корреляционный анализ.
При проведении корреляционного анализа в группе ведущих малоактивный образ жизни, обнаружены следующие связи: отрицательная связь высокой силы с длительностью заболевания (r=-0,48). Однако больше корреляционных связей для данной группы пациентов обнаружено не было.
При проведении корреляционного анализа были выявлены следующие корреляционные связи ФАРГ: имелась отрицательная зависимость высокой силы с возрастом появления осложнений (r=-0,62), также сильные зависимости отрицательной направленности наблюдались с тяжестью заболевания (r=-0,52) и субъективной выраженностью болевого синдрома (r=-0,51).
Выводы. Исследование взаимного действия факторов риска развития ОА при определенном уровне ФАРГ дает информацию у модифицирующем действии данных факторов при определенном «фоновом» значении ФАРГ.
В группе пациентов с отсутствием избыточной массы тела наблюдались статистически достоверные различия по ФАРГ во всех группах, у пациентов с наличием избыточной массы тела не обнаружено статистически достоверных различий по ФАРГ G. После проведенного корреляционного анализа для данной группы больных получены данные о наличии корреляций высокой силы и отрицательной направленности ФАРГ с тяжестью заболеваний и субъективной выраженностью болевого синдрома (r= -0,53; r= -0,45 и r=-0,51; r=-0,49 соответственно). Полученные данные говорят об отсутствии ассоциации зависимостей выраженности клинических симптомов ОА с «фоновым» значением ФАРГ. Однако имелись различия в коэффициентах корреляции ФАРГ и длительностью существования заболевания: при низком значении ИМТ эта связь положительная (r=0,54), а при высоком отрицательная (r=-0,58), и в первом и втором случаях связь имеет высокую силу. Соответственно у пациентов с высоким ИМТ имеется обратная корреляционная связь с уровнем ФАРГ.
Данные, полученные в результате исследования взаимного действия уровня ФАРГ и уровнем физической активности пациента свидетельствуются также о наличии достоверных статистических различий по группам сравнения, как для пациентов с низким КФА так и высоким КФА.
Коэффициенты корреляции имели достаточную силу в случае корреляции ФАРГ и длительностью заболевания, так более сильная корреляционная связь наблюдалась в группе пациентов с высоким КФА (r=-0,62) чем с низким КФА (r=0,48), что может свидетельствовать о влиянии уровня КФА на клиническое течение ОА, даже при одинаковом «фоновом» уровне ФАРГ.
Также высокий уровень КФА коррелирует с возрастом манифестации заболевания, но только в группе с высоким КФА (r=0,28). Высокий уровень КФА имеет корреляционные связи с выраженностью клинических симптомов ОА и объективной тяжестью заболевания только в группе с высоким КФА, в группе с низким КФА данных корреляционных связей нет.
