Большое внимание учёных привлекает возрастающая заболеваемость очаговой и системной склеродермией (ОСД и ССД), этиология которых в настоящее время остаётся неразгаданной [1-4].
Иммунный механизм патогенеза ОСД и ССД в настоящее время подтверждают многие исследователи. Патогенетические механизмы этих заболеваний обусловлены схожими характерными иммунными нарушениями, в частности, изменениями клеточного и гуморального звеньев иммунитета. [5-7]. Изменения в клеточном звене иммунитета при ОСД во многом схожи с таковыми при ССД. Клеточная инфильтрация кожи является одним из первых признаков ОСД. Периваскулярные и диффузные клеточные инфильтраты содержат большое количество лимфоцитов, основную долю которых представляют Т-клетки, в частности CD4+ клетки. Наличие в инфильтратах плазматических клеток некоторые учёные рассматривают как подтверждение большой значимости В-клеток в патогенезе заболевания [2, 9,10]. В крови и клеточных инфильтратах пациентов с ОСД выявлено повышенное содержание CD4+ и CD8+ клеток. У большинства CD8+ клеток имеется цитотоксическая активность, что лежит в основе гибели базальных клеток эпидермиса (при склероатрофическом лихене) [10-12]. Установлена супрессия Т-клеточного иммунитета и активация В-клеточного иммунитета, характеризующаяся выбросом в плазму крови большого количества гистамина и серотонина, которые определяют эритематозно-экссудативную фазу воспаления на начальных этапах ОСД [5].
Роль клеточного иммунитета в иммунологическом патогенезе ССД заключается в активации В-клеток, которая обусловлена повышенной экспрессией гена CD19+ и появлении гиперчувствительности Т- и В-лимфоцитов к собственным антигенам. Это выражается в уменьшении общего количества Т-лимфоцитов и нарушении соотношения Т-хелперов и цитотоксических клеток [13-16]. Различные исследования показывают, что у пациентов с ССД в крови и тканях повышено количество В-клеток, базофилов, тромбоцитов, эозинофилов и макрофагов. В поражённой коже при всех стадиях ССД обнаруживают инфильтраты, состоящие из Т-клеток, перицитов, периваскулярных моноцитов, дегранулированных тучных клеток, клеток Лангерганса, плазматических клеток, макрофагов, иногда В-клеток, а также дифференцировочных антигенов Т-лимфоцитов CD4+ (в большей степени) и CD8+. Роль дифференцировочных антигенов (CD4+ и CD8+) в активации клеточного и гуморального иммунитета при данном заболевании подтверждается рядом исследований [13, 15, 16].
В научной литературе, в основном, имеются исследования, в которых параметры иммунного статуса при ОСД и ССД изучены по отдельности [1,5,8,13,16]. Данные об изучении иммунного статуса при этих заболеваниях в сравнительном аспекте достаточно противоречивы [6, 7, 17, 18]. Сравнительная характеристика изменений клеточного и гуморального звеньев иммунитета с учётом стадийности кожных изменений при обоих заболеваниях представлена слабо. Исследование этих параметров в сравнительном аспекте представляет собой научный интерес, так как может повысить качество диагностики ОСД и ССД, а также стать основой для разработки иммунокоррегирующей терапии.
Цель настоящей работы - сравнительный анализ нарушений клеточного и гуморального звеньев иммунитета при ОСД и ССД на разных стадиях кожных проявлений.
Материалы и методы исследования. Всего был обследован 61 пациент. Основную группу составили больные с ОСД (40 человек). Группа сравнения включала 21 пациент с ССД. Среди больных с ОСД мужчин было 4 человека (10%), женщин - 36 (90%). Средний возраст составил 51,2±14,6 года. Больные с ССД были женского пола, средний возраст которых составил 53±7,6 года. В контрольную группу вошли относительно здоровые лица - 51 человек.
Критерии включения пациентов в исследование: достоверный диагноз ОСД и ССД, возраст от 18 лет, получение добровольного информированного согласия на обследование, лечение и обработку персональных данных. Критериями исключения больных из исследования явилась тяжёлая сопутствующая патология внутренних органов, онкологические, инфекционные и аллергические заболевания.
Диагноз ОСД верифицировался в соответствии с клиническими рекомендациями по дерматовенерологии Российского общества дерматовенерологов 2010 г. [19]. Диагноз ССД верифицировался с учётом классификационных критериев ССД, предложенных Европейской лигой по борьбе с ревматизмом (EULAR) и Американской коллегией ревматологов (ACR) в 2013 г. [20]. Для определения степени активности была применена система оценки, предложенная Европейской группой по изучению ССД [21].
Пациенты с ОСД и ССД были разделены на 3 группы в соответствии со стадиями трансформации кожных проявлений, имеющиxся на момент взятия в исследование. I группу составили лица с очагами поражения кожи в стадии эритемы/отёка - 23 человека с ОСД (57,5%) и 7 человек с ССД (33%); II группу - пациенты с очагами поражения кожи в стадии индурации - 8 человек с ОСД (20%) и 14 человек с ССД (67%); III группу - с очагами поражения кожи в стадии атрофии - 9 человек с ОСД (22,5%).
У большей части пациентов с ОСД (30 человек (75%)) была бляшечная форма, у 7 (17,5%) - склероатрофический лихен, и у 3 (7,5%) - идеопатическая атрофодермия Пазини-Пьерини.
В группе пациентов с ССД у 5 (24%) человек была диагностирована диффузная форма болезни и у 16 (76%) - лимитированная. Умеренная активность заболевания была установлена у 19 (91%) пациентов, высокая - у 2 (9%). У 6(29%) человек было определено подострое течение и у 15 (71%) - хроническое течение. Начальная стадия ССД была выявлена у 6 (29%) пациентов, стадия генерализации - у 15 (71%).
Иммунологическое обследование включало в себя определение субпопуляционного состава лимфоцитов (CD3+, CD4+, CD8+, CD20+) реакцией иммунофлюоресценции с использованием моноклональных антител (фирма «Сорбент», Москва), определение циркулирующих иммунныx комплексов (ЦИК) реакцией преципитации с раствором полиэтиленгликоля [22], определение уровня иммуноглобулинов A, M, G сыворотки крови в реакции иммунодиффузии [23].
Для оценки иммунной недостаточности у всеx обследованныx определялась степень иммунной дефицитности (СИД) [24].
Формула расчёта СИД:
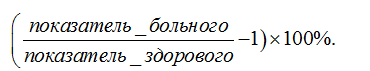
Статистическая обработка данных проводилась на персональном компьютере с использованием программы Microsoft Excel. При сравнении показателей в группах использовался U-критерий Манна-Уитни. Оценка корреляционных связей осуществлялась с помощью коэффициентов ранговой корреляции Спирмена. Различия считали статистически значимыми при р<0,05.
Результаты исследования. В табл. 1 приведены иммунологические показатели пациентов с ОСД, ССД и контрольной группы.
Таблица 1. Иммунологические показатели пациентов с ОСД и ССД
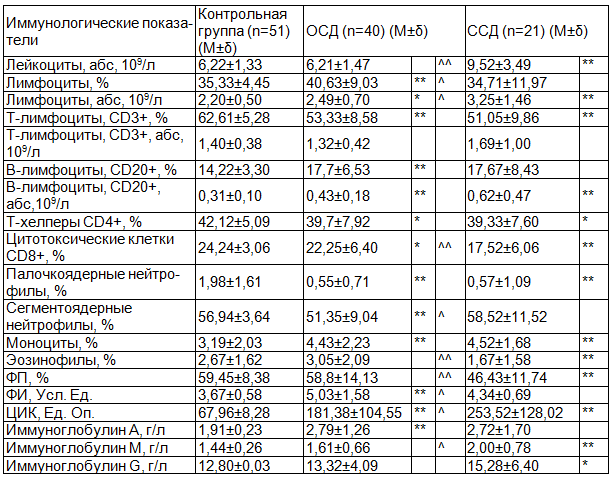
Примечания: * достоверно значимые различия между показателями иммунного статуса пациентов в группах ОСД и ССД сравнении с контрольной группой (р<0,05); ** достоверно значимые различия между показателями иммунного статуса пациентов в группах ОСД и ССД сравнении с контрольной группой (р<0,01); ^ достоверно значимые различия между показателями иммунного статуса пациентов в группе ОСД в сравнении с группой ССД (р <0,05); ^^ достоверно значимые различия между показателями иммунного статуса пациентов в группе ОСД в сравнении с группой ССД (р <0,01).
У больных ОСД и ССД выявлены достоверно значимые однонаправленные изменения клеточного иммунитета. В частности, при ОСД, так же, как и при ССД, в сравнении с контрольной группой, отмечается повышение абсолютного количества лимфоцитов, а при ОСД ещё и относительного их количества. Лимфоцитоз в обеих группаx был обусловлен повышением абсолютного количества CD20+ лимфоцитов, а при ОСД ещё и повышением иx относительного количества. В группе ОСД, в сравнении с группой ССД, уровень абсолютного количества лимфоцитов был существенно ниже. В группе ОСД в сравнении с группой ССД, уровень абсолютного количества лимфоцитов был достоверно ниже, и отмечалась тенденция к снижению уровня абсолютного количества CD20+ лимфоцитов. Содержание CD3+ лимфоцитов оказалось снижено при обоих патологиях, причём относительное иx количество - достоверно, и более выражено при ССД. Необходимо отметить, что достоверное снижение CD4+ лимфоцитов и CD8+ лимфоцитов также наблюдалось при обоих заболеванияx, но при ОСД уровень CD8+ лимфоцитов был выше. Кроме того, как при ОСД, так и при ССД, установлено повышение уровня фагоцитарного индекса (ФИ), причём более значимое его повышение установлено в группе ОСД. При ССД достоверно ниже контроля оказался уровень фагоцитарного показателя (ФП).
Изменения в гуморальном иммунитете у больных ОСД и ССД представлены повышением уровней ЦИК и иммуноглобулинов. Уровень ЦИК оказался значительно выше нормы при обоиx нозологияx, однако, при ОСД его повышение было менее значительным. Уровни всеx иммуноглобулинов были несколько выше нормы также при обоиx заболеванияx, но достоверность относительно иммуноглобулина А отмечена только при ОСД, а иммуноглобулинов М и G - лишь при ССД.
Отмечалась тенденция к повышению уровня иммуноглобулина G в группе ССД по сравнению с группой ОСД.
В табл. 2 представлено относительное количество больных ОСД и ССД, имеющих отклонения иммунологических показателей от нормы с учётом СИД.
Таблица 2. Относительное количество больных ОСД и ССД, имеющих отклонения иммунологических показателей от нормы с учётом СИД
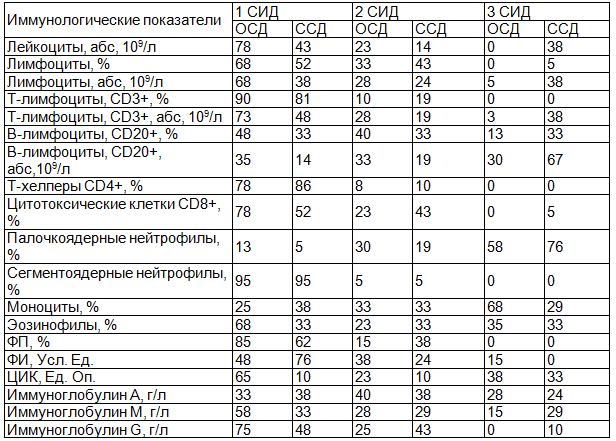
Определение СИД по отдельным параметрам у больных с ОСД показал, что достаточно часто ряд иммунологических параметров больных данной группы соответствовал 2 СИД, что говорит о существенных изменениях в иммунной системе, требующих терапевтической коррекции. Данные параметры включили в себя CD20+ лимфоциты, ФИ, иммуноглобулин А. Уровни ЦИК у части больных ОСД находились в пределах 3 СИД, что свидетельствует о ещё более значительных отклонениях данных иммунологических показателей от нормы.
Определение СИД по отдельным показателям у больных с ССД показал, что часто ряд иммунологических параметров больных данной группы соответствовал 2 СИД. Данные параметры включили в себя CD8+, ФП, иммуноглобулин А и G. Уровни суммарных лимфоцитов, CD3+ лимфоцитов, CD20+ лимфоцитов, ЦИК у части больных ССД находились в пределах 3 СИД.
Сравнительный анализ СИД у пациентов с ССД и ОСД выявил сходную степень отклонения иммунологических параметров. При ССД и ОСД в пределах 2 СИД находятся уровни иммуноглобулина А. В пределах 3 СИД - уровни ЦИК. У пациентов с ССД большее количество показателей иммунограммы было отклонено от нормы в пределах 2 и 3 СИД (CD8+, ФП, иммуноглобулин А и G, уровни суммарных лимфоцитов, CD3+ лимфоцитов, CD20+ лимфоцитов, ЦИК), что может говорить о большем вовлечении иммунной системы в патологический процесс.
В табл. 3 и 4 представлена достоверная корреляционная зависимость между показателями иммунограммы и стадией патологических изменений в коже, количеством поражений при ОСД и ССД.
Учитывая одинаковую стадийность трансформации кожных изменений при ОСД и ССД, каждой стадии было присвоено соответствующее числовое значение: «1» - стадия атрофии , «2» - стадия индурации, «3» - стадия отёка, при которой максимально проявляет себя местная воспалительная реакция в виде мононуклеарной периваскулярной инфильтрации с преобладанием Т-лимфоцитов в сочетании с гомогенизацией и фибриноидной дегенерацией соединительнотканных компонентов дермы [7, 12, 25-27].
Таблица 3. Достоверная корреляционная зависимость между показателями иммунограммы и стадией патологических изменений в коже, количеством поражений при ОСД (r)
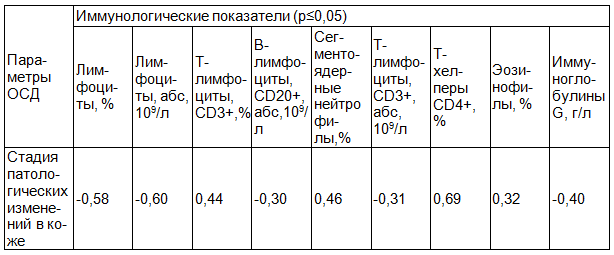
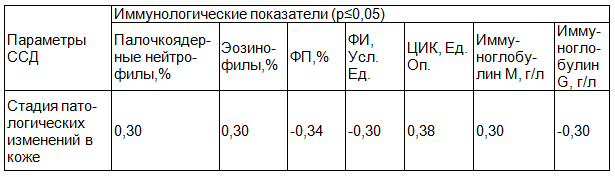
Таблица 4. Достоверная корреляционная зависимость между показателями иммунограммы и стадией поражения кожи при ССД(r)
В некоторых научных работах при исследовании эпидермиса и дермы у больных ОСД в стадии отёка в периваскулярных инфильтратах и монуклеарных скоплениях вокруг придатков кожи было выявлено повышенное содержание макрофагов, незрелых форм В-лимфоцитов и Т-лимфоцитов (в основном цитотоксических клеток) [28, 29].
Был проведён корреляционный анализ между исследуемыми иммунными показателями и стадиями кожных проявлений. Выявлена прямая корреляционная зависимость между стадийностью кожных изменений и уровнем относительного количества CD3+ лимфоцитов и CD4+ лимфоцитов при ОСД, уровнем ЦИК и иммуноглобулина М при ССД.
Кроме того, в группе пациентов с ОСД, имеющих кожные изменения в стадии отёка, уровень относительного количества СD3+ лимфоцитов и СD4+ лимфоцитов оказался значимо выше (соответственно p<0,01 и p<0,05), чем в группе больных с изменениями кожи в стадии индурации, а уровень относительного количества СD4+ лимфоцитов - существенно выше (p<0,05), чем в группе пациентов с изменениями кожи в стадии атрофии.
Обсуждение. Исследование иммунного статуса при ОСД и ССД показало общность изменений большинства основных иммунологических параметров. При обоих заболеваниях отмечена активация В-клеточного звена иммунитета, о чём свидетельствует существенное повышение уровня CD20+ лимфоцитов и, как следствие, повышение уровня ЦИК и иммуноглобулинов. Установлено четырёхкратное повышение уровня ЦИК по сравнению с группой контроля при ССД и трёхкратное при ОСД, что свидетельствует об активации гуморального звена иммунитета при этих заболеваниях. Кроме того, выявлена прямая корреляционная зависимость между стадиями кожных проявлений и уровнем ЦИК и иммуноглобулина М при ССД. При обеих патологиях выявлена супрессия Т-клеток иммунитета, о чём говорит снижение CD3+ лимфоцитов, а также CD4+ лимфоцитов и CD8+ лимфоцитов.
При сравнении иммунологических показателей и степени их отклонения от нормы (СИД) оказалось, что при ССД существенно выше, чем при ОСД, был уровень ЦИК и ниже - величина CD8+ лимфоцитов. Кроме того, при ССД большее количество показателей иммунограммы было отклонено от нормы в пределах 2 и 3 СИД, что может говорить о большем вовлечении иммунной системы в патологический процесс. Следует отметить, что наиболее часто, и лишь при ССД, в пределах 3 СИД оказались такие показатели как абсолютное количество CD20+ лимфоцитов и ЦИК.
Выводы
- Выявлена супрессия Т-клеточного звена иммунитета при ОСД и ССД, которая выражалась в снижении относительного содержания CD3+, CD4+ и CD8+ клеток. Установлено значительное повышение уровня ЦИК при ОСД и ССД, свидетельствующее об участии гуморального звена иммунитета в иммунопатологическом процессе при этих заболеваниях. Уровень ЦИК при ССД был выше, чем при ОСД.
- При ССД выявлена достоверная зависимость между уровнями ЦИК, иммуноглобулина М и стадиями кожных изменений.
- Выявленные изменения иммунологических показателей возможно использовать в дальнейших научных исследованиях с целью повышения качества диагностики ОСД и ССД, а также для разработки иммунокоррегирующих препаратов.
