В последнее время наблюдается увеличение обращаемости за ортопедической стоматологической помощью [2,9] и отмеченная тенденция наблюдается и в странах содружества. Несмотря на значительные успехи в области материаловедения и улучшения качества изготовления зубных протезов, различные авторы отмечают у пациентов жалобы на их непереносимость от 0,6 до 12% [10]. Непереносимость зубных протезов пациентами связана с недостатком или нарушением технологии их изготовления. Непереносимость может быть связана с содержанием остаточного мономера акриловых пластмасс, из которых изготавливается базис протеза, постоянно вымываемого в ротовую жидкость [1].
Важным патогенетическим моментом развития непереносимости зубных протезов является изменение биохимического состава ротовой жидкости, гомеостаз которой изменяется даже при пользовании зубными пастами [11]. Применение в клинической практике новых материалов, и в частности, косметичных металлокерамических конструкций в известной степени ограничено вследствие высокой микро твердости керамики. Исключение факторов, приводящих к непереносимости зубных протезов, приводит к дифференцировке «истинной» непереносимости, связанной с адаптивными возможностями организма пациента. Исследования последних лет показали, что у пациентов при пользовании съемными зубными протезами, различный уровень адаптивных возможностей, изучение которых позволяет прогнозировать развитие непереносимости [4,7].
Целью настоящего исследования явилось изучение состава ротовой жидкости у пациентов с различной степенью адентии. Материалы и методы. Всего обследовано три группы лиц, общая численность которых составила 38 человек обоего пола. Первую группу составили 17 лиц с интактными зубными рядами и здоровым пародонтом. Вторая группа состояла из 10 больных с частичной вторичной адентией, которым были изготовлены протезы из нержавеющей стали объемом в 5-6 единиц. Третья группа состояла из 11 больных с идентичной вторичной адентией, протезируемых металлокерамическими зубными протезами. Исследования проведены до протезирования, после сдачи зубного протеза, а также на 14 и 28 дни после пользования протезом. Ротовую жидкость у обследуемых собиралась обычно с 9 до 10-00 часов утра. Перед сбором слюны больные тщательно споласкивали рот теплой дистиллированной водой. Смешанную слюну собирали в чистые пробирки. Содержание малонового диальдегида определяли по методу, описанному Нагоевым Б.С. и др., (2008). Содержание гидроперекисей в смешанной слюне определяли по методу Гаврилова В.В. и С.И. Мишкорудной (1983). Содержание общих липидов в ротовой жидкости проводили с помощью биотеста “La Chema” (Чехия), Содержание общего белка в ротовой жидкости проводили по методу Lowry O.H. et all. (1951). Определение антиперекисной активности (АПА) смешанной слюны проводили по методу У.К.Ибрагимова с соавт. (1993). Активность супероксиддисмутазы (СОД) в ротовой жидкости определяли по методу Mirsa P.H.,. Fridovich I. S. (1972).
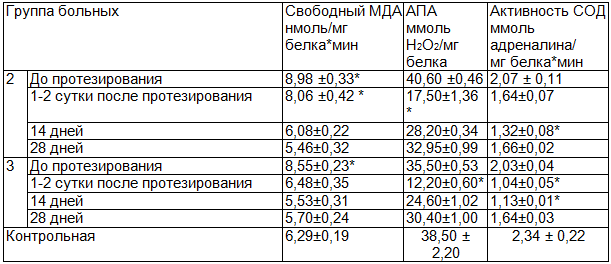
Полученные результаты и их обсуждение. В первой группе лиц, с интактным зубным рядом, содержание свободного малонового диальдегида (МДА) было в следовых количествах, что совпадает с данными литературы [4,5]. Сопоставление содержания свободного МДА в ротовой жидкости и сыворотке крови показало более высокое содержание его в ротовой жидкости, хотя это связано с пересчетом на количество общего белка [13]. Содержание белка в ротовой жидкости в 10-15 раз меньше, чем в сыворотке крови, тогда как свободное МДА в слюне в 12-15 раз выше аналогичного показателя крови. Следовательно, содержание свободного МДА в сыворотке крови и ротовой жидкости приблизительно равно.
В ротовой жидкости больных второй группы до начала протезирования обнаружено более чем в 1,4 раза накопление свободного МДА по сравнению с аналогичным показателем контроля, что вероятно связано с повреждением тканей протезного ложа в участках адентии. Ряд авторов связывают накопление свободного МДА с усилением синтеза простагландинов, наблюдаемое при воспалении [5], при котором в качестве побочного метаболита образуется МДА.
Анализ полученных результатов показывает, что у больных второй и третьей групп до протезирования в ротовой жидкости содержание свободного МДА одинаково превышал аналогичный показатель контрольной группы в 1,4 раза (табл. 1). После протезирования больных 2-й группы в ротовой жидкости накопление свободного МДА снизилось незначительно, и достоверно превышало аналогичный показатель группы здоровых лиц. В последующие сроки исследования установлено снижение накопления свободного МДА, что видимо, косвенно подтверждает взаимосвязь присутствия свободного МДА с процессом воспаления, в результате повреждения слизистой оболочки полости рта, на участках отсутствующих зубов. Аналогичное исследование ротовой жидкости у больных третьей группы обнаружило снижение содержания свободного МДА после сдачи зубного протеза. Обнаруженное отличие в интенсивности генерации активных форм кислорода (АФК) в ротовой жидкости больных, имеющих зубные протезы из различных материалов, объясняется состоянием защитной антиокислительной системы. До протезирования состояние антиокислительной системы находилось в состоянии компенсации, в силу чего практически не отличалась от аналогичного показателя контрольной группы. У больных второй группы АПА ротовой жидкости и активность СОД снижались, причем наибольшее снижение отмечено в первые сутки пользования зубными протезами, что, видимо, связано с периодом функционального напряжения процесса адаптации больных к новым условиям. В последующие сроки исследования отмечалось небольшое повышение активности СОД, которая отличалась от исходного уровня в статистически недостоверных пределах (табл. 1). Видимо, снижение активности ферментов антиоксидантной системы (АОС) связано с обнаруженным нами снижением интенсивности перекисного окисления липидов (ПОЛ) и, между показателями обнаружена высокая положительная коррелятивная зависимость. В то же время протезирование из металлов переменной валентности во второй группе больных, даже при их минимальном вымывании в ротовую жидкость может привести к изменению активности ферментов. Ферменты антиокислительной системы содержат в своем активном центре металлы переменной валентности и появление в ротовой жидкости конкурентоспособных активных металлов, возможно, и явилось причиной сдвига АПА.
В активном центре СОД содержится цинк и медь, которые по своей химической активности значительно отличаются от металлов переменной валентности. Следовательно, среди изученных параметров антиокислительной системы, изменения АПА ротовой жидкости более выраженные.
В третьей группе больных в ротовой жидкости наблюдалось снижение активности ферментов АОС (табл. 1). В результате протезирования металлокерамическими зубными протезами наблюдалось снижение активности ферментов, составляющих суммарную антиокислительную активность, соразмерно снижению интенсивности ПОЛ. Обнаружено, что при протезировании металлокерамическим материалом снижение суммарной АПА более выражено, чем при протезировании только сталью. Аналогичная тенденция обнаружена при изучении активности СОД. Следовательно, процесс адаптации к зубному протезированию сопровождается снижением активности ферментов АОС в ранние сроки после сдачи зубных протезов. В последующие сроки процесса адаптации к пользованию зубными протезами отмечалось восстановление активности ферментов АОС.
Обнаруженное снижение накопления свободного МДА, а также подверженности к переокислению под влиянием индукторов, сопровождалось увеличением содержания промежуточного продукта липопереокисления – ацилгидроперекись (АГП). До протезирования у больных второй и третьей группы обнаружено одинаковое увеличение содержания АГП в ротовой жидкости, которое превышало уровень контроля в 1,75-2,35 раза. Во второй группе пациентов содержание АГП в ротовой жидкости было значительным, и после сдачи протезов снижалось. К 28 дню пользования зубными протезами содержание АГП в ротовой жидкости данной группы больных в 1,2 раза превышало показатель контроля, что было в пределах статистически недостоверности. В отличие от второй группы, в третьей группе пациентов снижение содержания АГП мен-ее интенсивное, и к концу периода адаптации сохранялось в 1,7 раза выше аналогичного показателя контроля (табл. 2).
Таблица 1. Состояние антиокислительной системы в ротовой жидкости больных в динамике адаптации к зубным протезам
 \
\
Примечание: здесь и далее * - достоверность отличий аналогичного показателя больных и лиц с контрольной группы Р<0,05.
Таблица 2. Содержание общего белка и ацилгидроперекисей в ротовой жидкости больных в динамике адаптации к зубным протезам
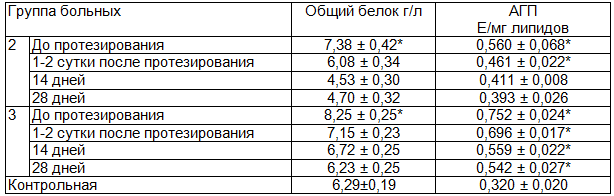
Необходимо отметить, что у больных 2 и 3 групп обнаружено увеличение содержания белка в ротовой жидкости в первые сутки после протезирования, что соответствует данным литературы [3]. Известно, что увеличение содержания белка в ротовой жидкости характерно для интенсивно протекающего процесса воспаления и нарушении целостности мембран слизистой оболочки полости рта [9].
Выводы. 1. У больных с вторичной частичной адентией исходный уровень ПОЛ значительно выше, чем аналогичный показатель у лиц с интактным зубным рядом.
- В результате протезирования из нержавеющей стали и металлокерамики, наблюдается снижение вымывания белка с ротовой жидкостью, уменьшается содержания АГП.
- В процессе адаптации к зубным протезам наблюдалось значительное снижение активности ферментов антиоксидантной системы, которая к 28 дню наблюдения не достигала исходного уровня.
