По данным Всемирной организации здравоохранения в мире живёт около 80 млн. людей, которые не имеют зубов и при этом не пользуются стоматологическими протезами. Учитывая общую динамику увеличения процента пожилого населения, предполагается также дальнейший рост этого значения [10].
Современная стоматология располагает большим выбором методов и технологий для лечения полной и частичной адентии. В последние годы благодаря применению новых имплантационных технологий в лечении вторичной адентии и часто сопутствующей ей атрофии костной ткани альвеолярного отростка достигнуты значительные успехи [2, 7].
Разработка таких методик - как увеличение объёма альвеолярных гребней, синуслифтинг, транспозиция и латерализация нижнечелюстного нерва -позволила улучшать предимплантационную картину [5, 6]. Особый интерес вызывает использование комбинации аутокости и костезамещающих препаратов, а также стимуляторов остеосинтеза, так как в этом случае предполагается достичь максимальной эффективности при восполнении дефекта костной ткани. Однако проблема взаимоотношения тканей клеточных элементов и структур костной ткани с материалами, применяемыми для восполнения дефектов кости, является одной из основных в клинике ортопедической стоматологии [1].
Сама подготовка протезного ложа сопровождаются неизбежным повреждением и удалением костной ткани в области операции. Успех восстановительного хирургического лечения в итоге во многом определяют процессы репаративной регенерации костной ткани челюстно-лицевой области пациента [11].
Несмотря на большое количество исследований, в специальной литературе недостаточно сведений о характере и типе остеоинтеграции в зависимости от применяемого имплантата [8], существуют большие сложности с оценкой в клинике состояния параимплантатной костной ткани, а также сроков ее дифференцировки. Мало данных об особенностях ведения послеоперационного периода. Почти нет сведений об особенностях и различиях в механизмах остеоинтеграции при непосредственной и отсроченной имплантации [9, 4].
Представляется, что сопоставление морфо-функциональных изменений, возникающих в костной ткани при имплантации с различной нагрузкой на костное ложе имплантата (различную степень его разрушения), а также при использовании комбинации аутотрансплантата и препарата ксенотрансплантата с изолирующими мембранами, позволит установить оптимальный вариант их комплексного использования [3].
Поэтому изучение и совершенствование методик лечения дефектов зубных рядов остаётся актуальным как с научной, так и практической точек зрения.
Обоснование выбора оптимальной имплантационной методики их последовательности или комбинации на основе наиболее распространённых, востребованных и перспективных материалов было положено в основу нашего эксперимента.
Цель исследования – установление в эксперименте оптимального варианта применения имплантационных методик на основании изучения морфологических изменений в костной ткани нижней челюсти при адентии по состоянию на 30, 90 и 180 сутки. Для определения дальнейшей целесообразности применения этих способов в клинике.
Материалы и методы. Для решения поставленных в работе задач были проведены экспериментальные исследования на 120 кроликах самцах и самках, в возрасте 4-5 недель массой от 1,5 кг и до 3,0 кг (в начале эксперимента), содержащихся на стандартном рационе питания. Все животные были разделены на 3 экспериментальные группы.
I часть эксперимента. Мы исследовали влияние фактора дополнительной ранней динамической нагрузки на имплантационное ложе непосредственно в процессе его формирования. Исследовалась костная ткань нижней челюсти вокруг моделей титановых дентальных имплантатов у 48 животных, которые вошли в I часть эксперимента.
Для этого под общим наркозом при помощи наружного доступа (через кожные покровы) к основанию нижней челюсти делался разрез, отслаивалась надкостница. Раскрывалось операционное поле площадью 1,5 см2 в области корней нижних резцов правой половины нижней челюсти. Под водяным охлаждением на низких оборотах при помощи понижающего стоматологического наконечника с шаровидной фрезой диаметром 0,5мм была пройдена кортикальная пластинка. Далее цилиндрическими фрезами были сформированы при помощи шаблонов исходные ложа имплантата в костной ткани глубиной 5 мм разного диаметра у каждого экспериментального животного по 1.
Далее, у всех животных при помощи набора титановых долот диаметром от 1,5 мм до 3,5 мм было сформировано окончательное ложе имплантата диаметром 3,5 мм. Этот способ формирования ложа был выбран для создания первичной нагрузки, как фактора влияющего на регенерацию костной ткани. При формировании имплантационного ложа в разных подгруппах экспериментальных животных отличался объём костной ткани, которую сжимали при помощи долот, чтобы установить модели имплантатов.
Операционная рана была ушита хирургической шёлковой нитью. Наложенные операционные швы сняты через неделю. Животных выводили из эксперимента через 1, 3, 6 месяцев.
Сжатие костной ткани от первичных диаметров для создания окончательного имплантационного ложа в 4 группах СОСТАВИЛО:
- группа сжатие от диаметра ложа 0,5 мм до 3,5 мм составило 3 мм. 85,7 %;
- группа сжатие от диаметра ложа 1,5 мм до 3,5 мм составило 2 мм. 57,1%;
- группа сжатие от диаметра ложа 2,5 мм до 3,5 мм составило 1 мм. 28,57%;
- группа без сжатия от диаметра ложа 3,5 мм до 3,5 мм составило 0 мм. 0% (то есть модель установили, не нагружая окружающую костную ткань).
Морфологическая оценка включала в себя изучение общего гистологического строения костной ткани нижней челюсти вокруг трансплантата. Наряду с этим проводилась морфометрическое исследование костной ткани с оценкой:
II часть эксперимента. Исследовалось влияние костезамещающего препарата «Bio-Oss», в различном соотношении с аутокостью на морфологическое состояние костной ткни у 36 подопытных.
Предоперационная подготовка и начальная часть операции (до формирования ложа) были подобны I части.
Далее цилиндрическими фрезами было сформировано ложе трансплантата диаметром 5мм и глубиной 2,5 мм, полусферической формы. У всех экспериментальных животных по 1 дефекту.
В процессе формирования ложа трансплантата извлекался фрагмент кортикальной аутокости экспериментального животного, который использовался при создании смеси с препаратом ксеноткани «Bio-Oss».
Фрагмент аутотрансплантата измельчался. Затем на мерной площадке предметного стекла с делениями 10х10 мм с шагом по 1мм определялся необходимый объём аутотрансплантата и препарата ксеноткани «Bio-Oss».
Смесь готовилась в объёмных пропорциях аутотрансплантата и препарата ксеноткани, смешивалась с кровью из раны.
В ходе эксперимента «смесь» вводили животным однократно, участок операции закрывался колагеновой рассасывающейся мембраной «Bio-Gide» в форме квадрата площадью 1см2. Мембрана фиксировалась к кости по краям ложа 4 пинами для удержания и изоляции смеси от окружающей среды. Дальнейшие манипуляции с экспериментальными животными проводили как в I части эксперимента.
Были сформированы 3 группы подопытных:
- группа Соотношение аутотрансплантата и препарата ксеноткани «Bio-Oss» 50/50%;
- группа Соотношение аутотрансплантата и препарата ксеноткани «Bio-Oss» 25/75%;
- группа Соотношение аутотрансплантата и препарата ксеноткани «Bio-Oss» (100 % костезамещающий).
Определялась эффективность использования разного соотношения аутокости экспериментального животного в смеси с костезамещающим препаратом «Bio-Oss»при заполнении стандартного дефекта.
III часть эксперимента. Исследовалось влияние плотности фиксации изолирующей мембраны «Bio – Gide» на сроки и качество регенерации костной ткани у 36 кроликов которые вошли в III часть эксперимента.
Смесь готовилась в объёмных пропорциях аутотрансплантата и препарата ксеноткани, смешивалась с кровью из раны 50 % аутотрансплантата и 50 % препарата ксенотрансплантата «Bio-Oss», закрывали мембраной «Bio-Gide», используя разные варианты фиксации её к краям ложа.
В ходе эксперимента «смесь» вводили животным однократно, участок операции закрывался колагеновой рассасывающейся мембраной «Bio-Gide» в форме квадрата площадью 1см2. Мембрана фиксировалась различными способами.
При первом способе мембрану «Bio-Gide» пришивали кетгутом к надкостнице окружавшей ложе трансплантата.
Во втором способе, для фиксации использовали 2 пина прикрепляя мембрану по диагонали 2х сторон за границей ложа трансплантата.
В третьем способе использовали 4 пина закрепляя все края мембраны.
Дальнейшие манипуляции с экспериментальными животными проводили как в I части эксперимента.
Животных выводили из эксперимента воздушной эмболией. Нижнюю челюсть вычленяли, фиксировали в 10% растворе нейтрального формалина, декальцинировали в 1% растворе охлажденного Трилона-В, обезвоживали в серии спиртов, выдерживали в ксилоле и заливали в парафин. Парафиновые срезы, толщиной 5-7 мкм. окрашивали гематоксилином и эозином, пикрофуксином по ван-Гизону. Морфологическая оценка включала в себя изучение общего гистологического строения костной ткани нижней челюсти вокруг имплантата. Наряду с этим проводилась морфометрическое исследование костной ткани с оценкой следующего показателя.
Объемная плотность костной ткани в области дефекта (в %)
Данный гистоморфометрический критерий позволяет дать относительно полную характеристику трансформации костной ткани на протяжении периода эксперимента.
Был проведён статистический анализ. Характер распределения во всех группах отличался от нормального, что обусловило необходимость воспользоваться непараметрическими методами для принятия или отрицания так называемой нулевой гипотезы при сравнении между группами. В пользу данного выбора свидетельствовало следующее: во-первых – малая численность групп, во-вторых, при анализе числовых данных каждой группы их среднее значение, медиана и мода не совпадали, что свидетельствовало об асимметричности распределения. И наконец, тесты Колмогорова-Смирнова и Шапиро-Уилка, также свидетельствовали о несоответствии имеющихся выборок нормальному закону распределения.
Достоверность различий между группами с независимыми количественными показателями определялась при помощи критерия Манна-Уитни (U) как непараметрического критерия для независимых групп.
Статистическая обработка полученных результатов производилась при помощи программ «Microsoft Excel» «Statistica 7», «SPSS 17.0 for Windows».
Результаты и обсуждение
Макроскопическое исследование всех препаратов I части эксперимента нижней челюсти в указанные сроки показало отсутствие в них патологических изменений воспалительного характера. Случаев расхождения операционных швов или отторжения моделей имплантатов мы не регистрировали, все они сохранили стабильность положения на всём протяжении эксперимента.
В ранние сроки в краевых зонах костного спила всех групп присутствовало выраженное острое воспаление с некрозом и рассасыванием костной ткани, обильно инфильтрированной нейтрофилами что, видимо, является реакцией на прямую механическую и термическую травму кости при создании дефекта стоматологическим фрезой.
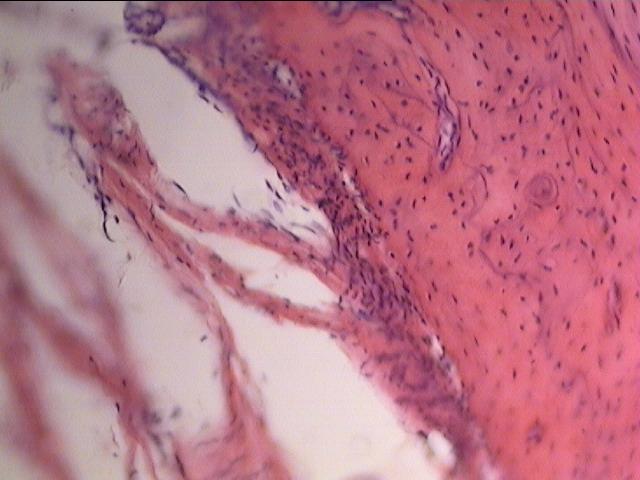
Анализируя полученные поздние данные, можно отметить, что формирование имплантационного ложа с диаметром исходного отверстия 3,5 мм с последующим внедрением титанового имплантата является неблагоприятным для регенерации костной ткани (рис. 1). Отсутствует плотный микроконтакт между поверхностью модели имплантата и имплантационным ложем, тогда как у экспериментальных животных с исходным имплантационным ложем диаметром 2,5 мм показатели регенерации наиболее выраженные, что объективно свидетельствует о наиболее благоприятных условиях восстановления участка кости при такого рода оперативном вмешательстве (рис. 2).
 |
 |
| Рис. 1. Микроскопическое строение костной ткани нижней челюсти на 180 сутки эксперимента подопытного животного с диаметром исходного имплантационного ложа 3,5 мм (окраска гематоксилин - эозином. Увеличение х 200). | Рис. 2. Микроскопическое строение костной ткани нижней челюсти на 90 сутки эксперимента подопытного животного с диаметром исходного имплантационного ложа 2,5 мм (окраска гематоксилин - эозином. Увеличение х 200). |
Наиболее однообразные изменения в исследуемых группах установлены со стороны размеров гаверсовых каналов, площадь которых численно возрастала от 1 го к 6 ому месяцу исследования, за исключением образцов с исходным отверстием 3,5 мм. Образование костной ткани там происходило медленнее, чем образование соединительной ткани. Соответственно, в зоне контакта поверхности модели имплантата и ложа преобладала фиброзная ткань не замещавшая костную ткань.
Это способствует нормальному оттоку экссудата из воспалительного инфильтрата, возникающего как ответ на прямую механическую и термическую травму костной ткани, что стимулирует процесс утилизации и преобразования разрушенной костной ткани. Также умеренное давление на костную ткань способствует быстрой фиброзно-костной регенерации вокруг титанового имплантата.
Таблица 1. Показатели объемной плотности костной ткани нижней челюсти
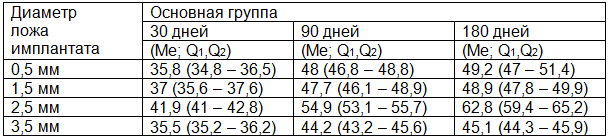
При анализе данных табл. 1 прослеживается преимущество показателей объемной плотности в группе с исходным ложем 2,5 мм во все сроки наблюдения, что подтверждает наиболее благоприятную морфологическую динамику восстановления костной ткани в этой группе.
Эксперимент показал высокую пластичность костной ткани и благоприятную динамику регенераторных процессов при правильном подборе конструкции титанового имплантата и диаметра исходного отверстия имплантационного ложа, а также целесообразность ранней динамической нагрузки имплантационного ложа в разумных пределах.
Во всех группах животных II части эксперимента макроскопически дефекты выражено не пальпировались, швы были заживлены, по краям раны признаков воспаления не наблюдалось.
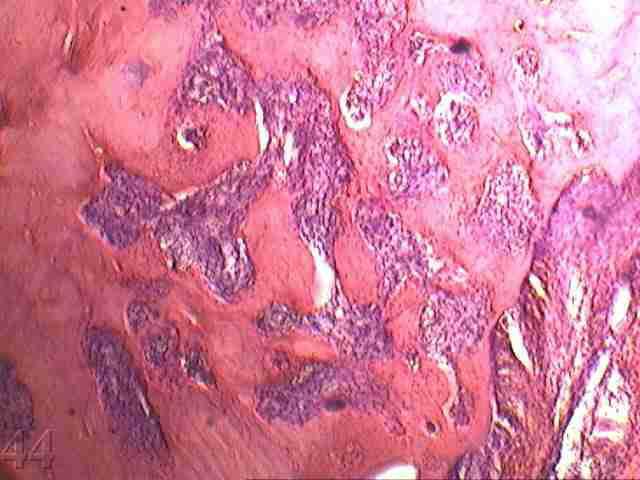
Морфологическое исследование показало формирование фиброзной ткани в зоне трансплантации с последующей перестройкой в костную ткань в более поздние сроки (рис. 3). Прорастание грануляционной ткани в ранние сроки в операционном участке, и восстановление трофики у фрагментов аутотрансплантата в составе смеси, видимо обеспечило более благоприятную динамику восстановления костной ткани в экспериментальных группах с аутокостью.
Суммируя полученные данные, следует отметить, что наиболее выраженное формирование костной ткани отмечается при замещении костного дефекта материалом состоящим на 50 % из аутотрансплантата и на 50 % препарата ксенотрансплантата «Bio-Oss» - объёмная плотность костной ткани составила 64,5 (%). В остальных подгруппах масса костной ткани заметно ниже.
Таблица 2. Показатели объемной плотности костной ткани нижней челюсти
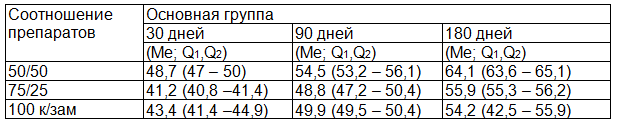
При анализе данных табл. 2 подтверждаются результаты морфологического наблюдения. В экспериментальной группе с соотношением аутокости и костезамещающего препарата 1:1 плотность костной ткани в динамике была выше чем в остальных группах.
Выявленные патоморфологические и морфометрические особенности остеорепарации нижней челюсти в эксперименте при применении аутокости и костезамещающего препарата «Bio-Oss» с различными исходными соотношениями и в различные сроки, показали, что большее исходное соотношение аутокости над костезамещающим препаратом влияет на преобладание регенеративных процессов, над реорганизационными. Преобладание в смеси костезамещающего препарата ведёт к большей активности остеокластов в более ранние сроки, что способствует ранней реорганизации и утилизации костезамещающего препарата. Так равное соотношение способствует быстрой фиброзно-костной регенерации. Эксперимент также показал, что костная ткань является перспективным материалом в отношении регенерации при правильном подборе смеси аутокости и костезамещающего препарата.
Во всех группах животных III части эксперимента макроскопически дефекты выражено не пальпировались, швы были заживлены, по краям раны признаков воспаления не наблюдалось.
Во всех группах формирование костной ткани в краях дефекта сопровождалось наличием процессов вторичного остеолиза в более глубоких отделах кости челюсти в ответ на воспаление в зоне травмирования и регенерации кости, проявляющееся развитием процессов ремоделирования зрелой кости челюсти с одновременно протекающим остеолизом и остеосинтезом (рис. 4).
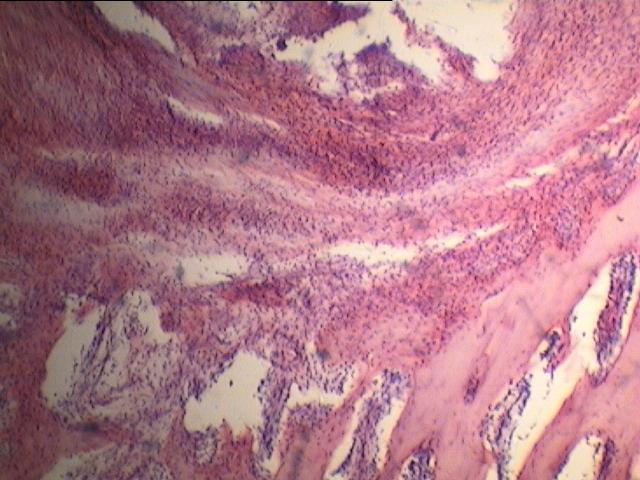 |
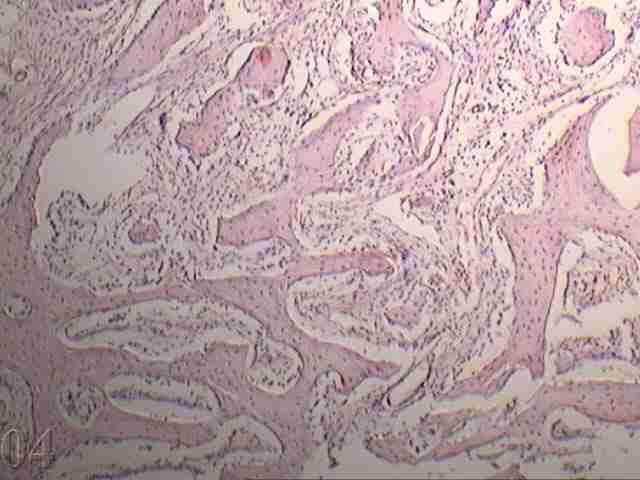 |
| Рис.3. Микроскопическое строение костной ткани нижней челюсти на 30 сутки эксперимента подопытного животного с ложа трансплантата заполненным костезамещающим препаратом «Bio-Oss» 100% (окраска гематоксилин - эозином. Увеличение х 160). | Рис. 4. Микроскопическое строение костной ткани нижней челюсти на 30 сутки эксперимента подопытного животного с соотношением в смеси аутокости и костезамещающего препарата «Bio-Oss» 50/50% при заполнении трансплантационного ложа и фиксации изолирующей мембраны «Bio-Gide» кетгутовыми швами (окраска гематоксилин - эозином. Увеличение х 160). |
Таблица 3. Показатели объемной плотности костной ткани нижней челюсти
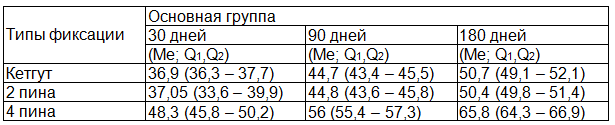
Суммируя полученные данные относительно 3-х основных групп можно отметить, что наиболее оптимальная динамика восстановления костной ткани наблюдается при замещении костного дефекта смесью аутокости и костезамещающего препарата «Bio-Oss» в соотношении 50/50 %, а так же при фиксации к краям дефекта покрывающей мембраны 4 пинами.
При анализе данных таблицы № 3 можно отметить снижение показателей объёмной плотности в экспериментальных группах с кетгутом и фиксацией мембранами 2 пинами в сроки наблюдения 30, 90 дней.
Наибольшее снижение показателей было в ранние сроки. По данным таблицы прослеживается положительная динамика восстановления плотности костной ткани во всех экспериментальных группах. В группе с 4 пинами показатель объёмной плотности был значительно выше во все сроки наблюдения и продемонстрировал наиболее благоприятную динамику роста среди всех экспериментальных групп. Плотное прикрепление изолирующей мембраны обеспечило более высокие и стабильные показатели в костном дефекте как морфологически так и морфометрически.
Заключение. Представленные результаты динамики заживления травматического костного дефекта нижней челюсти позволяют констатировать факт формирования органотипичного костного регенерата в условиях применения комбинации препаратов ксенотрансплантатов и аутотрансплантатов.
В челюстно-лицевой хирургии рядом авторов отмечен положительный эффект от использования ранней динамической нагрузки имплантационного ложа. Полученные нами результаты исследования подтверждают оправданность её применения в процессе лечения воспалительно-деструктивных процессов в зубочелюстном аппарате, делают перспективными дальнейшие исследования химических и биологических свойств комбинации препаратов ксенотрансплантатов и аутотрансплантатов.
- При изменении диаметра исходного имплантационного ложа в пределах 0,5-3,5 мм (85,7-0 %) получены результаты.
А) При изменении диаметра исходного имплантационного ложа до 0,5 мм (85,7%). При большом сжатии наблюдаются неблагоприятные морфологические процессы. Ишемия сосудов, преобладание дистрофических процессов. Показатели коэффициентов объёмной плотности, активного роста и резорбции резко снижены. Повышается риск разрушения целостности костной структуры ложа.
Б) При изменении диаметра исходного имплантационного ложа до 1,5 мм (57,1%). Деструктивные процессы преобладали над регенерационными. Наблюдаем изменение показателей коэффициентов активного роста и резорбции в сторону снижения активности клеточного компонента костной ткани.
В) При изменении диаметра исходного имплантационного ложа до 2,5 мм (28,57%) оптимальный результат даёт относительно небольшая компрессия имплантационного ложа. Что является компромиссом между условиями первичной стабильности, сохранением трофики, и течением регенерационных процессов.
Г) При изменении диаметра исходного имплантационного ложа до 3,5 мм (0 %) обуславливается отсутствием сжатия, первичная стабильность и регенерационные процессы менее выражены.
- Морфологически выявлено, что ранняя динамическая нагрузка на имплантационное ложе не ухудшает регенерацию и реорганизацию костной ткани.
- Изучение и оценка морфологических состояний в костной ткани при использовании различных соотношений аутокости и костезамещающего препарата «Bio-Oss» показала, что использование смеси аутокости и костезамещающего препарата «Bio-Oss» в соотношении 1:1 ускоряет процессы пролиферации соединительно-тканных клеточных элементов в эксперименте.
- Оценка влияния на регенерацию костной ткани у экспериментальных особей дополнительно к введению ксенотканей фактора - различного варианта прикрепления изолирующей коллагеновой мембраны «Bio-Gide», показала, что наиболее оптимальная динамика восстановления костной ткани имеет место при замещении костного дефекта смесью аутокости и костезамещающего препарата «Bio-Oss» в соотношении 50/50%, а так же при фиксации к краям дефекта покрывающей мембраны 4 пинами.
При использовании малого количества фиксирующих элементов:
2 пина не достигнута изоляция и герметичность операционного участка, что было подтверждено морфологически.
При использовании шовного материала (кетгута) не достигнут результат сопоставимый с 4 пинами, но эффективнее чем при применении 2х пинов.
- 1. Основную роль в процессах формирования остеоинтеграции, и регенерации костной ткани играют площадь контакта и нагрузка на имплантационное ложе.
- Увеличение площади контакта за счёт перегрузки имплантационного ложа не даёт значимых положительных результатов в регенерации костной ткани.
На основании проведённых нами исследований мы можем рекомендовать:
В клинических исследованиях для дальнейшего изучения морфологических процессов имплантации рекомендуем формировать ложе имплантата на (нижней челюсти) для достижения первичной стабильности имплантата и осуществления ранней динамической нагрузки на костную ткань оптимальным диаметром ложа около 25-30 % от исходного диаметра имплантата. Что является компромиссом между условиями первичной стабильности, сохранением трофики, и течением регенерационных процессов. Максимальное сохранение аутокости имплантационного ложа и минимальный объём вмешательства благоприятно сказывается на морфологии регенерационных процессов.
При достижении первичной стабильности имплантата возможно применение ранней динамической нагрузки на имплантационное ложе за счёт его компрессии.
Оптимальное для использования соотношение смеси аутокости и костезамещающих препаратов 1:1 (аналогичных препарату «Bio-Oss»).
Лучшим вариантом прикрепления изолирующих мембран, определено наиболее приемлемое количество фиксирующих элементов обеспечивающих плотное прилегание и стабильность мембраны. В нашем эксперименте это были - как минимум 4 пина.
