Достигнутые на сегодняшний день успехи в лечении патологии прикуса с использованием ортодонтической техники позволяют значительно расширить показания к ее применению. Накоплен богатый клинический опыт в достижении функционального и эстетического эффектов у взрослых пациентов, отягощённых хроническими воспалительными заболеваниями пародонта, в том числе сопровождающихся деструктивными поражениями. Тем не менее, исследования ряда авторов свидетельствуют о росте процента осложнений ортодонтического лечения, наиболее частым из которых являются обострение хронических воспалительных заболеваний пародонта (ХВЗП) [1,9,17]. Своеобразной зоной риска обострения ХВЗП являются те участки зубного ряда, к которым применяется силовое воздействие. Ортодонтические конструкции изменяют рельеф зубного ряда, значительно увеличивают потенциальную площадь возможной адгезии микроорганизмов [16], затрудняют удаление зубного налёта [6,12,15], что побуждает к поиску информативных критериев мониторирования течения хронического инфекционно-воспалительного процесса в полости рта в условиях перманентно действующих нагрузок.
Известно, что биотопы полости рта представляют собой наиболее контаминированные области человеческого организма, отличающиеся качественным и количественным разнообразием [4,10]. При этом патогенность максимально проявляется при наличии зубной бляшки - многовидового сообщества микроорганизмов, располагающихся на поверхности зубов в виде биоплёнки [18]. Биоплёнки обладают высоким уровнем толерантности к антисептикам и фагоцитам [2,13,14]. Литературные источники свидетельствуют о том, что при неудовлетворительной гигиене полости рта у ортодонтических пациентов увеличивается концентрация грибковой флоры (дрожжей и грибов рода Candida) относительно нормальной микрофлоры полости рта [5]. Так, Павловская Я.В. и соавт. (2013) определяли качественный и количественный состав пародонтопатогенной микрофлоры у пациентов, нуждающихся в ортодонтическом лечении, с помощью молекулярно-генетического метода полимеразной цепной реакции (ПЦР). Носительство пародонтопатогенных штаммов установлено авторами у 73% обследованных, из них 23% нуждающихся в ортодонтическом лечении относятся к группе риска развития пародонтита [8]. Однако нами не найдено сведений о динамике качественных и количественных сдвигов микробного пейзажа в процессе ортодонтического лечения, что и определило цель настоящего исследования.
Материал и методы исследования. В исследовании приняли участие 54 пациента (15 мужчин и 39 женщин, исследуемая группа) в возрасте от 18 до 36 лет, проходящих ортодонтическое лечение с использованием несъёмных конструкций (эджуайз-техника). У всех пациентов исследуемой группы было диагностировано скученное положение передних зубов верхней и нижней челюсти. Было проведено ранжирование пациентов исследуемой группы на три подгруппы (по признаку отягощённости воспалительными заболеваниями пародонта): первая подгруппа-пациенты с интактным пародонтом (n=18), вторая - пациенты с хроническим генерализованным гингивитом (n=20), третья - с хроническим генерализованным пародонтитом лёгкого течения (n=16). Критериями включения пациентов в исследуемую группу служили: подтверждённый диагноз зубочелюстной аномалии (на основании данных клинического, рентгенологического исследований, диагностических моделей челюстей), отсутствие эндокринологической/соматической отягощённости; отрицание в анамнезе факта приёма лекарственных препаратов, биологически активных добавок, пробиотиков, зубных паст, содержащих антибактериальные добавки; согласие на участие в исследовании. Группу сравнения составили 47 пациентов, сопоставимых по гендерно-возрастному составу, отягощённости ортодонтической патологией, хроническими воспалительными заболеваниями пародонта, которым не проводилось ортодонтическое лечение. Все пациенты группы сравнения также были ранжированы на 3 подгруппы по упомянутому выше принципу: в первую подгруппу вошли 14 пациентов, во вторую - 16 пациентов, в третью - 17 пациентов. Все пациенты исследуемой группы и группы сравнения подтвердили своё согласие на участие в исследовании.
Для верификации пародонтологического диагноза был использован комплекс клинических и рентгенологического методов исследования. Оценка состояния полости рта и тканей пародонта была проведена с помощью гигиенических (Грина - Вермильона) и пародонтологических (пародонтологический индекс (ПИ) по Расселу, индекс кровоточивости по Мюллеману-Коуэллу) индексов. Для определения степени микробной обсеменённости материал забирали натощак или через 3-4 ч после приёма пищи. В день забора материала на исследование пациенту необходимо воздержаться от чистки зубов, применения лекарственных препаратов и полоскания полости рта эликсирами либо ополаскивателями, содержащими антисептические компоненты растительного / химического происхождения.
Материал для исследования получали с пришеечной области зубов в области ортодонтической конструкции, десневой борозды/ пародонтального кармана с помощью стерильных бумажных эндодонтических штифтов (размер №25), которые затем помещали в пробирку с транспортной средой и доставляли в отделение микробиологии ФБУН «Казанский научно-исследовательский институт эпидемиологии и микробиологии» Роспотребнадзора (зав. - к.м.н. Баязитова Л.Т.). Забор материала осуществлялся трёхкратно: на этапе диагностики, через 3-4 недели, 3 и 6 месяцев после фиксации несъёмной ортодонтической техники, в начале ретенционного периода. Перед фиксацией элементов конструкции все пациенты, отягощённые воспалительными заболеваниями пародонта, прошли курс пародонтологического лечения. Биоматериал высевался на плотные и полужидкие питательные среды для культивирования микроорганизмов в аэробных и анаэробных условиях. Применяли 5% кровяной агар, среду Сабуро, стрептококковый селективный агар, желточно-солевой агар, тиогликолевую среду, среда de Man, Rogosa, Sharpe (MRS) агар, среду Блаурокка. Идентификацию выделенных микроорганизмов осуществляли общепринятыми методами с учетом морфологических, культуральных и биохимических свойств.
Для определения степени микробной контаминации изучаемых биотопов пародонтопатогенными штаммами использовали метод ПЦР-диагностики. Маркёрные пародонтопатогенные виды бактерий Actinobacillus actinomycetemcomitans, Prevotella intermedia, Treponema denticola, Porphyromonas gingivalis, Tannerella forsythensis (Bacteroides forsythus) выявляли с помощью набора реактивов “Мультидент-5”, разработанного ООО «НПФ Генлаб» (Россия) с помощью ПЦР и электрофореза в 1,6 % агарозном геле; тест-системы Micro DentR (“Hain Diagnostica”, Германия), позволяющей проводить мультиплексную ПЦР с последующей регистрацией синтезированных ампликонов методом обратной гибридизации.
Для статистической обработки использовался пакет программ Statistical Package for Social Science (SPSS) - Статистический пакет для социальных наук 13.0. Для проверки нормальности распределений использовался критерий Стьюдента, различия считали достоверными при р<0,05.
Результаты и обсуждение. Данные, полученные при оценке гигиенического статуса пациентов исследуемой группы с интактным пародонтом, свидетельствуют о достоверном возрастании гигиенических индексов на этапах наблюдения. Так, спустя 3-4 недели после фиксации ортодонтической техники индекс Грина-Вермильона возрастал с 0,4±0,1 балла до 2,2±0,3 балла (p<0,05), спустя 3 месяца прирост его был незначительным - до 2,6±0,5 балла (p>0,05). Через 6 месяцев после фиксации значения индекса становились достоверно ниже и достигали 1,8±0,3 балла (p<0,05). К началу ретенционного периода существенной динамики в гигиеническом состоянии выявлено не было. ПИ по Расселу и индекс кровоточивости по Мюллеману-Коуэллу существенных значений достигали на сроке 3-4 недели и составили 1,4±0,2 балла (p<0,05) и 1,8±0,4 балла (p<0,05). Активность воспалительного процесса в тканях пародонта сохранялась на указанном уровне до 3 месяцев. Спустя 6 мес. значения индексов уменьшились 0,4±0,1 балла (p<0,05) и 0,8±0,2 балла (p<0,05) соответственно.
Наиболее выраженная динамика гигиенических и пародонтологических индексов наблюдалась у пациентов, отягощённых хроническими воспалительными заболеваниями пародонта. Так, у пациентов с гингивитом индекс Грина-Вермильона возрастал с 1,8±0,5 балла до 2,7±0,8 балла (p<0,01) через 3-4 недели после фиксации брекетов, спустя 3 месяца прироста практически не наблюдалось, а к 6-ому месяцу гигиеническое состояние улучшилось: 1,2±0,3 балла (p<0,05), сохраняясь на этом уровне до начала ретенционного периода. Аналогична динамика пародонтологических индексов в данной подгруппе. Наибольший прирост ПИ по Расселу и индекс Мюллемана-Коуэлла зарегистрирован на сроке 3-4 недели - 2,2±0,4 балла (p<0,05) и 2,6±0,7 балла (p<0,05) соответственно. На сроке 3 месяца после фиксации брекетов состояние тканей пародонта не претерпевало существенных изменений. Отметим, что к 6 месяцу выраженность воспаления и интенсивность кровоточивости снижаются и к началу ретенционного периода достигали 1,0±0,2 балла (p<0,05) и 1,3±0,3 балла (p<0,05) соответственно.
У пациентов с хроническим генерализованным пародонтитом наибольший подъём значений индекса Грина-Вермильона наблюдался начиная с 3-4 недели после фиксации брекетов: 4,2±1,2 балла (p<0,05) и сохранялся практически на данном уровне до 6 месяца. К началу ретенционного периода гигиеническое состояние улучшалось: 3,1±1,0 балла (p<0,05). Максимальные значения пародонтологических индексов имели место также на этапе 3-4 недели: ПИ по Расселу составил 4,3±0,9 балла (p<0,05), индекс Мюллемана-Коуэлла - 2,9±0,8 балла (p<0,05). Наблюдение на этапах 3 месяца и 6 месяцев не выявило существенной динамики. Улучшение состояния тканей пародонта определялось лишь на ранних сроках ретенционного периода. Активность воспалительного процесса снижалась до 3,1±0,5 балла (p>0,05), интенсивность кровоточивости - до 1,8±0, балла (p<0,05).
Данные, полученные в ходе изучения степени контаминации бактериальной и пародонтопатогенной микрофлорой десневой борозды и пародонтального кармана, выраженные в колониеобразующих единицах (КОЕ) на 1 см², представлены в табл. 1.
Таблица 1. Микробный пейзаж десневой борозды и пародонтального кармана пациентов исследуемой группы
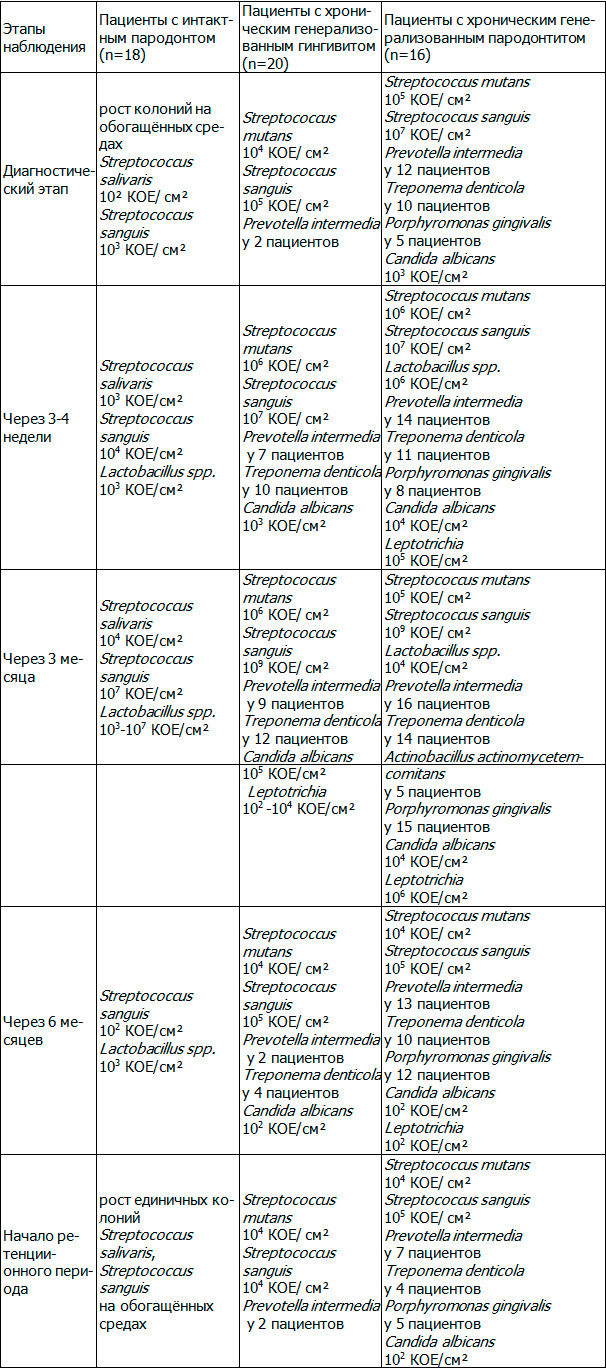
Сведения, представленные в табл. 1, свидетельствуют о том, что у пациентов с интактным пародонтом микробный пейзаж десневой борозды на этапах наблюдения изменяется незначительно в качественном отношении. Так, доминирующими микробными группами являются стрептококки и лактобациллы, причём плотность высеваемости оказалась наибольшей спустя 3-4 недели и 3 месяца после фиксации брекетов. У пациентов с хроническим генерализованным гингивитом доминирующей флорой также оказалась кокковая, однако на диагностическом этапе у 2 пациентов высевались превотеллы. Через 3-4 недели после фиксации возрастает титр кокковой флоры, изменяется качественный (видовой) состав: появляются представители грибковой флоры, возрастает число пациентов, у которых выявлены превотеллы и трепонемы. На сроке наблюдения 3 месяца разнообразие видового состава усиливается за счёт штаммов Сandida albicans и Leptotrichia, плотность высеваемости остальных бактерий возрастает. Через 6 месяцев и к началу ретенционного периода констатировано обеднение видового состава и снижение плотности высеваемости микрофлоры.
Наибольшим качественным и количественным разнообразием отличался микробный пейзаж пародонтальных карманов у пациентов с хроническим генерализованным пародонтитом на этапах наблюдения 3-4 недели и 3 месяца. Доминирующей микрофлорой на данных этапах представляется пародонтопатогенная. Кокковая и кандидозная микрофлора в данном случае аккомпанирующая. Отметим, что при сравнении особенностей микробной контаминации пришеечной области зубов, на которых зафиксированы брекеты, и пародонтальных карманов, нами были выявлены принципиальные отличия. Так, пародонтопатогенные штаммы определялись только в пародонтальных карманах, что обусловлено условиями анаэробиоза [7].
Сопоставляя сведения о гигиеническом состоянии полости рта, состоянии тканей пародонта и бактериологического статуса, можно утверждать, что период ортодонтического лечения 3-4 недели - 3 месяца можно обозначить как критический, поскольку именно на этих этапах имеет место накопление зубных отложений (преимущественно за счёт мягкого зубного налёта и зубной бляшки), усиливается активность воспалительных процессов в тканях пародонта, возрастает уровень бактериальной контаминации десневой борозды/пародонтального кармана. Полагаем, что причинами «критического периода» могут быть существенные мануальные трудности при проведении ежедневных гигиенических процедур; отметим также, что поддержание адекватного уровня гигиены межзубных промежутков технически довольно сложно (ежедневное внимание ей уделяли лишь 12% наблюдаемых нами пациентов). Полученные сведения согласуются с данными других исследователей, отмечающих, что пациенты, хорошо обученные технике чистки зубов и межзубных промежутков, со временем все меньше внимания уделяют борьбе с зубным налётом [11]. Нами выявлена положительная корреляционная зависимость между уровнем оральной гигиены и выраженностью воспалительного процесса у пациентов с хроническим катаральным гингивитом (r=0,61) и хроническим генерализованным пародонтитом (r=0,74). Имеются литературные подтверждения влияния ускоренного накопления зубного налета на элементах ортодонтических конструкций на развитие заболеваний тканей пародонта [3]. Весьма интересным представляется факт достаточно быстрой реконтаминации изучаемых биотопов после проведения профессиональной гигиены полости рта. Полагаем, что наличие ортодонтических конструкций может сократить «планктонный» период созревания биоплёнки, ускорить образование микроколоний, фиксирующихся на элементах ортодонтической дуги, которые выступают в данном случае как абиотические поверхности [8].
Таким образом, полученные нами сведения диктуют необходимость дифференцированной разработки регламента профессиональной гигиены для ортодонтических пациентов, отягощённых воспалительными заболеваниями пародонта.
