В работе профильных стационаров острые одонтогенные остеомиелиты, осложненные флегмоной челюстно-лицевой области, являются одной из наиболее тяжелых форм гнойно-воспалительной патологии. Попытки внедрения в базовые курсы ведения данных больных компонентов патогенетического лечения различной направленности, бесспорно, дают свои результаты. Десятки научных трудов, выполненных в этой области челюстно-лицевой хирургии, оказали значимое влияние в обеспечении эффективного лечения пациентов с одонтогенными флегмонами. На практике удалось добиться сокращения сроков купирования болевого, интоксикационного синдромов, репарации раны и т.д. При этом недостаточно внимания было уделено частоте хронизации исследуемой патологии и попыткам ее снижения [4, 12].
Цель исследования: оценить эффективность снижения частоты хронизации одонтогенного остеомиелита применением комплекса иммуномодуляторов Ликопид и Имунофан.
Материалы и методы исследования. В течение 2013-2015 г. выполнено клиническое и лабораторное обследование 113 пациентов обоих полов в возрасте от 20 до 60 лет с острым одонтогенным остеомиелитом, осложненным флегмоной, обратившихся за лечением в челюстно-лицевой стационар. Все пациенты были сопоставимы по возрасту и полу, продолжительности заболевания и объему гнойного поражения мягких тканей.
Хирургическое лечение являлось стандартным для всех пациентов. В зависимости от программы медикаментозной терапии больные были распределены в группы. Таким образом, была выделена группа пациентов получающих на всех этапах стандартную схему лечения (базовая терапия (БТ), количество испытуемых (n=54), и группа, в которой базовая терапия была дополнена назначением иммуномодуляторов (базовая терапия (БТ) + иммуномодулирующая терапия (ИМТ), n=59). В качестве средств иммунотропной направленности применялась комбинация препаратов Ликопид и Имунофан, назначаемая с первых суток госпитализации по 0,01 г под язык 1 раза в день (за 30 мин до завтрака) в течение 10 дней, и по 1 мл в/м 1 раз в день в течение 5 дней соответственно. Базовый объем лечения включал в себя антибактериальную, анальгетическую, дезинтоксикационную терапию, коррекцию водно-электролитного баланса. Антибактериальная терапия проводилась препаратом широкого спектра действия группы цефалоспоринов первого поколения Solution Cefazolini 1,0 в/м 3 раза в день.
Определение состояния иммунного статуса в каждом клиническом случае осуществлялось трижды. Первый забор крови производился при поступлении пациента в стационар, второй - при переходе раневого процесса из фазы воспаления в фазу регенерации, третий - спустя 45 суток со дня второго лабораторного этапа.
Исследование проводили по следующим параметрам:
- количество лейкоцитов;
- относительное количество лимфоцитов;
- абсолютное количество лимфоцитов;
- определение фагоцитарной активности лейкоцитов: % фагоцитоза, фагоцитарное число;
- СD 3 (Т - лимфоциты);
- СD 4 (Т - хелперы);
- СD 8 (Т - цитотоксические);
- ИРИ (СD 4/ СD 8) - иммунорегуляторный индекс;
- СD 19 (В - лимфоциты)
- СD 56 (NK - клетки, натуральные киллеры);
- Ig G, А, М (иммуноглобулины);
- ЦИК (циркулирующие иммунные комплексы);
- IL-2, IL-4, IL-10 (интерлейкины);
- TNF-альфа (фактор некроза опухоли).
Сравнение показателей проводилось с использованием непараметрической статистики (критерий Манна-Уитни). Критическое значение уровня статистической значимости принималось равным 0,05.
Результаты и их обсуждение. В рамках настоящего исследования, наряду с базовым объемом диагностических мероприятий при поступлении в стационар всем пациентам подгрупп исследования (n=113) был произведен первый забор крови для определения состояния иммунного статуса на момент госпитализации. Результаты проведенного на данном этапе исследования представлены в табл. 1.
Таблица 1. Иммунограмма №1, сравнение показателей иммунного статуса пациентов на момент поступления в стационар с таковыми же у здоровых доноров
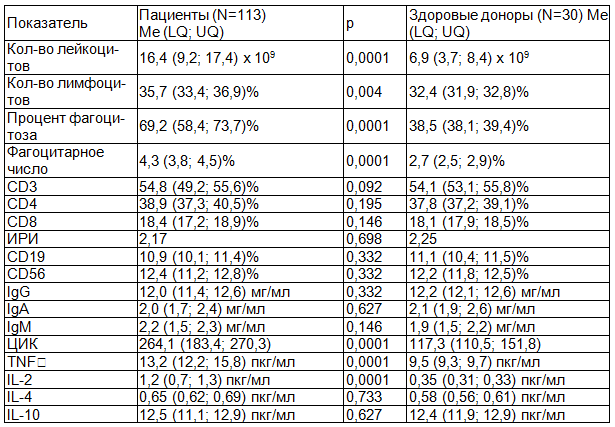
Примечание: Me - медиана; LQ, UQ - интерквартильный размах; p - статистическая значимость; мг - миллиграмм; пкг - пикограмм; мл – миллилитр.
Об инициации иммунного ответа организма на активно развивающийся гнойно-воспалительный процесс челюстно-лицевой области на данном этапе исследования свидетельствуют достоверно различные показатели фагоцитоза, количества лейкоцитов (р=0,0001), лимфоцитов (р=0,004), ЦИК (р=0,0001) и некоторых провоспалительных цитокинов (TNF-альфа (р=0,0001); IL-2 (р=0,0001)). Сравнение относительных значений концентрации всех классов иммуноглобулинов и субпопуляций лимфоцитов не демонстрирует статистической значимости (р>0,05).
Иммунологическая картина заболевания на его начальных этапах полностью укладывается в рамки ответных реакций организма на присутствие острого гнойно-воспалительного процесса. Выраженный лейкоцитоз, лимфоцитопения, активность фагоцитоза, увеличение уровня ЦИК и ряд других каскадных реакций клеточного и гуморального иммунитета являются вполне закономерными и не могут быть расценены, как проявление вторичного иммунодефицитного состояния [3, 7, 11].
После проведения операции вскрытия флегмоны стадийность заболевания на этапе фазы воспаления не демонстрировала клинических различий в группах исследования вне зависимости от присутствия иммунотропного компонента медикаментозной терапии. Статистически значимой разницы в объеме экссудации (р=0,687>0,05), выраженности болевого (р=0,215>0,05), интоксикационного синдромов (р=0,307>0,05) между пациентами групп исследования выявлено не было. Полученный опытным путем результат указывает на отсутствие симптоматического эффекта от применяемых в работе иммуномодуляторов при лечении острого гнойного поражения мягких тканей челюстно-лицевой области.
Согласно материалам и методам настоящего исследования, появление в послеоперационной ране участков пролиферативной активности ознаменовало смену фаз раневого процесса и являлось отправной точкой для проведения второго лабораторного этапа, результаты которого представлены в табл. 2.
Таблица 2. Иммунограмма №2, показатели иммунного статуса пациентов на момент начала фазы регенерации
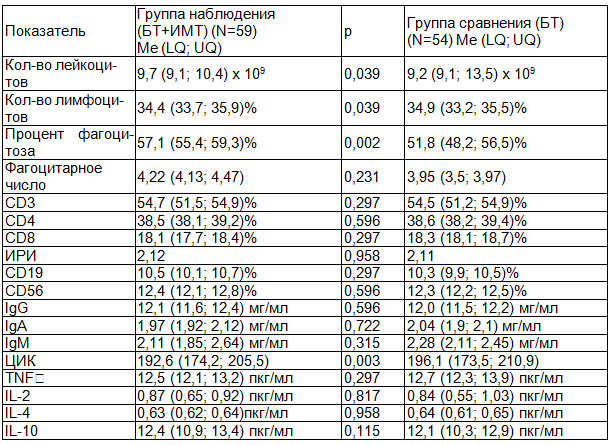
По результатам второго лабораторного этапа исследования, проводимого у пациентов группы наблюдения и сравнения при переходе раневого процесса из фазы воспаления в фазу регенерации, статистически значимые различия в иммунном ответе регистрировались в показателях процента фагоцитоза (57,1 (55,4; 59,3)% в группе БТ+ИМТ и 51,8 (48,2; 56,5)% в группе БТ; p=0,02<0,05) и уровне ЦИК (192,6 (174,2; 205,5) в группе БТ+ИМТ и 196,1 (173,5; 210,9) в группе БТ; p=0,003<0,05). Полученные результаты вполне могут быть обусловлены фармакодинамикой иммуномодулирующего компонента медикаментозной терапии. Ключевой точкой приложения для ГМДП (глюкозаминилмурамилдипептид), действующего вещества Ликопида, является макрофагально-фагоцитарное звено цепи запущенных реакций клеточного иммунитета, что главным образом проявляется в его способности к стимуляции функциональной (бактерицидной и цитотоксической) активности фагоцитов [2, 5, 8, 9]. В тоже время в течение средней фазы фармокологического действия Имунофана, начинающейся через 2-3 суток и продолжающейся до 7-10 суток со дня начала приема, помимо усиления антиоксидантной защиты организма, он оказывает стимулирующее влияние и на фагоцитарную активность нейтрофилов [10]. Достоверно отличные темпы нормализации показателей лимфоцитов (34,4 (33,7; 35,9)% в группе БТ+ИМТ и 34,9 (33,2; 35,5)% в группе БТ; p=0,039<0,05), снижения общего уровня лейкоцитов (9,7 (9,1; 10,4) х 109 в группе БТ+ИМТ и 9,2 (9,1; 13,5) х 109 в группе БТ; p=0,039<0,05) в обеих группах исследования на данном этапе свидетельствовали о начавшемся с различной интенсивностью процессе купирования разлитого острого гнойно-воспалительного процесса, что объективно сопровождалось завершением экссудативных процессов, стиханием признаков локальной и общей интоксикации.
Применение методов статистики позволило установить, что большинство лабораторных показателей не коррелировали с динамикой клинической симптоматики. На момент смены фаз раневого процесса, клиническая картина заболевания отличалась значимо большей экспрессией признаков негативного течения заболевания. Таким образом, в зависимости от исхода первого отрезка исследования, по признаку продолжающегося на фоне гранулирования раны гноетечения, все пациенты групп БТ и БТ+ИМТ были разделены на две подгруппы. Манифестная симптоматика хронизации острого инфекционного процесса регистрировалась у 14 пациентов (25,9±1,4%) группы базовой терапии и 16 больных (27,1±1,9%) группы иммуномодуляции. Полученная разница результатов не представляла статистической достоверности (p=0,29>0,05), что указывает на отсутствие ранних клинических проявлений профилактического эффекта комбинации иммуномодуляторов Ликопид и Имунофан при их включении в базовую схему медикаментозной терапии острого одонтогенного остеомиелита.
Окончательные клинические результаты исследования были подведены спустя 45 суток со дня смены фаз раневого процесса. По оценке состояния послеоперационного рубца и общей клинической картины исхода заболевания установлены статистически достоверные показатели результативности проводимой иммунотропной терапии (хи-квадрат = 5,388; СС = 2; р=0,02<0,05). В группе базового медикаментозного лечения количество случаев хронизации оказалось равным 20,37±0,21% (11 пациентов из 54), что на 11,9% превышало показатели в группе иммуномодулирующей терапии - 8,47±0,15% (5 из 59 испытуемых).
На момент подведения финальных клинических итогов был произведен заключительный забор крови для выполнения завершающего лабораторного этапа исследования. Его результаты представлены в табл. 3.
Таблица 3. Иммунограмма №3, показатели иммунного статуса пациентов спустя 45 суток с момента предыдущего лабораторного исследования
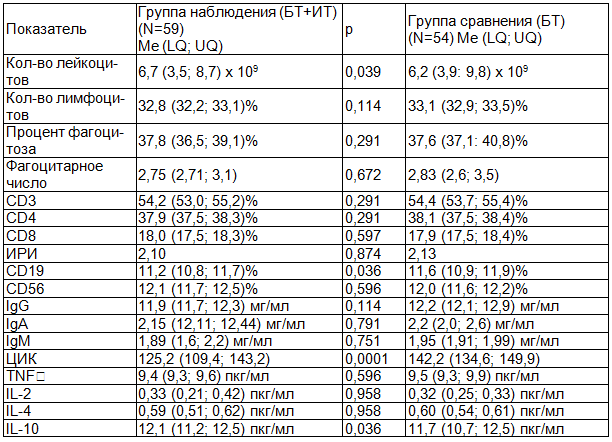
Итоговый сравнительный анализ иммунного статуса пациентов двух групп исследования на его заключительном этапе демонстрирует статистически достоверную разницу достигнутых результатов по уровню лейкоцитоза (р=0,039<0,05), концентрации CD19 лимфоцитов (р=0,036<0,05) и ЦИК (р=0,0001<0,05). Полученные в ходе работы результаты во многом перекликаются с уже известными данными литературы [1, 6, 13].
Достигнутые уровни статистической значимости при сравнении отдаленных результатов проводимой иммуномодулирующей терапии не демонстрируют достоверно различных данных при сравнении показателей цитокинового статуса (TNF-альфа, IL-2, IL-4, IL-10), концентрации фракций Ig G, M, A, CD3, CD4, CD8, CD56 лимфоцитов (р>0,05). Таким образом, диагностика вторичного иммунодефицитного состояния пациентов с хроническим одонтогенным остеомиелитом должна строиться в первую очередь на объективных данных клинической картины заболевания. К тому же отсутствие клинических и лабораторных проявлений истинного иммунодефицита на момент начала лечения должны мотивировать специалистов к выбору препаратов иммунотропной направленности именно среди представителей иммуномодулирующего эффекта, способных обеспечить поддержание качества иммунного ответа и в конечном итоге сократить количество случаев хронизации инфекционного процесса.
В этой связи комбинация иммуномодуляторов Ликопид и Имунофан вполне удовлетворяет предъявляемым требованиям. Обоснование их эффективности в качестве средств профилактики хронического одонтогенного остеомиелита челюстных костей может быть основано на фармакокинетике действующих компонентов препаратов. Так, посредством связывания молекул ГМДП с внутриклеточным рецептором, главным образом достигается стимулирующее воздействие на цитотоксическую и бактерицидную активность фагоцитов, а также улучшение презентации ими антигенов Th2-лимфоцитам (CD4). В дальнейшем, на пути активации последними CD19 лимфоцитов, значимое влияние оказывают молекулы модифицированного тимопоэтина, действующего вещества Имунофана. Таким образом, в комплексной терапии острого одонтогенного остеомиелита комбинация иммуномодуляторов Ликопид и Имунофан контролирует всю цепочку иммунного ответа от фагоцитоза до активации B-лимфоцитов на синтез антител [9, 10].
Выводы
- Изменения лабораторных показателей иммунного статуса пациентов с острым одонтогенным остеомиелитом являются закономерной реакцией организма на развитие гнойно-воспалительного процесса, характеризуется выраженными лейкоцитарными реакциями, дисбалансом цитокинового статуса и не должны расцениваться как проявление вторичного иммунодефицитного состояния.
- Выраженность клинических показателей течения раневого процесса не имеет статистически достоверной зависимости от динамики изменения лабораторных данных иммунологической картины заболевания.
- Включение комплекса иммуномодуляторов Ликопид и Имунофан в программу базовой терапии острого одонтогенного остеомиелита не демонстрирует клинической эффективности на течении воспалительной фазы раневого процесса, но позволяет добиться снижения частоты хронизации на 11,9%
