Актуальность. Хондрома - доброкачественная опухоль, характеризующаяся образованием хорошо дифференцированной хрящевой ткани, нередко с очагами обызвествления и окостенения. Это довольно распространённая опухоль, по данным литературы, частота её составляет от 3 до 38% всех больных опухолями костной системой и до 84,4% среди всех доброкачественных поражений костей [3]. Большинство хондром располагается центрально в костно-мозговом канале – энхондромы. Гораздо реже хондрома располагается вне кости, в непосредственном контакте с прилегающей надкостницей – экхондрома (периостальная или юкстакортикальная хондрома) [1]
Лечение этих опухолей неоднозначно, и в тактике лечения нет согласованности. В то время, как ряд авторов считают целесообразным проведение обширных резекций в пределах здоровых тканей, которые впоследствии должны быть замещены костным материалом, другие авторы придерживаются более щадящей техники операций, ограничиваясь только внутриочаговой резекцией [4].
Необходимо подчеркнуть, что, по мнению многих исследователей, хондромы обладают потенциальной злокачественностью и способны малигнизироваться. По сводным данным, 5-8% хондром при длительном существовании трансформируются в хондросаркому. Именно поэтому многие клиницисты относятся к хондромам с большой настороженностью [3].
В Клиниках Самарского государственного медицинского университета (далее СамГМУ) располагается кафедра и клиника травматологии, ортопедии и экстремальной хирургии, которой руководит ректор СамГМУ, академик РАМН, д.м.н., профессор Г.П. Котельников, было принято решение провести экспериментальное исследование по изучению воздействия низкотемпературной плазмы на костную ткань с целью улучшения результатов лечения больных с доброкачественными опухолями скелета и псевдоопухолевых заболеваний костей. В процессе данного исследования костная ткань, подвергалась обработке при помощи аргоно-плазменного скальпеля различной мощности (от 20 до 120 Вт). В результате проведенных исследований получен патент РФ №2416367 от 20.04.2011 «Способ обработки костной ткани при хирургическом лечении доброкачественных опухолей скелета» [2].
Цель исследования – изучить патоморфологические изменения в костной ткани при воздействии плазмы и обосновать возможность применения плазменной деструкции в лечении больных с хондромами костей кисти.
Материалы и методы: для получения плазмы мы использовали аргоно-плазменную установку ERBE VIO 300D. Суть заключается в следующем: через электрическую дугу постоянного тока путем продувания инертного газа (аргона или гелия), работая в режиме коагуляции, плазменным потоком не более 1 мм. образуется плазма. Температура по оси плазменного тока достигает не более 10-20 тыс. градусов.
Морфологическое исследование: материалом служили фрагменты резецируемой костной ткани различной локализации, взятые интраоперационно, которые в дальнейшем подвергались обработке при помощи аргоно-плазменного скальпеля различной мощности (от 20 до 120 Вт). После макроскопической оценки объекты декальцинировали в 7% растворе азотной кислоты, после чего проводили в ацетонах и заливали в парафиновые блоки. Срезы толщиной до 7 мкм окрашивали гематоксилином и эозином, пикрофуксином по Ван-Гизон. Изучали светооптически при помощи микроскопа Nikon Alphaphot YS2-H, оснащённым цифровой видеокамерой. Морфометрическое исследование проводилось с помощью программы «Видео Тест-Морфо».
Результаты: микропрепараты были разделены на группы в зависимости от мощности используемого излучения. В первую подгруппу были включены препараты губчатой части кости. Результаты морфометрии были следующими. Мощность 20 Вт – глубина дефекта составила 2726±146,4 мкм. Мощность 40 Вт – 3074,4±137,8 мкм. Мощность 60 Вт – 4276,8±139,4 мкм. Мощность 80 Вт – 4576,3±141,5 мкм. Мощность 100 Вт – 4826,3±138,5 мкм. Мощность 120 Вт - 5071±137,6 мкм. При обработке кортикальной пластинки результаты морфометрического исследования были следующими. Мощность 20 Вт - 3721±101,4 мкм. Мощность 40 Вт - 3924±96,7 мкм. 60 Вт - 4075±88,8 мкм. 80 Вт - 4252±93,4 мкм. 100 Вт – 4476,5±98,8 мкм. 120 Вт – 4620,7±95,1 мкм.
Проведённые морфометрические исследования выявили прямую зависимость между мощностью применяемого излучения и глубиной зоны полной деструкции костной ткани. В области губчатой кости и кортикальной пластинки видна разница числовых показателей, которая связана с разной структурной организацией кости в этих зонах.
Оперативное вмешательство выполнялось в соответствии с топографо-анатомическими особенностями расположением патологического очага. Послойно обнажался соответствующий отдел кости, выполнялась резекция кортикального слоя в пределах здоровых тканей. Затем механически удалялось новообразование с помощью таких хирургических инструментов, как ложка Фолькмана. После тщательного просушивания полости приступали к обработке костной ткани плазмой. Источником плазмы служила установка плазменно-дуговая для рассечения и коагуляции тканей ERBE VIO 300D. Мощность потока плазмы определялась толщиной костной ткани в соответствующем отделе кости.
Далее выполнялась аутопластика образовавшегося дефекта участком крыла подвздошной кости. При риске образования патологического перелома использовали накостный остеосинтез.
Данный способ применяется при лечении больных с доброкачественными опухолями и опухолеподобными заболеваниями опорно-двигательной системы в отделениях взрослой ортопедии, детской ортопедии Клиник СамГМУ, а так же в отделении общей онкологии Самарского областного клинического онкологического диспансера (далее СОКОД). Всего предложенным способом было прооперировано 42 пациента с хондромами костей кисти различной локализации.
Клинический пример 1.
Пациентка Д., 27 лет, почувствовала острую боль и хруст в области II пястно-фалангового сустава левой кисти, когда одевала джинсы. После выполненной рентгенографии данного сегмента в лечебном учреждении по месту жительства был поставлен предварительный диагноз: хондрома II пястной кости левой кисти, патологический перелом (рис.1а). Пациентка после дообследования была госпитализирована в Клиники СамГМУ для оперативного лечения. Выполнено: экскохлеация очага, обработка образовавшейся костной полости при помощи аргоно-плазменной установки мощностью 60Вт. Аутопластика участком крыла левой подвздошной кости. Иммобилизация гипсовой лангетой 6 недель (рис. 1б). Пациентка наблюдается в условиях СОКОД в течение полутора лет.
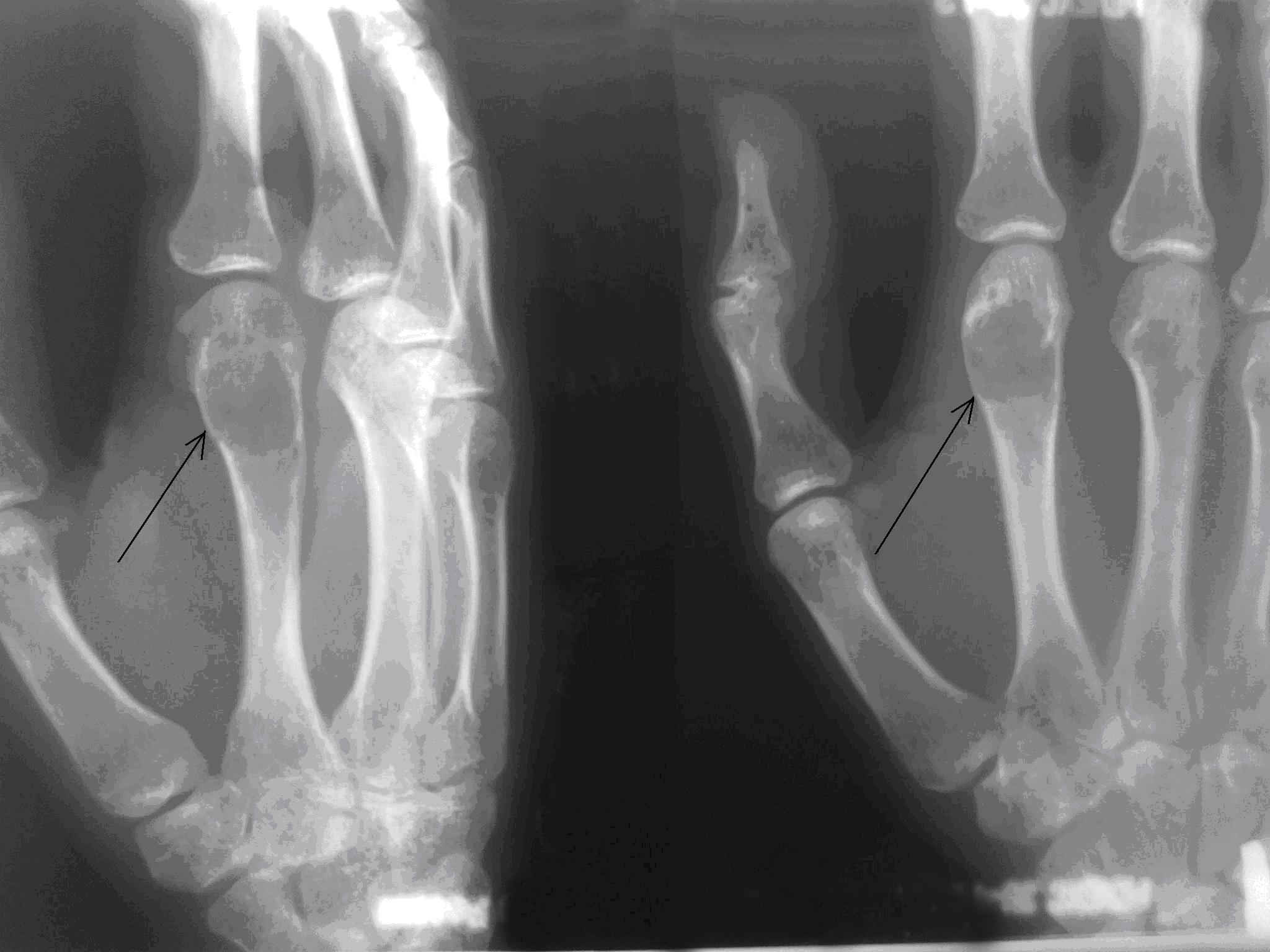
Рис. 1. а) Рентгенограмма левой кисти в прямой и боковой проекциях больной Д. до оперативного лечения (стрелками указана энхондрома II пястной кости).
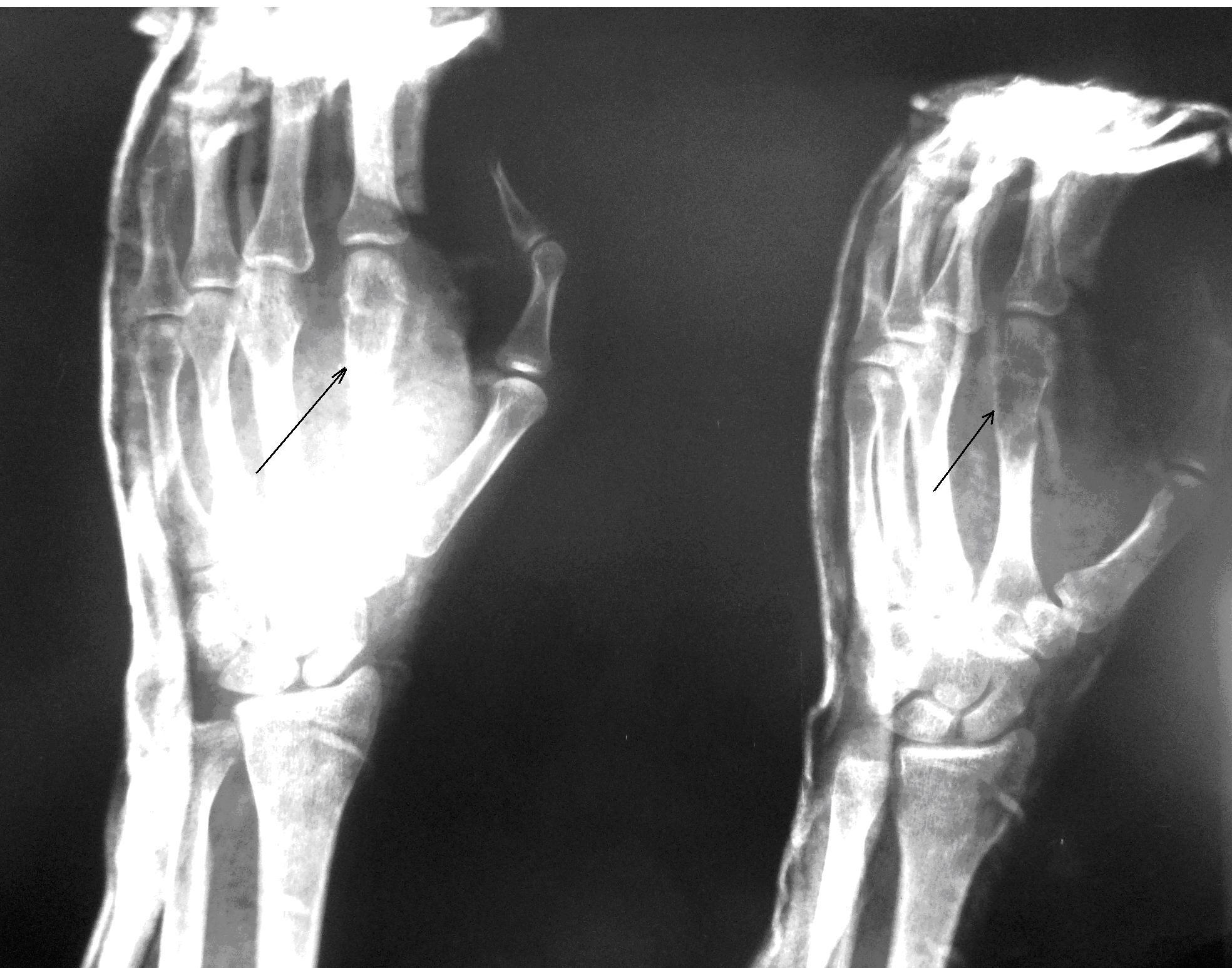
Рис. 1. б) Рентгенограмма левой кисти в прямой и боковой проекциях больной Д. после оперативного лечения спустя 3 дня, в гипсовой лонгете (стрелками указана зона экскохлеации).
Клинический пример 2.
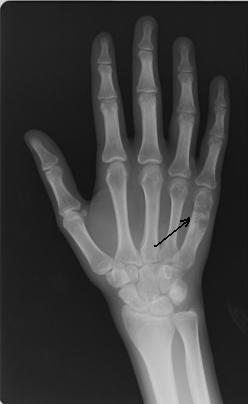
Пациентка Я., 34 года, заметила увеличение области V пястно-фалангового сустава левой кисти, через полгода начали беспокоить боли в данной области. Обратилась в СОКОД, после дообследования была госпитализирована в отделение общей онкологии с диагнозом: энхондрома V пястной кости левой кисти, для оперативного лечения (рис. 2а). Выполнено: экскохлеация очага, обработка образовавшейся костной полости при помощи аргоно-плазменной установки мощностью 60Вт. Аутопластика участком крыла левой подвздошной кости. Остеосинтез пластиной с винтами (рис. 2б). Иммобилизация гипсовой лангетой 6 недель. Пациентка наблюдается в условиях СОКОД в течение года.
 |
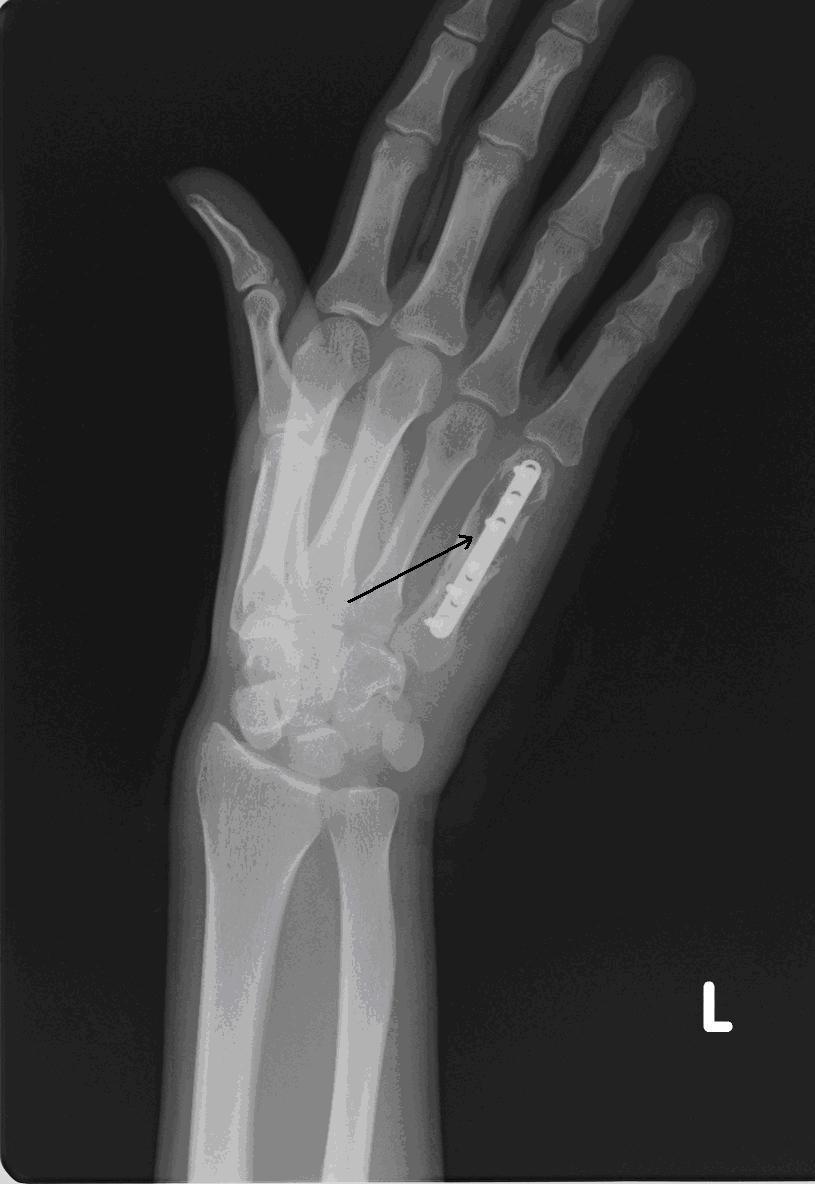 |
| Рис.2. а) Рентгенограмма левой кисти в прямой проекции больной Я. до оперативного лечения (стрелками указана энхондрома V пястной кости). | Рис. 2 б) Рентгенограмма левой кисти в прямой проекции больной Я. после оперативного лечения спустя 3 дня (стрелкой указана зона выполненной операции с наличием металлофиксатора). |
Все пациенты находились на диспансерном наблюдении в Самарском областном клиническом онкологическом диспансере. Данных за прогрессию процесса выявлено не было.
Вывод: полученные экспериментальные и клинические данные позволяют использовать обработку зоны резекции костной ткани потоком низкотемпературной плазмой, для получения зоны некроза, которая может способствовать улучшению результатов хирургического лечения больных с хондромами костей кисти.
